
Лекция 2.Мед.хим
.pdf
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Доц. Сидун М.С.
Содержание
I.Понятие о комплексных соединениях с точки зрения теории Льюиса.
II. Координационная теория А.Вернера и современные представления о строении комплексных соединений.
III. Равновесие в растворах комплексных соединений.Устойчивость комплексных соединений.
IV. Железо-, кобальто-, медь- и цинксодержащие комплексы. Функциональное строение порфиринов:
1)гемоглобин – строение,механизмы работы;
2)общий путь образования тетрапиррольных предшественников (синтез основы);
3)синтез гемоглобина;
4)биосинтез хлорофиллов.
V. Комплексоны и их применение в медицине (хелатотерапия).
І. Понятие о комплексных соединениях с точки зрения теории Льюиса.
Комплексными соединениями (КС) называют соединения, в узлах кристаллических решеток которых распределяются комплексные ионы, способные к существованию в растворе.
С точки зрения теории Льюиса КС – это такие соединения, которые образуются при взаимодействии с кислотами Льюиса и основаниями Льюиса по донорно-акцепторному механизму.
Например: В (1s22s22p1)
2p1
2s2
1s2
C молекулой фтора бор образует ковалентную связь BF3, но у бора есть свободная орбиталь. На эту свободную орбиталь претендует ион фтора F-, образуется комплексный йон [BF4]-. Бор является кислотой Льюиса, а ион
1

фтора F-, который имеет свободную пару электронов, – основанием Льюиса. Например,
BF3 + F- ↔ [BF4]- |
Co 3+ + 6NO2- ↔ [Co(NO2)6]3- |
|
кислота основание |
кислота |
основание |
Льюиса Льюиса |
Льюиса |
Льюиса |
II. Координационная теория А.Вернера и современные представления о строении комплексных соединений.
Впервые теоретическое обоснование и объяснение комплексные соединения получили в координационной теории А. Вернера (1893г.). В 1913 г. за координационную теорию Вернеру присуждена Нобелевская Премия. Согласно теории Вернера:
1) комплексные ионы состоят из:
а) центрального атома (комплексообразователя);
б) лигандов (аддендов).
Центральные атомы – ионы металлов Pt, Fe, Co, Ni, Cu с переменной валентностью, реже – атомы неметалла (B+3, S+4, P+4)
Лиганды – нейтральные молекулы воды, аммиака, а также анионы Cl-, F-, NO2- и другие кислотные остатки.
2)комплексообразователи кроме главных валентностей, обладают побочной
валентностью, за счет которой и образуются комплексные ионы. Например: [PtCl6]2-
Вэтом комплексном ионе 4 связи Pt–Cl образованы за счет главной валентности (ковалентная связь), а 2 связи за счет побочной валентности (по донорно-акцепторному механизму).
2-
Cl
Cl |
Cl |
Pt

Cl Cl
Cl
3)каждый центральный атом имеет свое координационное число (КЧ) - это число δ-связей, которые образует центральный атом в комплексном ионе (число лигандов).
Например, в комплексном ионе [Co(NO2)6]3- катион Co3+ – центральный атом (ц.а.); КЧ=6; группа NO2- – лиганд.
2
Координационное число бывает равно 4 или 6, но иногда может быть равно 2, 3, 8. КЧ изменяется с изменением степени окисления комплексообразователя: Pt2+ → КЧ=4; Pt4+ → КЧ=6
4)каждый лиганд характеризуется дентатностью – это число координационных мест (количество связей), которое занимает обычный лиганд.
Обычно: 1 лиганд – 1 координационное место (монодентатные), но есть лиганды, занимающие 2 координационных места (полидентатные).
Лиганд, образующий одну связь с комплексообразователем, - монодентатный: Cl-; I-; OH-; H2O; NH3 и т.д. Например, в комплексном ионе [HgI4]2- анион I- – монодентатный лиганд:
2-
I I
Hg
I I
Бидентатные лиганды: SO42-; CO32-; C2O42-, т.е. анионы двухосновных кислот. Например, в комплексном ионе [Hg(С2O4)2]2- оксалат анион (C2O42-) – бидентатный лиганд:
2-
O C O O C
C O O C O
O
+2
Hg
O C O O C
C O O C O
O
Пример полидентатного лиганда – ЭДТА (этилендиаминтетраацетат) или трилон Б.
Это кислота – четырехосновная, кроме того, возможно образование еще 2 связи по двум азотам (свободные электронные пары). ЭДТА – гексадентатный лиганд. ЭДТА является комплексом, который образует водорастворимые внутрикомплексные (хелатные) соединения.
-OOC |
|
CH2 |
CH2 |
|
COO- |
||
|
|
||||||
|
|
N CH2 |
|
CH2 N |
|
|
+ Ca2+ |
|
|
|
|||||
-OOC |
|
CH2 |
CH2 |
|
COO- |
||
3
-OOC CH2 |
H2C |
CH2 |
CH2 COO- |
|
N |
|
N |
CH2 |
Ca |
CH2 |
|
|
|
||
|
O |
O |
|
|
C |
|
C |
|
|
|
|
|
O |
|
O |
5)комплексообразователь и лиганды составляют внутреннюю среду комплекса (в квадратных скобках). Ионы, нейтрализующие заряд внутренней сферы – внешняя сфера комплекса.
n±
L L
An Me
LL
А– внешняя сфера; Ме – центральный атом; L – лиганды; [ ] – внутренняя
сфера
Например,
K4[Fe(CN)6]
K – внешняя сфера; Fe – ц.а.; CN – лиганды
III. Равновесие в растворах комплексных соединений. Устойчивость комплексных соединений.
Рассмотрим комплексную соль K4[Fe(CN)6]. Эта соль – сильный электролит, поэтому диссоциирует полностью:
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-
Комплексный ион – слабый электролит, и диссоциирует ступенчато. Устойчивость комплекса характеризуется диссоциацией комплексного иона, т.е. диссоциацией внутренней сферы.
I ступень [Fe(CN)6]4- ↔ [Fe(CN)5]3- + CN-
4
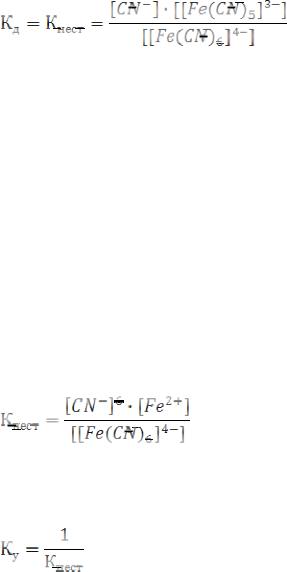
Константа диссоциации комплексного иона называется константа нестойкости:
II ступень [Fe(CN)5]3- ↔ [Fe(CN)4]2- + CN-
III ступень [Fe(CN)4]2- ↔ [Fe(CN)3]- + CN-
IV ступень [Fe(CN)3]- ↔ [Fe(CN)2] + CN-
V ступень [Fe(CN)2] ↔ [Fe(CN)]+ + CN-
VI ступень [Fe(CN)]+ ↔ Fe2+ + CN-
Суммарный процесс диссоциации:
[Fe(CN)6]4- ↔ Fe2+ + 6CN-
Общее значение константы нестойкости определяется произведением величин Кнест всех ступеней диссоциации:
Кнест = Кнест1 × Кнест2 × Кнест3 × Кнест4 × Кнест5 × Кнест6
Чем меньше величина Кнест, тем прочнее соединение.
Константа устойчивости – величина обратная константе нестойкости:
Константа устойчивости комплекса связана с термодинамическими функциями уравнения изотермы:
Go = -2.3RT·lgKy
Go – изменение стандартной энергии Гиббса (изобарно-изотермический потенциал)
Go = Ho – T So = -2.3RT·lgKy
Ho – стандартная энтальпия реакции;
So – изменение энтропии реакции.
5
Факторы, влияющие на Ку и термодинамические функции:
1. природа ц.а. и лиганда;
Например, хелатирующий лиганд – порфирин, макроциклическое соединение, донорные атомы в нем – 4 атома азота, в центре ион металла:
∙порфирин + Fe2+ → гем гемоглобина (небелковая часть молекулы гемоглобина);
∙порфирин + Со2+ → витамин В12;
∙порфирин + Mg2+ → хлорофилл;
Таким образом, комплексные соединения – огромный класс металлоферментов.
2. хелатный эффект.
Хелатный эффект также влияет на устойчивость комплексов. Металлы в растворах преимущественно связываются с хелатными лигандами, а не с монодентными – это и есть хелатный эффект.
Например: |
|
|
Ni2+ |
+ 2NH3 ↔ [Ni(NH3)2]2+ |
pK = 5 |
Ni2+ |
+ ЭДТА ↔ [Ni× ЭДТА] |
рК = 8 |
Чем больше рК, тем устойчивей комплекс, а потому Ni2+ связывается, отдавая преимуществo ЭДТА.
Конкурентное взаимодействие лежит в основе хелотерапии (лечение отравлений металлами свинца, ртути, которые являются промышленными ядами с помощью хелатных лигандов).
Металл-ион Hg2+ в организме образует хелатный комплекс с тиоловыми ферментами. Этот процесс успешно коррегируют с помощью ЭДТА (трилон Б), так как комплекс ртути с ЭДТА более устойчив по сравнению с тиоловым комплексом и таким образом фермент освобождается от яда.
3.суперхелатный эффект.
Смысл суперхелатного эффекта состоит в том,что металлы отдают преимущество макроциклическим лигандам (порфирин, гемоглобин, пероксидаза и др.).
Биокомплексы d-металлов с белковыми молекулами называются биокластерами. Внутри биокластера (трансферрин, ферритин, миоглобин и др.)
– пустота, в неё входит металл, который взаимодействует с донорными группами.
6
IV. Железо-, кобальто-, медь- и цинксодержащие комплексы. Функциональное строение порфиринов
Комплексные соединения в организмах обычно координируются ионами переходных металлов, например Mn, Co, Fe V(т.н. «биологически активных»). Содержание этих металлов в организмах очень мало, и уже из этого можно сделать предположение, что значение комплексов (доказанное прямым опытом
– это почти всегда так) должно быть связано с катализом, т.к. именно активные катализаторы могут способствовать быстрым изменениям состава вещества, действуя в малых концентрациях. Также, комплексы переходных металлов могут играть роль переносчиков групп атомов и целых молекул, закреплять молекулы в определенном положении, поворачивать их, поляризовать и т.п. Металлы-комплексообразователи относятся к группе «жизненно важных», т.е. присутствуют во всех здоровых тканях человека и диапазон их концентраций практически постоянен в каждой ткани, а исключение из организма приводит к тяжелым последствиям.
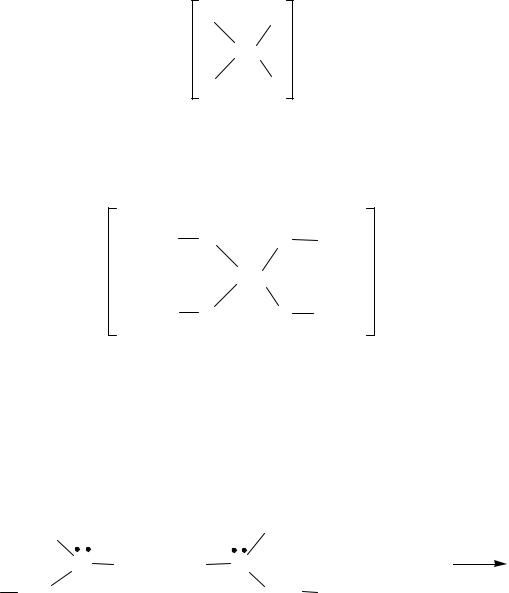
Для живых организмов (животных, растений, бактерий) очень важны комплексные соединения металлов, в которых четыре координационных места занимает одна и та же частица, называемая порфином, содержащая четыре пирролоподобных цикла, соединенных =СН-группами
Производными порфина являются порфирины. В порфиринах, в отличие от порфина, имеются боковые цепи вместо некоторых из 8 периферических пиррольных атомов водорода. Расположение и вид заместителей определяют название и специфические функции, соответствующего производного. В нормальном обмене веществ человека участвует т.н. Изомер III. Изомер I в значительных количествах появляется при довольно редком дефекте метаболизма. Остальные изомеры у человека не встречаются.
Некоординированные («чистые») порфирины не проявляют биологической активности в организме человека, они работают только в комплексе с металлами (гем – комплекс порфирина и иона железа). В некординированном виде порфирины встречаются в качестве пигментов в скорлупе яиц, птичьих перьях и покровах червей.
Порфирины – это ярко окрашенные соединения. К ним в настоящее время относятся представители многочисленного класса циклических ароматических соединений, содержащих многоконтурную сопряженную систему, в основе которой лежит шестнадцатичленный макроцикл, состоящий из четырех молекул пиррола и мостиков. У порфиринов, имеющих красный цвет, пирролы соединены между собой метиновыми мостиками, и тогда макроцикл носит название «порфин».
В хлорофиллах, для которых характерна зеленая окраска, частично гидрированы один или два пиррола и молекула носит название «хлорин» или «бактериохлорин». Для кобаламинов, важнейшим из которых является витамин
7
В12, все четыре кольца частично гидрированы и вместо одного метинового мостика имеется непосредственная связь между пирролами. Этот цикл называется коррином. В составе гемоглобина, миоглобина, цитохромов, каталазы и пероксидазы порфирины выступают в виде комплексов с ионами железа – гемов. Хлорофиллы и бактериохлорофиллы содержат магний. Витамин В12 и родственные ему кобаламины, как следует из названия, имеют в качестве центрального иона кобальт.
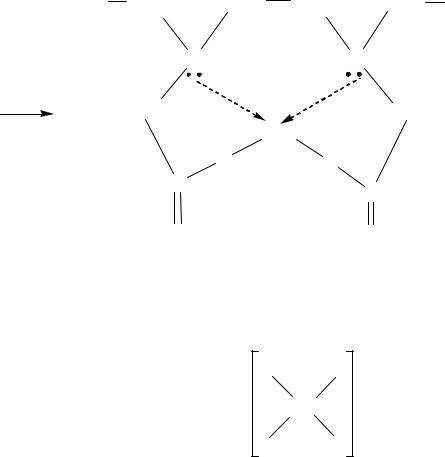
В организмах встречаются комплексы, в которых некоторые атомы водорода в порфине замещены на метильные и винильные остатки пропионовой кислоты (протопорфирины). Известны 15 возможных изомерных структур. Однако основной каркас этой сложной молекулы сохраняется во многих сложных веществах: гемоглобине, цитохромах, витамине В12. Ион металла замещает атомы водорода двух пиррольных колец. Связи металла с четырьмя атомами азота двух других пиррольных колец, которые лежат в одной плоскости, благодаря эффекту резонанса рассматриваются как одинаковые.
Важнейшим свойством порфиринов является наличие в молекуле координационной полости, ограниченной атомами азота, N4, имеющей радиус около 2Å и способной координировать ионы металлов М2+, М3+, М4+ и даже с большей степенью окисления. В результате комплексообразования образуются комплексные соединения порфиринов, т.н. металлопорфирины, обладающие многообразными структурными и химическими особенностями, высокой биологической и каталитической активностью. При этом металл либо занимает центр полости N4 и оказывается в экваториальной плоскости xy, образуя плоский координационный узел из атомов MN4, либо оказывается приподнятой над плоскостью, в которой лежат атомы N4 и образует координационные узлы различной геометрической структуры – от тетрагональной пирамиды L(MN)4 и октаэдра (L1)(L2)MN4 до более сложных геометрических фигур.
Выход центрального атома из плоскости происходит, как правило, при донорно-акцепторном взаимодействии с молекулой L. Если металл М способен присоединить вторую молекулу L той же природы с противоположной стороны плоскости xy, то он возвращается в центр плоскости N4. Лиганды (L1), способные вступать в координационную сферу металла, уже занятую четырьмя атомами азота порфирина, называются аксиальными.
Возможности молекул металлопорфиринов выступать в биологических процессах в качестве биокатализаторов (ферментов) значительно расширяется в связи с специфическим строением порфиринов и их комплексов, необычайным своеобразием их свойств и чрезвычайно большим структурным многообразием. Структурное многообразие связано с многочисленными путями химической модификации молекул порфина за счет замещения атомов водорода.
8
Известно большое число биологических систем, в структуре которых металлопорфирины выполняют функции инициатора того или иного биологического процесса. Например, гем в составе гемопротеидов участвует в транспорте кислорода (гемоглобин), клеточном дыхании (цитохромы), утилизации пероксидов (каталаза). Наибольшее число исследований посвящено гемоглобину, гему крови, и процессам обратимой фиксации атмосферного кислорода на биологических и модельных системах.
Рассмотрим функциональные особенности и механизмы работы гемоглобина, как наиболее хорошо изученные.
1) гемоглобин – строение, механизмы работы
Потребление атмосферного кислорода живыми организмами – важнейший биохимический процесс. Кислород транспортируется гемоглобином эритроцитов от легких к мышцам и удерживается в мышцах миоглобином. Гемоглобин и миоглобин представляют собой комплексы железа, в которых группа ферропротопорфирина (гема) содержит Fe (III) .
Пятое координационное число занимает азот имидазола (Im) гистидинового остатка, через который осуществляется единственная связь группы гема с полипептидной цепью белка. В настоящее время известны аминокислотный состав и последовательность аминокислот в гемоглобинах, выделенных из разных животных, места присоединения частиц гема, пространственная структура гемоглобина (работы Перутца и др.). Гем локализован в расщелине между спиралями белка. Одна молекула гемоглобина, состоящая из четырех белковых субъединиц (глобулл), содержит четыре гема и, следовательно, четыре атома железа. Поскольку кислород в гемоглобине непосредственно фиксируется железом, то такая молекула может, постепенно насыщаясь, присоединить четыре молекулы кислорода. В молекуле миоглобина полипептидная цепь координирована железом гем-группы так же как в гемоглобине. Однако, в отличие от гемоглобина молекула миоглобина состоит из одной белковой субъединицы и содержит одну гемовую единицу. Структуры окси- и дезокси-форм различны, и это различие не исчерпывается тем, что одна из них содержит молекулы кислорода, а другая – нет.
При отсутствии кислорода атом Fe (II) в гемоглобине имеет координационное число 5, связан донорно-акцепторными связями с четырьмя координирующими атомами азота протопорфирина и одной менее прочной связью с третичным атомом азота проксимального имидазольного фрагмента гистидина . Координационный узел Fe (N4) N Im представляет собой квадратную пирамиду с атомом железа, удаленным от основания пирамиды на 0.8 Å. Шестое координационное место не в состоянии занять ни один из имеющихся поблизости лигандов (в том числе и Н2О), кроме молекулярного кислорода. Молекула О2 вызывает оксигенирование гемоглобина, а точнее иона Fe (II). При этом комплекс Fe (N4) N Im из высокоспинового пирамидального
9
состояния в низкосипновое октаэдрическое искаженное состояние с координационным узлом Fe (N4) N Im (О2).
Под влиянием кристаллического поля N-донорных атомов порфирина, а также аксиальных лигандов (Im и О2 ) t42ge2g – конфигурация Fe (II) превращается в t62ge0g. На вакантные eg -орбитали переходят сигма-электроные пары имидазола и кислорода. Считают, что молекула О2 связывается в шестом координационном месте с Fe (II) также за счет дативной π-связи. Координированный ион железа поставляет пару электронов, находящуюся на его dyz (или dxz)-орбитали, на вакантную (разрыхляющую) pz-орбиталь молекулы О2. Образованию π-связи Fe (II) → О2 благоприятствует высокая электроннодонорная способность π-системы и проксимального имидазола. Атом железа после оксигенации входит в координационную плоскость N4 и располагается ценртосимметрично. Структура белка в гемоглобине такова, что он экранирует подход к атому Fe (II) всех других молекул, имеющихся в крови, и своевременно регулирует его донорно-акцепторные свойства. Исключение составляют токсиканты – яды крови, к которым относятся монооксид углерода, оксиды азота, метиленовый синий. Проникая с атмосферным воздухом в легкие, монооксид углерода быстро преодолевает капиллярноальвеолярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает в обратимое химическое взаимодействие как с окси-, так и с дезоксигемоглобином:
HbО2 + CO = HbCO + О2
Hb + CO = HbCO, где Hb – гемоглобин.
Образующийся комплекс карбоксигемоглобин (HbCO) не способен присоединять к себе кислород. В молекуле гемоглобина СО координируется атомом железа , вытесняя О2. Одна молекула гемоглобина (точнее, четыре её гема) может присоединить до четырех молекул СО.
Важным производным гемоглобина является метгемоглобин, в молекуле которого атом железа находится в степени окисления +3. Метгемоглобин не связывает молекулярный кислород. Он образуется при воздействии на гемоглобин окислителей (оксидов азота, метиленового синего, хлоратов). Образование метгемоглобина в крови уменьшает количество в ней функционально важного оксигемоглобина и нарушает доставку кислорода к тканям. Комплексы железа с порфиринами участвуют не только в транспорте кислорода, но и выполняют множество других функций. Среди них процесс переноса электронов.
2) общий путь образования тетрапиррольных предшественников
Начало исследований принято относить к 1945 году, когда молодой американский ученый Шемин поставил эксперимент на собственном организме, приняв порцию простейшей аминокислоты глицина, которая
10
