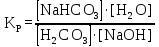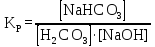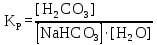- •Методические указания
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 2. Биогенные s- и p- элементы, биологическая роль, применение в медицине.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 3. Биогенные d- элементы; биологическая роль, применение в медицине
- •Теоретические вопросы
- •Набор заданий для контроля самоподготовки
- •Тема 4. Растворы. Электрофотоколориметрический метод определения концентрации растворов.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 5. Растворы. Перманганатометрия как метод объемного количественного анализа. Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 6. Комплексообразование в биологических системах.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 7. Коллигативные свойства растворов. Теоретические вопросы.
- •Информационный блок
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 8. Осмос и осмотическое давление.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 9. Кислотно-основное равновесие в организме. Водородный показатель биологических жидкостей.
- •Значение pH различных биологических жидкостей и тканей тела человека
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 10. Буферные системы, классификация и механизм действия.
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 11. Тепловые эффекты химических реакций. Химическая термодинамика.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 12. Кинетика биохимических реакций. Химическое равновесие.
- •Теоретические вопросы
- •Набор заданий для контроля самоподготовки
- •Тема 13. Сорбция биологически-активных веществ на границе раздела фаз.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 14. Дисперсные системы. Получение, очистка и свойства коллоидных растворов.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 15. Лиофобные золи и их свойства. Коагуляция. Коллоидная защита.
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Мицеллярная формула
- •Набор заданий для контроля самоподготовки
- •Тема 16. Свойства растворов биополимеров. Изоэлектрическая точка белка.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Лабораторный практикум s- и р-элементы.
- •Комплексные соединения.
- •Определение концентрации растворов.
- •Химическая термодинамика.
- •Коллоидные растворы
- •Свойства растворов вмс.
- •Список основной литературы
- •Дополнительная литература.
Тема 12. Кинетика биохимических реакций. Химическое равновесие.
Все процессы, которые происходят вокруг нас и внутри нас, идут с преобразованием энергии и с разной скоростью. Большое практическое значение химической кинетики состоит в том, что она разрешает определять, возможен или невозможен тот или иной процесс, и в каких условиях он происходит.
Положения химической кинетики, которая изучает скорости и механизмы реакций, с большим успехом применяются для изучения биохимических процессов, факторов, определяющих образование метаболитов в норме и патологии. В фармакологии изучение фармакокинетических характеристик лекарственных препаратов позволяет оценить его биодоступность и эффективность.
Теоретические вопросы
Предмет изучения химической кинетики. Определение и математическое выражение скорости реакции. Порядок и молекулярность реакций.
Факторы, влияющие на скорость реакции: концентрация, температура. Закон действующих масс. Константа скорости. Правило Вант-Гоффа.
Теория активных столкновений. Энергия активации. Уравнение Аррениуса.
Гомогенный и гетерогенный катализ. Понятие о ферментативном катализе в биологических системах.
Необратимые и обратимые реакции. Закон действующих масс для состояния химического равновесия. Направление смещения равновесия по принципу Ле-Шателье.
Набор заданий для контроля самоподготовки
Задание 1.
В организме человека реакция окисления этанола идет по уравнению:
С2Н5ОН + О2 → СН3СООН+ Н2О
Как изменится скорость реакции, если увеличить концентрацию этанола в 5 раз, порядок реакции по этанолу первый.
Уменьшится в 5 раз;
Уменьшится в 10 раз;
Увеличится в 10 раз;
Увеличится в 5 раз;
Увеличится в 25 раз.
Задание 2.
Под влиянием ферментов сахароза в организме человека превращается в глюкозу и фруктозу. Как изменится скорость этой реакции при увеличении температуры на 20°С (γ = 3)?
Уменьшится в 3 раза;
Уменьшится в 9 раз;
Увеличится в 6 раз;
Увеличится в 9 раз;
Увеличится в 27 раз.
Задание 3.
Скорость реакции увеличивается с повышением температуры. Укажите, во сколько раз она увеличится при повышении температуры реакции на 30°С , если температурный коэффитиент γ = 3.
3;
9;
12;
27;
81.
Задание 4.
Для характеристики смещения равновесия биохимических процессов пользуются значением величины константы равновесиия Кр. Укажите фактор, от которого зависит эта константа.
Природы реагирующих веществ и температуры.
Концентрации реагирующих веществ;
Давления;
Катализатора;
Энергии активации;
Задание 5.
Гидрокарбонат натрия, применяющийся в медицине при ацидозе, подвергается гидролизу по реакции:
NaHCO3 + H2O ↔ H2CO3 + NaOH
Определите константу равновесия (Кр) этой реакции на основании закона действующих масс.
Задание 6.
Ферменты – вещества белковой природы, которые управляют всеми биологическими функциями организма. Укажите температурный оптимум действия этих веществ в живом организме в градусах.
0-10
15-20
35-40
65-70
90-95