
- •Методические указания
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 2. Биогенные s- и p- элементы, биологическая роль, применение в медицине.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 3. Биогенные d- элементы; биологическая роль, применение в медицине
- •Теоретические вопросы
- •Набор заданий для контроля самоподготовки
- •Тема 4. Растворы. Электрофотоколориметрический метод определения концентрации растворов.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 5. Растворы. Перманганатометрия как метод объемного количественного анализа. Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 6. Комплексообразование в биологических системах.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 7. Коллигативные свойства растворов. Теоретические вопросы.
- •Информационный блок
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 8. Осмос и осмотическое давление.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 9. Кислотно-основное равновесие в организме. Водородный показатель биологических жидкостей.
- •Значение pH различных биологических жидкостей и тканей тела человека
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 10. Буферные системы, классификация и механизм действия.
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 11. Тепловые эффекты химических реакций. Химическая термодинамика.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 12. Кинетика биохимических реакций. Химическое равновесие.
- •Теоретические вопросы
- •Набор заданий для контроля самоподготовки
- •Тема 13. Сорбция биологически-активных веществ на границе раздела фаз.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 14. Дисперсные системы. Получение, очистка и свойства коллоидных растворов.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 15. Лиофобные золи и их свойства. Коагуляция. Коллоидная защита.
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Мицеллярная формула
- •Набор заданий для контроля самоподготовки
- •Тема 16. Свойства растворов биополимеров. Изоэлектрическая точка белка.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Лабораторный практикум s- и р-элементы.
- •Комплексные соединения.
- •Определение концентрации растворов.
- •Химическая термодинамика.
- •Коллоидные растворы
- •Свойства растворов вмс.
- •Список основной литературы
- •Дополнительная литература.
Тема 10. Буферные системы, классификация и механизм действия.
Постоянство величин рН биологических жидкостей является основой нормального функционирования организма. Механизм поддержания величин рН жидкостей на определенном уровне реализуется за счет работы внутренних органов (почки, печень, легкие) и физико-химических систем организма (буферные растворы).
Наиболее важными являются буферные системы крови, которые предотвращают изменение рН крови при попадании в нее органических кислот и основных продуктов метаболизма (аммиак, креатин).
Буферные системы можно классифицировать как органические (белковая, гемоглобиновая-оксигемоглобиновая) и неорганические (гидрокарбонатная, фосфатная). Неорганические буферы присутствуют как в плазме, так и в эритроцитах, белковый буфер локализован в плазме, а гемоглобиновый – в эритроцитах.
При проведении клинических исследований, широко применяют буферные растворы с определенным диапазоном значений рН, максимально приближенным к значениям рН биологических жидкостей. Подобное "моделирование" основных жидкостных сред организма позволяет изучать протекание биохимических процессов, рассматривать возможные изменения кислотного баланса при введении лекарственных средств и разрабатывать способы устранения подобных изменений.
Теоретические вопросы.
Классификация и основные компоненты буферных растворов.
Уравнения Гендерсона-Гассельбаха. Влияние разведения и концентрирование на величину рН буферов.
Механизм действия ацетатного и аммонийного буферных систем.
Буферная емкость и факторы, которые определяют данную характеристику.
Основные буферные системы организма, механизм их действия и расчет рН:
гидрокарбонатная;
фосфатная;
белковая;
гемоглобиновая-оксигемоглобиновая.
Кислотно-основное состояние крови. Резервная щелочность крови.
Решение обучающих задач.
Задача 1.
Фосфатный
буферный раствор, моделирующий фосфатную
буферную систему крови был приготовлен
смешением 100мл 0,1 М раствора Na2HPO4
и 50 мл 0,02 М раствора NaH2PO4,
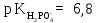 .
Определите рН буферного раствора.
.
Определите рН буферного раствора.
Эталон решения:
Для определения рН раствора используем уравнение:
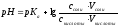 ;
;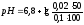 =
6,8 +lg10-1
= 5,8
=
6,8 +lg10-1
= 5,8
Задача 2.
Определите буферную емкость крови по кислоте если известно, что добавление 20 мл 0,01М раствора соляной кислоты к 100 мл крови вызывал изменение рН образца от 7,35 до 6,55.
Эталон решения:
1. В результате добавления соляной кислоты к образцу крови ее рН изменялось от 7,35 до 6,55. Рассчитаем значение рН
рН = 7,35 – 6,55 = 0,8
2. Для определения буферной емкости крови используем уравнение:

Набор заданий для контроля самоподготовки
Задание 1.
Для проведения биохимических исследований необходимо приготовить буферную систему путем смешивания растворов CH3COOH и CH3COONa. Определите тип данного буферного раствора.
Кислотный;
Основной;
Солевой;
Амфотерный;
Изотонический.
Задание 2.
С целью изучения кинетической активности фермента необходимо задать кислотность реакционной среды рН≈8 и поддерживать ее на постоянном уровне. Определите вещества, которые могут быть для этого использованы.
NH4OH и HCl;
NH4OH и NH4Cl;
NH4Cl и HCl;
NaOH и NH4Cl;
NaOH и HCl.
Задание 3.
При проведении клинических исследований к образцу мочи больного было добавлено небольшое количество соляной кислоты. Однако, это не привело к изменению рН, а вызвало увеличение концентрации одного из неорганических компонентов. Определите данный ион.
PO43-;
HPO42-;
HPO4-;
H2PO42-;
H2PO4-.
Задание 4.
Для определения влияния различных факторов на кинетическую активность фермента карбоангидразы, необходимо приготовить гидрокарбонатный буфер, который моделирует основную буферную систему крови. Определите компоненты данной системы.
H2CO3/HCO3-;
H2CO3/CO32-;
HCO3-/CO32-;
H2CO3/CO2;
H2O/CO2.
Задание 5.
Для
определения содержания фосфат-ионов в
образце крови было установлено, что
рН=7,4. При условии, что
 ,
рассчитайте приблизительное соотношение
компонентов фосфатного буфера
[HPO42-]/[H2PO4-].
,
рассчитайте приблизительное соотношение
компонентов фосфатного буфера
[HPO42-]/[H2PO4-].
0,25;
1;
2;
4;
8.
Задание 6.
Для подтверждения буферного действия растворов альбуминов крови, к двум образцам были добавлены небольшие количества неорганической кислоты и щелочи. При этом изменения рН не наблюдалось. Определите свойство белков, которое это обусловливает.
Растворимость;
Наличие небелкового компонента;
Амфотерность;
Кислотность;
Основность.
