
- •Реакції катіонів першої аналітичної групи
- •1. Дія натрій гідрогентартрату NaНс4н4о6
- •2.Дія винної кислоти h2c4h4o6
- •3. Дія натрій гексанітрокобальтату (III) Na3[Со(nо2)6]
- •4. Мікрокристалоскопічна реакція
- •5. Реакція забарвлення полум'я солями Калію
- •1. Дія калій гексагідроксостибату(V) к[Sb(он)6]
- •2. Мікрокристалоскопічна реакція. Дія цинк триураніл октаацетату Zn(uo2)3(сн3соо)8.
- •Контрольна задача. Аналіз суміші катіонів першої аналітичної групи.
- •Реакції катіонів другої аналітичної групи
- •1. Дія 2м розчину хлоридної кислоти
- •2. Дія розчинів лугів
- •3. Дія розчину амоніаку
- •4. Дія розчину калій хромату к2СrО4
- •5. Дія розчину калій іодиду
- •8. Дія натрій гідроген фосфату(V) (Na2hpo4).
- •9. Дія калій гексаціаноферрату (ііі) (k3[Fe(cn)6]).
- •10. Дія натрій тіосульфату (Na2s2o3).
- •11. Дія натрій сульфіду (Na2s).
- •12. Дія розчинних карбонатів (МехСо3).
- •Контрольна задача. Аналіз суміші катіонів другої аналітичної групи
- •1. Осадження хлоридів катіонів II групи
- •Реакції катіонів третьої аналітичної групи
- •1. Дія 1м розчину сульфатної кислоти
- •2. Дія карбонатів
- •3. Дія хроматів
- •4. Дія насичених розчинів амоній сульфату і амоній оксалату
- •6. Реакція забарвлення полум'я солями Барію, Стронцію, Кальцію
- •8. Реакція з динатрій гідрогенфосфатом Na2hpo4.
- •Контрольна задача. Аналіз суміші катіонів третьої аналітичної групи
- •2. Відокремлення йонів стронцію і кальцію
- •3. Виявлення і відокремлення йонів стронцію
- •4. Виявлення йонів кальцію
- •Лабораторна робота 4. Аналіз суміші катіонів першої, другої та третьої аналітичних груп
- •Аналіз розчину без осаду
- •2. Виявлення катіонів калію.
- •3. Виявлення катіонів натрію.
- •4. Проба па наявність у розчині катіонів II аналітичної групи та їх відокремлення.
- •5. Виявлення катіонів II аналітичної групи.
- •6. Проба на наявність у розчині катіонів III аналітичної групи та їх відокремлення.
- •7. Відокремлення плюмбум (II) сульфату.
- •8. Переведення сульфатів III аналітичної групи в карбонати.
- •9. Розчинення осаду карбонатів та виявлення катіонів III аналітичної групи.
- •Аналіз розчину з осадом
- •2. Відокремлення катіонів II і III аналітичних груп.
- •3. Виявлення і відокремлення плюмбум (іі)-катіонів.
- •4. Виявлення димеркурій (і)-катіопів.
- •5. Виявлення аргентум (і)-катіопів.
- •7. Виявлення катіонів ііі аналітичної групи.
- •8. Виявлення натрій- і калій-катіонів.
- •Реакції катіонів четвертої аналітичної групи
- •1.Дія алізарину
- •2. Дія кобальт (II) нітрату
- •3. Реакція з натрій ацетатом ch3cooNa.
- •4. Реакція з натрій тіосульфатом Na2s2o3.
- •3. Окиснення сполук хрому (VI) до СrO5
- •1.Дія гідроген сульфіду н2s
- •2. Дія розчину калій гексаціаноферату (II) к4[Fе(сn)6]
- •3. Дія дитизону
- •4. Реакція сухим способом з солями Кобальту (іі).
- •Реакції сполук Арсену (Обережно! Сполуки Арсену отруйні)
- •1.Реакція відновлення арсену (iiі) і арсену (V) до АsН3
- •2. Реакція окиспепня сполук Аs(ііі)
- •3. Реакція відновлення сполук арсену (V)
- •Реакції стануму (II) та стануму (IV)
- •1. Реакція з гідроген сульфідом
- •2. Реакція окиснення стануму (II) солями бісмуту (III)
- •3. Реакції відновлення стануму (IV) до стануму (II)
- •4. Виявлення йонів СгО42– і АsО43–
- •Реакції катіонів п'ятої аналітичної групи
- •1. Дія розчину калій гексаціаноферату (III) к3[Fе(сn)6]
- •3. Реакція з диметилгліоксимом (реактивом Чугаєва).
- •1. Дія розчину калій гексаціаноферату (II) к4[Fе(сn)6]
- •2. Дія розчину амоній тіоціанату nн4sсn
- •3. Реакція з натрій ацетатом ch3cooNa.
- •4. Реакція з калій йодидом ki.
- •5. Дія натрій тіосульфату Na2s2o3
- •1. Дія розчину дії натрій гідрогенфосфату Na2hро4
- •4. Реакція з калій гексаціаноферратом(ііі) k3[Fe(cn)6].
- •1. Дія калій іодиду
- •2. Дія свіжоприготовлеіюго розчину натрій тригідроксостапату (II)Na[Sп(он)3]
- •3. Реакція гідролізу.
- •4. Реакція з сульфідами.
- •5. Реакція з тіосечовиною cs(nh2)2 або тіоціанатами.
- •Реакції стибію (III) і стибію (V)
- •1. Дія натрій тіосульфату Na2s2o3
- •2. Відновлення стибію (III) і стибію (V) до металевого стибію
- •Контрольна задача. Аналіз суміші катіонів п'ятої аналітичної групи
- •2. Осадження основних солей Бісмуту і Стибію
- •3. Відокремлення та виявлення стибію (iiі)
- •4. Виявлення бісмут (III)- катіонів
- •5. Відокремлення манган (II), ферум (II, iiі)-, магній- катіонів
- •Реакції катіонів шостої аналітичної групи
- •1. Дія розчинів лугів
- •2. Дія розчину амоніаку
- •3. Дія гідроген сульфіду
- •1. Дія амоніаку
- •2. Дія калій гексаціаноферату (II) к4[Fе(сn)6]
- •3. Дія натрій тіосульфату Nа2s2о3
- •4. Дія калій тіоціанату (kscn).
- •5. Дія металів, що більш активні за мідь (Fe, Zn, Al).
- •6. Дія калій йодиду (ki).
- •6. Дія розчинних карбонатів (МехСо3).
- •1. Дія амоній тіоціанату nн4sсn
- •3. Реакція сухим способом
- •4. Дія натрій гідроген фосфату(V) (Na2hpo4).
- •5. Дія калій гексаціаноферрату (ііі) (k3[Fe(cn)6]).
- •1. Реакція з диметилгліоксимом (реактивом Чугаєва)
- •2. Дія натрій гідроген фосфату(V) (Na2hpo4).
- •4. Дія амоній тіоціанату (nh4scn).
- •5. Дія калій хромату (k2CrO4).
- •6. Дія розчинних карбонатів (МехCo3).
- •7. Дія дифенілкарбазиду (або дифенілкарбазону).
- •1. Реакція з гідроген сульфідом н2s
- •2. Реакція з дифенілкарбазидом
- •3. Реакція з розчином амоніаку і калій йодидом.
- •Контрольна задача. Аналіз суміші катіонів шостої аналітичної групи
- •Лабораторна робота 8. Аналіз суміші катіонів четвертої-шостої алітичних груп
- •1. Попередні дослідження.
- •2. Відокремлення катіонів четвертої аналітичної групи.
- •3. Аналіз суміші катіонів четвертої аналітичної групи.
- •4. Відокремлення катіонів п'ятої аналітичної групи.
- •5. Аналіз суміші катіонів п’ятої аналітичної групи.
- •6. Аналіз суміші катіонів шостої аналітичної групи.
- •Лабораторна робота 9. Аналіз суміші катіонів першої-шостої аналітичних груп
- •1. Попередні спостереження та дослідження.
- •Аналіз суміші катіонів першої-шостої аналітичних груп без осаду
- •2. Відокремлення та виявлення катіонів другої аналітичної групи.
- •3. Відокремлення та виявлення катіонів третьої аналітичної групи.
- •5. Відокремлення та аналіз катіонів IV аналітичної групи.
- •6. Відокремлення катіонів V аналітичної групи.
- •7. Аналіз суміші катіонів V аналітичної групи.
- •8. Аналіз суміші катіонів шостої аналітичної групи.
- •Аналіз суміші катіонів першої-шостої аналітичних груп з осадом
- •3. Відокремлення катіонів II та III аналітичних груп.
- •7. Відокремлення Нg, HgNh2Сl.
- •8. Відокремлення РbSо4.
- •9. Виявлення катіонів III аналітичної групи.
- •10. Аналіз центрифугату (і) (розділення та виявлення катіонів іv-vі аналітичних груп).
- •Реакції та аналіз аніонів. Аналіз сухої речовини.
- •Лабораторна робота 10. Реакції та аналіз аніонів першої аналітичної групи sо,sо,со,f–, s2o32–, b4o72–, ро, с2о,SiO.
- •Реакції аніонів першої аналітичної групи
- •1. Дія розчину барій хлориду
- •2. Дія розчину аргентум нітрату
- •Реакції сульфат-іонів
- •1. Дія розчинних солей плюмбуму (II)
- •Реакції сульфіт-іонів
- •1. Дія окисників
- •2. Дія мінеральних кислот
- •Реакції оксалат-іонів
- •1. Дія розчину кальцій хлориду
- •2. Дія розчину калій перманганату (калій тетраоксоманганату (VII))
- •Реакції фторид-іонів
- •1. Дія розчину кальцій хлориду
- •2. Дія розчину ферум (ііі) хлориду
- •Реакції карбонат-іонів
- •1. Дія мінеральних кислот
- •Реакції фосфат-іонів
- •1. Дія магнезіальної суміші
- •2. Дія молібденової рідини
- •Реакції силікат-іонів
- •1. Дія мінеральних кислот
- •2. Дія солей амонію
- •Реакції тетраборат-іонів
- •1. Дія розчину аргентум нітрату
- •2. Дія розчину меркурій(іі) нітрату
- •3. Реакція на забарвлення полум’я
- •Реакції тіосульфат-іонів
- •6. Виявлення фосфат-іонів ро43–
- •7. Виявлення оксалат-іонів с2о42–
- •Реакції аніонів другої і третьої аналітичних груп Реакції хлорид-іонів
- •1. Дія групового реагенту АgNо3
- •2. Дія окисників
- •Реакції бромід-іонів
- •1. Дія групового реагенту АgNо3.
- •2. Дія хлорної води
- •Реакції іодид-іонів
- •1. Дія групового реагенту АgNо3
- •2. Дія плюмбум (II) нітрату Рb(no3)2
- •3. Дія хлорної води
- •Реакції сульфід-іонів
- •3. Дія розчину ферум (ііі) хлориду
- •Реакції нітрат-іонів
- •1. Дія дифеніламіну (с6н5)2nн
- •2. Дія ферум (II) сульфату FеSо4
- •Реакції нітрит-іонів
- •1. Дія калій іодиду кі
- •2. Дія кислот
- •3. Дія тіосечовини (nh2)2cs і сечовини ((nh2)2co)
- •4. Дія солей Кобальту (іі)
- •Реакції ацетат-іонів
- •1. Дія сульфатної кислоти
- •2. Дія ферум (III) хлориду FеСl3
- •3. Дія сульфатної кислоти і етилового спирту.
- •Контрольна задача. Аналіз суміші аніонів другої та третьої аналітичних груп
- •1. Виявлення та відокремлення аніонів II групи
- •2. Виявлення хлорид-іонів Сl–
- •3. Виявлення бромід-іонів Br– та іодид-іонів I–
- •4. Відокремлення сульфід-іонів s2–
- •5. Виявлення нітрит-іонів nо2–
- •6. Виявлення нітрат-іонів no3–
- •7. Виявлення ацетат-іонів сн3соо–
- •Лабораторна робота 12. Аналіз сухої речовини
- •Аналіз речовини, розчинної у воді
- •1. Виявлення катіонів I аналітичної групи
- •2. Виявлення катіонів II аналітичної групи
- •3. Виявлення катіонів III аналітичної групи
- •4. Виявлення катіонів IV аналітичної групи
- •5. Виявлення катіонів V аналітичної групи
- •6. Виявлення катіонів VI аналітичної групи
- •7. Виявлення аніонів і аналітичної групи
- •8. Виявлення аніонів II аналітичної групи
- •9. Виявлення аніонів iiі аналітичної групи
- •Аналіз речовини, нерозчинної у воді
- •1. Розчинення плюмбум (п) сульфату РbSо4
- •2. Розчинення аргентум хлориду та броміду АgСl, АgВг
- •3. Розчинення аргентум іодиду АgІ
- •4. Розчинення сульфатів ВаSо4, СаSо4, SrSо4
2. Дія розчину амоній тіоціанату nн4sсn
Тіоціанат-іони з катіонами Fе3+ утворюють комплексну сполуку Fе(SСN)3 (lg3 = 5,0), яка має червоне забарвлення. Реакцію необхідно проводити в кислому середовищі при рН=2. При надлишку реагенту (NН4SСN, КSСN) утворюються порівняно стійкі комплексні йони з більшим координаційним числом: [Fe(SСN)4]– (lg4 = 6,3), [Fе(SСN)5]2– (lg5 = 6,2), [Fе(SСN)6]3– (lg6 = 6,1), які також мають червоне забарвлення.
Реакція дуже чутлива. Користуючись нею, можна виявити у розчині йони Fe3+ при граничному розведенні 200000 см3/г. Чутливість підвищується, якщо долити до суміші трохи ізоамілового спирту, який екстрагує забарвлену комплексну сполуку.
Виявленню йонів Fе3+ заважають йони, які з ними утворюють більш стійкі комплекси, ніж тіоціанатні. Це флуорид-іони ([FeF3], lg3 = 12,1), оксалат-іони ([Fе(С2О4)3]3–, lg3 = 18,49), ціанід-іони ([Fe(СN)6]3–, lg6 = 43,6).
Дослід. До 1-2 крапель розчину FеСl3, додайте 4-6 крапель води і 1-2 краплі розчину NH4SСN. Зазначте аналітичний ефект. До цієї суміші долийте 1 мл розчину Н2С2О4. Що спостерігається?
3. Реакція з натрій ацетатом ch3cooNa.
При дії надлишку натрій ацетату на розчин солей Феруму(ІІІ) утворюються комплексні катіони змінного складу, що при нагріванні сильно гідролізують з утворенням основного ферум ацетату:
3FeСl3 + 9CH3COONa + 5H2O Fe3(OH)2O3CH3COO + 9NaCl + 8CH3COOH
Дослід. До 4–5 краплин розчину солі Феруму (ІІІ) додають 9–10 крапель розчину натрій ацетату, потім додають 5–7 крапель дистильованої води, перемішують і нагрівають до кипіння.
4. Реакція з калій йодидом ki.
Йодид-іони відновлюють іони Fe3+ до Fe2+, при цьому утворюється вільний йод, що забарвлює розчин в бурий колір (або при наявності крохмалю – в темно-синій):
2Fe3+ + 2I– 2Fe2+ + I2.
5. Дія натрій тіосульфату Na2s2o3
При реакції катіонів Fe3+ з тіосульфат-іонами утворюється комплексна сполука темно-фіолетового кольору, яка швидко руйнується внаслідок окисно-відновної реакції, в якій Fe3+ є окисником:
Fe3+ + 2S2O32– [Fe(S2O3)2]–
2[Fe(S2O3)2]– 2Fe2+ + S4O62– + 2S2O32–
Дослід. До 5–7 краплин розчину солі Феруму (ІІІ) додають 7–8 крапель розчину натрій тіосульфату, спостерігають за змінами забарвлення розчину.
Реакції катіонів Мg2+
1. Дія розчину дії натрій гідрогенфосфату Na2hро4
Катіони Мg2+ утворюють з розчином Na2НРО4, при наявності амоніачного буферного розчину, кристалічний осад подвійної солі магній амоній фосфату:
Мg2+ + НРО42– + NН3.Н2О МgNН4РО4 + Н2О.
Хлорид амонію додають для того, щоб запобігти утворенню аморфного осаду Мg(ОН)2.
Умови проведення досліду:
реакція проводиться в амоніачному середовищі при 9,4 < рН < 10,8;
надлишок йонів NH4+ заважає утворенню осаду МgNН4РО4;
катіони усіх аналітичних груп, крім першої, заважають проведенню реакції.
Дослід. До 2-3 крапель розчину магній хлориду додайте 1-2 краплі розчину NН4Сl, 1-2 краплі розчину амоніаку і 2 краплі розчину Na2НРО4. Якщо осад не утворюється, потріть внутрішню стінку пробірки скляною паличкою, дайте постояти.
2. Дія 8-оксихіноліну
8-оксихінолін з йонами Мg2+ утворює зеленувато-жовтий кристалічний осад магній оксихіноляту. Умови реакції: амоніачно-лужне середовище, відсутність іншіх катіонів п’ятої аналітичної групи. Цій реакції також заважають катіони третьої аналітичної групи.
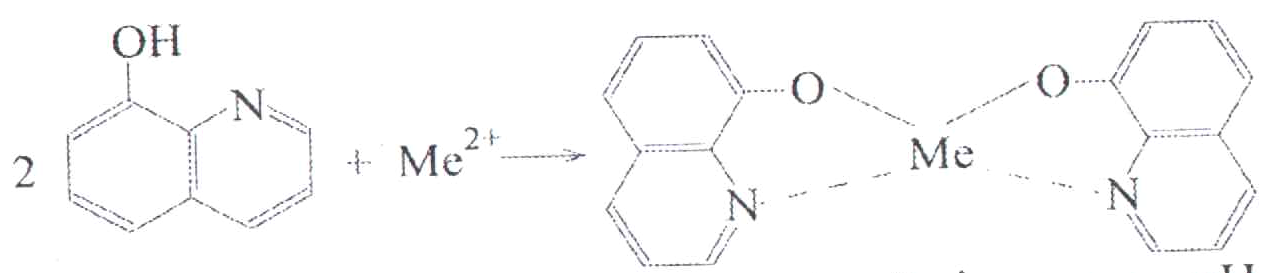
Дослід. До 5–10 крапель розчину солі Магнію додайте 5-10 крапель розчину амоніаку, перемішайте. Додайте розчин NН4Сl до повного розчинення осаду Мg(ОН)2 і 3-5 крапель спиртового розчину 8-оксихіноліну (з масовою часткою 5%). Що спостерігається?
Реакція з калій гексаціаноферратом(ІІ) K4[Fe(CN)6].
Іони Магнію на холоді дають з калій гексаціаноферратом(ІІ) білий осад дикалій магній гексаціаноферрату(ІІ) K2Mg[Fe(CN6)]. В присутності солей амонію утворюється менш розчинна сіль гексаціаноферрату калію, магнію і амонію змінного складу (приблизна формула – K(NH4)Mg[Fe(CN6)]).
Дослід. До 3–5 краплин розчину солі Магнію додають таку саму кількість розчину NH4Cl, концентрованого розчину амоніаку до появи запаху і 5–7 крапель насиченого розчину K4[Fe(CN)6]. Випадає білий кристалічний осад, який не розчиняється в оцтовій кислоті (іони барію утворюють аналогічний осад і тому заважають проведенню цієї реакції).
Реакції катіонів Мn2+
1. Окиснення катіона Мn2+ до аніона МnО4 –
Ця реакція має дуже велике значення, оскільки дає можливість виявити йони Мn2+ у присутності катіонів усіх аналітичних груп. Як окисники можна використовувати плюмбум (IV) оксид (РbО2), диамоній пероксодисульфат ((NH4)2S2О8) та інші сильні окисники, окисно-відновний потенціал яких більше 1,51 В.
Окиснення йона Мn2+ окисником РbО2 (реакція Крума) відбувається за таким рівнянням реакції:
2Мn2+ + 4Н+ + 5РbО2 2МnO4– + 5Рb2+ + 2Н2О .
Умови проведення цієї реакції: кисле середовище (рН=2), нагрівання, манган (II) хлорид брати не можна, оскільки аніони-відновники заважають окисненню йона Мn2+ до МnО4–. Тому при проведенні цієї реакції при наявності у розчині йонів хлору їх усувають розчином аргентум нітрату (кілька крапель).
Заважає цій реакції також надлишок двовалентних йонів мангану Мn2+, які відновлюють перманганатну кислоту до темно-бурого осаду МnО2.nН2О.
Дослід. У пробірку з 1 краплею дуже розведеного розчину солі МnSО4 долийте 1-2 мл концентрованої нітратної кислоти, додайте небагато порошку РbО2 і нагрійте суміш до кипіння. Дайте відстоятись. Фіолетове забарвлення розчину свідчить про утворення МnО4–- аніона.
Окиснення йона Мn2+диамоній пероксодисульфатом відбувається за рівнянням реакції:
2Мn2+ + 5S2О82– + 8Н2О 2МnО4– + 10SО42– + 16Н+.
Умови проведення цієї реакції такі, як і з РbО2.
Дослід. До 4-5 крапель 2М розчину НNО3 додайте дві краплі розчину АgNО3, кілька кристалів (NН4)2S2О8 і нагрійте до 50-60°С. У нагріту суміш додайте за допомогою скляної палички 1 краплю розчину МnSО4, перемішайте. Зазначте аналітичний ефект.
2. Окиснення катіона Мn2+ до МnО2 (в лужному середовищі)
До утвореного в результаті реакції з лугами білого осаду Mn(OH)2 додають один з розчинів-окисників (H2O2, KClO3, бромна або хлорна вода) і нагрівають до кипіння. Осад змінює свій колір на чорно-бурий. Мінімальна концентрація Mn2+ яку можна визначити даною реакцією 3–5 мг/дм3. В суміші реакції заважають іони Fe2+, Fe3+, Cu2+, Co2+, Ni2+, Ag+, Hg2+, Hg22+.
Mn(OH)2 + H2O2 MnO(OH)2 + H2O
Mn(OH)2 + Cl2 + 2OH– MnO(OH)2+ 2Cl– + H2O
Дослід. До 4-5 крапель розчину солі Мангану (ІІ) додайте розчин лугу до випадіння осаду. Потім додають декілька краплин розчинів вказаних вище окисників і нагрійте до кипіння. Зазначте аналітичний ефект.
3. Окиснення катіона Мn2+ до МnО4– (в лужному середовищі)
Окиснення іону Mn2+ до MnO4– в лужному середовищі відбувається за наявності каталізатору, яким є іони Cu2+.
2Mn2+ + 5Br2 + 16OH– 2MnO4– + 10Br– + 8H2O
Дослід. До 1-3 крапель розчину солі Мангану (ІІ) додайте 4–5 мл лужного розчину хлорної або бромної води і 7–8 краплин розчину CuSO4. Перемішайте суміш струшуванням і обережно (рідину може викинути з пробірки!) нагрівайте до кипіння. Дайте осаду CuO осісти. Зафіксуйте забарвлення осаду над розчином.
