
- •CURS2:
- •Farmacodinamia
- •RECEPTORII
- •Ineracţiunea medicament – receptor
- •Proprietăţile receptorilor
- •Tipuri de acţiune medicamentoasă
- •Relaţia doză – efect
- •♦ Dozele în studiul clinic
- •Farmacoepidemiologia
- •Reacţii adverse de tip I
- •Reacţii adverse de tip II
- •2. Studii transversale
- •Prescrierea raţională a medicamentelor
- •INTERACȚIUNI MEDICAMENTOASE (vezi lp nr. 19)
- •CRONOFARMACOLOGIA
- •Bioritmurile sunt considerate mecanisme prin care organismele pot măsura timpul şi spaţiul. Sunt adevărate ceasornice biologice cvadri sau pluridimensionale.
- •Orice ritm poate fi schematizat printr-o armonică sinusală sau oscilaţie de relaxare.
- •Bioritmul este alcătuit din următoarele elemente:
- •faza - poziţia începutului oscilaţiei faţă de punctul de origine.
- •Ritmurile biologice au următoarele proprietăţi:
- •FARMACOGENETICA
- •DEFINIŢII
- •Citocromul P450s
- •Citocromul P450 CYP2D6
- •EuEu
- •Posibilităţi şi tendinţe actuale în farmacogenetică
- •ANESTEZICE LOCALE
- •TIPURI DE ANESTEZICE
- •B). Anestezice cu structură esterică – au durată de acţiune mai scurtă (20-60 min.) şi potenţă scăzută; sunt rapid inactivate de colinesterazele plasmatice. Exemple : Procaina , Clorprocaina.
- •Antisepticele sunt substanţe bactericide sau bacteriostatice cu acţiune asupra germenilor aflaţi pe ţesutul viu (piele, mucoase, cavităţi naturale, plăgi).
- •Mecanisme de acţiune
- •Mod de acţiune al antisepticelor şi dezinfectantelor
- •BIBLIOGRAFIE SELECTIVĂ

Farmacologie
Facultatea de Medicina Dentara
FARMACOLOGIE
- SUPORT DE CURS –
-
CURS 1
FARMACOLOGIA este ştiinţa care se ocupă cu toate aspectele interacţiunii dintre biosisteme şi substanţele chimice, proprietăţile fizico-chimice şi utilizările biologice ale substanţelor studiate, precum şi de unele aspecte privind sursele substanţelor farmacologic active (29).
Farmacologia studiază relaţiile de cauzalitate şi legile după care se desfăşoară fenomenele din cadrul domeniului de studiu.
Mai concret, după dicţionarul Robert, farmacologia se ocupă cu studiul medicamentelor, acţiunea lor şi modul de utilizare.
Noţiunea de medicament sau drog defineşte, în sens larg, orice substanţă care poate influenţa natura vie, iar în sens restrâns, o substanţă utilizată în vederea prevenirii, ameliorării sau diagnosticării bolii (30). Deci, medicamentul este o moleculă bine definită a cărui parcurs în organism este bine cunoscut, iar efectele benefice sunt suficient de importante pentru a putea fi pus în circuitul terapeutic (1).
Farmacocinetica
DEFINIŢIE
Farmacocinetica studiază parcursul medicamentului în organism, dar şi influenţa organismului asupra medicamentului. Organismul poate acţiona limitând absorbţia, inactivând substanţa de bază sau grăbind eliminarea renală, digestivă sau pulmonară.
Farmacologie
Farmacocinetica studiază fenomene ce intervin în:
-absorbţie (influx)
-distribuţie
-biotransformare
-eliminare (eflux),
mai ales sub aspect cantitativ în relaţie cu acţiunea farmacologică în timp a medicamentului.
Farmacocinetica permite:
-cunoaşterea profilului farmacocinetic
-parametrii mişcării şi transformării medicamentului în organism
-concentraţia plasmatică (tisulară)
-efectul farmacologic (43).
- |
Medicament la |
|
|
situsul de |
|
|
administrare |
|
|
influx |
|
|
1. ABSORBŢIE |
|
|
Medicament în |
|
|
|
|
|
plasmă |
|
|
|
|
Distribuţie
|
|
Medicament intratisular |
|
|
Medicament şi/sau |
|
|
|
metaboliţii în urină, |
||||
|
|
|
|
|
|
|
|
|
3. BIOTRANSFORMARE |
|
EFLUX |
fecale, bilă |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Metaboliţi în ţesuturi |
4. ELIMINARE |
|||||
|
|
|
|
|
|
|
Fig. 1: Reprezentarea schematică a absorbţiei, distribuţiei, biotransformării şi eliminării unui |
||||||
medicament. |
|
|
||||
Farmacocinetica permite o mai bună alegere a căii de administrare, a momentului administrării, o dozare optimă pentru a obţine efectul terapeutic cel mai bun (întotdeauna corelarea se va face în context clinic şi evolutiv al bolii) (1).
Scopul farmacocineticii este de a furniza cunoştinţele necesare adaptării posologiei pentru a obţine concentraţiile plasmatice ale unui medicament cu un efect optim, adică cea mai bună eficacitate, cu efecte indezirabile minime (1).
Prezenţa medicamentelor în organism depinde de proprietăţile lor fizico-chimice cât şi de procesele biochimice şi fiziologice care intervin:
-predominant fizico-chimice: în cazul absorbţiei, distribuţiei şi eliminării,

Farmacologie
-predominant biochimice: în cazul metabolizării.
Având cunoştinţe de farmacocinetică se poate lărgi sfera de cunoaştere a medicamentului prin prospectarea de structuri medicamentoase noi, ţinând seama de relaţia dintre structură, proprietăţile fizico-chimice şi cele farmacocinetice, farmacodinamice şi toxicologice (43).
În farmacologia clinică, singurul parametru direct accesibil fiind concentraţia plasmatică a medicamentului, se studiază variaţia acestei concentraţii (poate urca, coborî sau rămâne constantă) într-un interval de timp considerat (1).
Diferenţele farmacocinetice între medicamente provin esenţial din facilitatea cu care acestea traversează membranele biologice şi de viteza lor de biotransformare (1).
Dispoziţia medicamentului sau a metaboliţilor săi activi la nivelul organului receptor depinde de trei factori:
-viteza şi nivelul de eliberare a substanţelor active din produsul farmaceutic şi absorbţia consecutivă,
-“efectul primului pasaj” ceea ce determină trecerea în circulaţia sanguină a unei fracţiuni intacte din medicamentul absorbit la nivel gastro-intestinal şi care a trecut bariera hepatică,
-un proces complex de legare şi transportare de către proteinele plasmatice, fixare
tisulară, repartizare în lichidele organismului, de metabolizare şi eliminare.
În concluzie, cinetica medicamentelor implică următoarele etape: absorbţia, distribuţia, metabolizarea (biotransformarea) şi excreţia (eliminarea) (29, 33).
PRINCIPALII PARAMETRI FARMACOCINETICI
Farmacocinetica se ocupă de studiul concentraţiei plasmatice a medicamentului, singurul parametru accesibil.
Pentru a aborda acest termen trebuie să definim:
a.timpul de înjumătăţire (T1/2): timpul necesar pentru ca valoarea concentraţiei plasmatice să diminue la jumătate; cunoaşterea timpului de înjumătăţire permite evaluarea numărului de prize pe zi pentru a obţine concentraţia plasmatică dorită.
În marea majoritate a cazurilor timpul de înjumătăţire este independent de doza de medicament administrat. Doar în câteva cazuri excepţionale el variază în funcţie de doză: poate creşte sau
Farmacologie
diminua în funcţie de saturarea unui mecanism (de eliminare, catabolism sau fixarea pe proteinele plasmatice) (1).
b. ASC (aria de sub curbă) sau AUC (area under curve) corespunde integralei concentraţiei plasmatice într-un interval de timp dat.
În practică se utilizează următoarea formulă:
unde,
ASC = Σ ([C] x
[C] = concentraţia măsurată
t = intervalul de timp între cele două măsurători. ASC-ul se exprimă în miligrame sau grame/liltru/oră.
Rolul său principal este de a permite măsurarea biodisponibilităţii unui medicament (1).
c.biodisponibilitateareprezintă procentul de medicament administrat care ajunge în compartimentul central. În general, este măsurată comparând ASC obţinută după administrarea aceluiaşi medicament pe cale intravenoasă cu o altă cale, cel mai adesea orală.
d.termenul de compartimentcuprinde:
-primul compartiment care este un volum real (volumul sanguin)
-al doilea compartiment care este un volum fictiv în care medicamentul este distribuit (ansamblul organismului, exceptând sângele) (1).
e.Volumul aparent de distribuţie (Vd) este un volum fictiv, exprimat în litri/kg, în care este distribuit medicamentul, presupunând că este omogen (concentraţia tisulară medie este egală cu cea plasmatică).
Vd = D/C0
în care,
Vd = volumul de distribuţie, D = doza,
C0 = concentraţia iniţială,
Exemplu: dacă doza este de 100 mg administrată i.v., iar concentraţia sa iniţială în plasmă este de 10 mg/l, se poate deduce că volumul de distribuţie este de 10 litri (1).
f. Clearance-ul este fracţia unui volum teoretic totalmente epurat pe unitatea de timp.

Farmacologie
Clearance-ul plasmatic este volumul aparent de plasmă epurat în unitatea de timp.
Clearance-ul total sau global este fracţiunea volumului aparent de distribuţie, care este totalmente epurat în unitatea de timp.
În concluzie, clearance-ul total depinde de constanta de eliminare şi, deci, de timpul de înjumătăţire şi de volumul de distribuţie (1).
g. Platoul (steady state)
Corespunde unei stări de echilibru atinsă după un număr de administrări. Dacă doza şi frecvenţa de administrare sunt stabile, atunci şi concentraţia obţinută va fi stabilă (platoul se atinge după aproximativ cinci timpuri de înjumătăţire) (1).
CĂILE DE ADMINISTRARE A MEDICAMENTELOR
Calea de administrare este determinată de:
● |
proprietăţile medicamentului (hidrosolubilitate, |
liposolubilitate, |
ionizare) |
|
|
● |
scopul terapeutic urmărit (acţiune imediată, administrare controlată, |
|
restricţie pe o cale de administrare) (29).
Administrarea medicamentelor se realizează în principiu pe două căi principale:
¤enterală
¤parenterală.
A. ENTERAL.
1. Oral
Este cea mai comună cale de administrare, dar este şi cea mai variabilă şi implică cel mai complicat parcurs către locul ţintă. Unele medicamente sunt absorbite la nivelul stomacului, dar duodenul este frecvent situsul major de intrare în circulaţia sistemică datorită suprafeţei mari de absorbţie.
Cele mai multe medicamente absorbite în tractusul gastro-intestinal, pătrund în circulaţia portală şi trec prin ficat înainte de a fi distruibuite în circulaţia generală.
Aici are loc ”efectul primuluipasaj” unde sunt metabolizate majoritatea medicamentelor şi astfel este diminuată eficacitatea medicaţiei administrată oral.
De exemplu, mai mult de 90% din nitroglicerină este neutralizată în cursul unui singur pasaj hepatic, ceea ce face ca locul de administrare de elecţie a acestui medicament în urgenţă să fie sublingual tocmai pentru a evita metabolizarea hepatică.
Ingestia alimentelor concomitent administrării medicamentoase poate influenţa absorbţia; prezenţa alimentelor în stomac întârzie evacuarea gastrică, astfel încât medicamentele care sunt

Farmacologie
degradate de către sucul gastric (ex. penicilina G) devin non-disponibile pentru absorbţie. Medicamentele enterosolubile sunt protejate de mediul gastric acid, iar administrarea lor sub această formă medicamentoasă poate preveni iritaţia gastrică.
După modul de condiţionare medicamentele pot căpăta valenţe multiple, care favorizează absorbţia intestinală (efervescente, capsule , comprimate cu efect retard sau eliberare controlată).
2. Sublingual.
Plasarea sublinguală a medicamentului permite un contact direct şi prelungit cu mucoasa şi circulaţia locală capilară, ceea ce permite pătrunderea directă a principiului activ în torentul sanguin.
Administrarea unui agent pe această cale are avantajul că medicamentul “şuntează” efectul primului pasaj hepatic.
3. Rectal
Se utilizează pentru administrarea locală sau pentru a “şunta “ calea de metabolizare hepatică, pentru că 50% din circulaţia rectală nu se varsă în portă, de asemenea se foloseşte această cale de administrare pentru a evita aciditatea gastrică sau în afecţiunile care se manifestă cu vărsături.
Este una din principalele căi de administrare a medicamentelor la copii sau la persoanele inconştiente (29, 33, 43).
B. PARENTERAL
Administrarea parenterală este utilizată pentru medicamentele care sunt slab absorbite în tractul gastro-intestinal şi pentru agenţii instabili pe această cale de administrare, cum este insulina.
Administrarea parenterală este utilizată deasemenea în cazul pacientului inconştient, precum şi în situaţii care necesită instalarea rapidă a efectului medicamentului
Administrarea parenterală oferă cel mai bun control al dozei şi efectului medicamentului în corp.
1. Intravascular
Injectarea intravenoasă (i.v.) este cea mai comună cale parenterală.
Pentru medicamentele care nu se absorb enteral, frecvent constituie singura alternativă. Prin administrare intravenoasă medicamentul evită tractul gastro-intestinal şi deci primul pasaj metabolic hepatic.

Farmacologie
Reprezintă o cale de administrare în care se obţine efect rapid, dar şi cu un grad mare de risc, pentru că substanţa activă introdusă intravenos nu mai poate fi eliminată (prin vomă ca în cazul medicaţiei din tractul gastro-intestinal). Prezintă un mare grad de risc de contaminare bacteriană, poate induce hemoliză sau poate cauza reacţii adverse prin eliberarea prea rapidă a concentraţiilor mari de medicament în plasmă şi ţesuturi; de aceea rata injectării trebuie controlată cu atenţie.
Aceeaşi prudenţă se cere şi în administrarea medicamentelor intraarterial.
2. Intramuscular (i.m.)
Medicamentele administrate intramuscular pot fi soluţii apoase sau preparate depôt (suspensie de medicament într-un vehicul non apos - etilenglicol sau ulei de alune) care au grade de absorbţie diferenţiate (preparatul depôt se absoarbe mai lent furnizând o doză susţinută de-a lungul unei perioade lungi de timp).
3. Subcutanat (s.c.)
Această cale de administrare, ca şi cea musculară, implică un proces de absorbţie şi este mai lentă decât cea venoasă.
Administrarea subcutană minimalizează riscurile asociate administrării intravenoase.
Alte exemple de medicamente ce se utilizează prin administrare subcutanată includ solidele precum şi capsulele din silastic, care conţin contraceptivul levonorgestrel şi care sunt administrate sub formă de implant cu acţiune pe termen lung şi infuzoarele mecanice programabile care pot elibera insulină în anumite cazuri de diabet.
C. ALTE CĂI DE ADMINISTRARE
1. Inhalarea
Permite eliberarea medicamentului pe o suprafaţă mare de mucoasă a tractului respirator şi a epiteliului pulmonar, producând un efect aproape la fel de rapid ca şi injectarea intravenoasă. Se utilizează ca şi cale de administrare pentru substanţele gazoase sau pentru cele ce pot fi vaporizate.
Calea este în mod particular eficientă şi convenabilă pentru pacienţii cu afecţiuni respiratorii deoarece medicamentul este eliberat direct către situsul de acţiune, iar efectele adverse sistemice sunt minimizate.
2. Intranazal
Desmopresinul este administrat intranazal în tratamentul pacienţilor cu diabet insipid; calcitonina este un hormon peptidic utilizat în tratamentul osteoporozei şi este disponibilă sub formă de spray nazal. Cocaina este administrată de dependenţi tot intranazal pentru a obţine un efect rapid şi comod. Este necesară însă, o stare normală a mucoasei nazale.

Farmacologie
3. Intratecal / intraventricular
În anumite afecţiuni este necesar ca medicamentul să fie administrat direct în LCR (meningite).
4. Topic
Calea de administrare topică se utilizează atunci când vrem să obţinem un efect local al medicamentului care poate fi aplicat pe tegument sau pe mucoase (conjunctivală, auriculară,vaginală etc)
5. Transdermal
Această cale de administrare conduce la efecte sistemice prin aplicarea cutanată a medicamentului, de obicei prin intermediul unui plasture transdermal. Rata absorbţiei poate varia seminficativ, dependent de caracteristicile fizice cutanate şi de situsul aplicării. Această cale este cel mai frecvent utilizată pentru eliberarea prelungită a medicamentelor (nitroglicerina).
Variaţia concentraţiilor plasmatice a unui medicament este în funcţie de modalitatea de administrare.
Cei trei factori esenţiali care trebuie avuţi în vedere în cazul administrării repetate a unui medicament sunt:
-doza administrată,
-frecvenţa administrării
-timpul de înjumătăţire.
Durata persistenţei în organism a unui medicament creşte odată cu doza administrată şi cu timpul de înjumătăţire.
Dacă există un interval suficient de timp între două administrări nu se produce acumularea medicamentului.
Dacă frecvenţa de administrare a unui medicament este suficientă sau timpul de înjumătăţire este destul de lung, persistă o concentraţie reziduală a medicamentului în momentul unei administrări ulterioare. În acest caz, repetarea administrării medicamentului la intervale constante duce la o creştere progresivă a concentraţiei sale până la atingerea unei concentraţii maximale sau a unui platou (apare după un timp echivalent cu durata a cinci timpi de înjumătăţire).
Existenţa platoului se explică prin faptul că doza administrată rămâne constantă, în timp ce cantitatea de medicament eliminată creşte treptat până la a compensa cantitatea adusă prin fiecare nouă admnistrare (43).

Farmacologie
ABSORBŢIA ŞI DIFUZIA MEDICAMENTELOR
Medicamentul este capabil, prin grupările chimice pe care le posedă, să ducă la modificarea suprafeţei celulare cu care vine în contact, deci să modifice proprietăţile acesteia (33).
Dizolvarea şi difuzia medicamentelor
Dizolvarea substanţelor medicamentoase este un proces care precede absorbţia lor în circulaţia generală şi poate fi o etapă limitantă, de aceea este importantă pentru biodisponibilitatea medicamentelor.
Cedarea substanţei medicamentoase din forma farmaceutică poate fi influenţată semnificativ de proprietăţile fizico-chimice ale substanţei medicamentoase şi ale formei farmaceutice. Disponibilitatea farmaceutică sau cedarea substanţei medicamentoase este determinată în principal de viteza de cedare din forma farmaceutică.
Viteza de dizolvare a unei substanţe medicamentoase solide este definită prin cantitatea care intră în soluţie în unitatea de timp, în condiţii standardizate de interfaţă solid/lichid, temperatură şi compoziţie a solventului (23, 47).
În biofarmacie viteza de dizolvare este viteza cu care substanţa medicamentoasă se dizolvă din produsul medicamentos (formă farmaceutică dozată) sau din părţi ale acestuia în timpul testării (23).
Eliberarea substanţelor medicamentoase din forme farmaceutice cu cedare modificată
Formele farmaceutice cu cedare modificată sunt produse medicamentoase în care printrun procedeu tehnologic se asigură eliberarea substanţei medicamentoase cu o viteză mică, prelungind absorbţia în circulaţia generală, deci realizarea de niveluri medicamentoase terapeutice, mărind în ultimă instanţă efectul terapeutic în timp.
Formele medicamentoase cu cedare modificată pot fi:
-cu cedare prelungită sau susţinută
-cu cedare întârziată.
● Substanţele medicamentoase care se pretează la o astfel de formulare sunt cele cu timpul de înjumătăţire scurt, 3 – 4 ore şi cu indice terapeutic mare. Acestea se mai numesc şi medicamente cu cedare prelungită sau susţinută.
● Atunci când doza unitară conţine o fracţiune de substanţă medicamentoasă cu dizolvare rapidă în stomac şi o alta cu o acoperire gastrorezistentă (enterosolubilă) produsul se numeşte cu cedare întârziată.

Farmacologie
Eliberarea substanţelor medicamentoase din sisteme farmaceutice cu cedare modificată implică atât dizolvarea, cât şi difuzia.
Cedarea prelungită sau întârziată se realizează prin crearea de forme farmaceutice cu ajutorul unor polimeri. În funcţie de mecanismul difuziei (de cedare a formei active) se disting (23):
-sisteme rezervor sau cu membrană
-sisteme de tip matriţă sau monolitice
-sisteme hibride (laminate sau multiple)
-sisteme biodegradabile
-sisteme activate prin solvent (presiune osmotică; umflarea polimerului după îmbibare
– sisteme gonflabile)
-sisteme controlate magnetic.
Cunoaşterea vitezei de cedare este cel mai important factor de prevedere al biodisponibilităţii şi a evaluării calităţii formelor farmaceutice.
Difuzia este principalul mod de transfer al substanţelor medicamentoase prin membranele biologice, adică de absorbţie în circulaţia generală, după ce a avut loc cedarea (sau dizolvarea) lor din formele farmaceutice administrate pe diferite căi (23).
Traversarea membranelor de către medicamente
Compoziţia şi structura membranei plasmatice este în jur de 60% fosfolipide şi 40% proteine.
Lipidele care intră în compoziţia membranelor sunt amfipatice deoarece sunt formate din molecule care au o extremitate polară (hidrofilă) şi o extremitate nepolară (hidrofobă). Este vorba, în esenţă, despre:
-glicerofosfolipide sau glicerol substituit,
-sfingolipide (care derivă din sfingozină – un alcool substituit de către acizi graşi şi o grupă polară); ele se împart în 3 clase:
-sfingline,
-cerebomielozide,
-gangliozide.
-colesterolul, alcătuit dintr-un nucleu steranic, substituit de o grupare polară –OH şi
dintr-un lanţ flexibil nepolar. El se intercalează între celelalte lipide întărind structura membranară.
Aceste lipide amfipatice, glicerofosfolipidele şi sfingolipidele, se orientează în mod natural sub formă de dublu strat cu extremităţile polare situate la exterior şi cu cele nepolare în centru.

Farmacologie
Fluiditatea dublului strat depinde în mod evident de temperatură, dar şi de compoziţia sa; acizii graşi nesaturaţi care formează lanţuri mai puţin lineare cresc fluiditatea membranară mai mult decât cei saturaţi.
Proteinele se inseră în dublul strat lipidic, fie la exterior, fie la interior, fie transmembranar.
Aceste proteine constituie:
-receptorii membranari (cel mai adesea glicoproteine care asigură comunicarea intercelulară),
-structuri care asigură schimbul de ioni şi de alte molecule între celulă şi exterior:
pompe de tipul Na+/K+-ATPaza dependente, canale şi transportatori membranari. Conceptele de structură membranară sunt încă destul de discutate, această ipoteză a
membranei de tip “mozaic fluid” fiind cea mai acceptată (1, 43).
Există mai multe posibilităţi de traversare a membranei.
Pentru a penetra în celulă, medicamentele trebuie să străbată membrana; pentru a trece dintr-un compartiment în altul medicamentele trebuie să traverseze mai multe membrane. Membranele sunt formate din mai multe celule legate unele de altele mai mult sau mai puţin strâns. Aceste celule sunt dispuse pe o membrană bazală mai mult sau mai puţin permeabilă pentru molecule.
Se distinge astfel:
-pasajul transcelular,
-pasajul paracelular,
-filtrul poros.
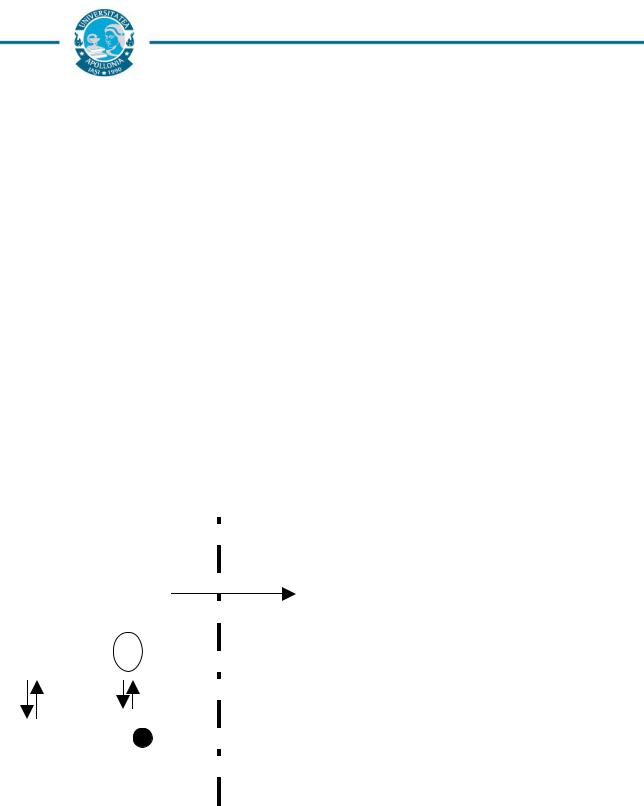
Pasajul transcelular
Dacă celulele sunt strâns legate unele de altele, cum este în cazul celulelor endoteliului capilarelor cerebrale, medicamentul trebuie să traverseze celulele, adică “membrana citoplasmatică” pentru a ajunge dintr-un compartiment în altul.
Pasajul paracelular
Dacă celulele epiteliale transmembranare sunt unite între ele prin joncţiuni mai laxe, moleculele pot traversa prin aceste joncţiuni numite de comunicare (“gap junctions”).
Pasaj transcelular |
Pasaj paracelular (“gap junctions”) |

Farmacologie
Fig. 2: Modalităţi de pasaj dintr-un compartiment în altul a medicamentului (modificat după Allain,
1996).
Filtrul poros
Unele epitelii, cum ar fi cel renal glomerular, sunt străbătute de pori care pot lăsa să treacă molecule de talii inferioară dimensiunii porului. La nivelul glomerulului renal, moleculele care au o greutate moleculară sub 68.000, pot teoretic traversa membrana. Totuşi trebuie ţinut cont şi de alţi parametri ai moleculelor, cum ar fi încărcătura electrică şi flexibilitatea (1, 33, 43).
Difuziunea pasivă prin dublul strat lipidic
Traversarea dublului strat lipidic se face fără consum de energie din partea celulei. Dublul strat lipidic membranar constituie o barieră:
-impermeabilă pentru ionii de K+, Na+ şi Cl-, moleculele polare, chiar neionizate, cum ar fi glucoza şi proteinele;
-permeabilă pentru moleculele nepolare, liposolubile sau hidrofobe cu masă moleculară mică sau medie, de asemenea pentru moleculele în stare gazoasă şi pentru moleculele mici cu polaritate slabă;
Migrarea prin membrană se face de la o soluţie cu concentraţie mai mare către soluţia cu concentraţie mai mică, până se obţine un echilibru. Viteza de pasaj depinde de suprafaţa membranei, concentraţiile de o parte şi de alta a membranei şi de o constantă de difuziune k esenţial legată de liposolubilitatea sa şi de asemenea de dimensiunea moleculei (cu cât este mai mică, cu atât pasajul este facilitat).
Viteza de traversare se poate calcula după formula:
V = KxSx(C2- unde:
K = constanta de difuziune,
S = suprafaţa membranei
C1, C2 = concentraţia mai mică, respectiv, mai mare, de o parte şi de alta a membranei.
Caracterul liposolubil al unei molecule este determinat de măsurarea coeficientului de partaj între un solvent apos şi un solvent organic (ex. hexanul). Moleculele liposolubile sau apolare se acumulează în solventul organic, iar cele polare în apă.
Farmacologie
Polaritatea unui medicament depinde de ionizarea sa; se disting trei categorii:
-molecule întotdeauna ionizate, indiferent de pH, de exemplu cele care au în componenţă un amoniu cuaternar. Aceste molecule, în principiu, nu traversează dublul strat lipidic prin difuziune pasivă.
-Molecule neutre neionizate indiferent de pH, cum este cazul solvenţilor organici care traversează uşor dublul strat lipidic (1).
-Molecule a căror ionizare depinde de pH: care traversează dublul strat lipidic în stare neutră, dar nu şi în stare ionizată. Medicamentele acide se disociază în mediu bazic, iar bazele în mediu acid pentru a se transforma în molecule ionizate. PKa a unui acid este pH-ul la care se găseşte disociat în proporţie de 50%.
-Fixarea medicamentelor pe proteinele plasmatice, care poate merge de la 0 la 99%, modifică pasajul membranar; în stare liberă, adica nefixate pe proteinele plasmatice, medicamentele liposolubile, dacă există un gradient de concentraţie favorabil, traversează membranele lipidice, spre deosebire de medicamentele legate de proteine plasmatice (cum ar fi albuminele sau de alte proteine tisulare) care nu
Compartiment extracelular |
Compartiment |
|
intracelular |
|
|
|
|
|
M |
M |
M |
+ |
|
|
P |
P |
membrana |
celulară |
|
|
|
|
|
MP MP
traversează membrana (1).
Fig. 3:Pasajul transmembranar al unui medicament (M) în funcţie de legarea de proteine (P) (modificat după Allain, 1996).
Transportul activ

Farmacologie
Transportul activ se realizează prin structurile proteice membranare cu consum de energie furnizat de metabolismul celular.
Transportul activ direct realizat prin pompele membranare
Transportul activ necesită un aport de energie, în general furnizat de ATP. Pompa Na+/K+ ATP-ază dependentă, Mg++ dependentă utilizează energia ATP-ului pentru repolarizarea celulară lăsând să iasă trei ioni de Na+ şi să intre doi ioni de K+, ceea ce realizează o diferenţă de potenţial de o parte şi de alta a membranei.
Există de asemenea o pompă Ca++-ATP-ază dependentă, localizată la nivelul membranei plasmatice şi a reticulului endoplasmatic, precum şi o pompă H+/K+ ATP-ază dependentă.
O proteină membranară particulară este P-glicoproteina sau P170 deoarece greu
a. molecule implicate în metabolism, cum ar fi glucoza, acizii aminaţi, unii mediatori şi medicamentele cu structură chimică apropiată. Energia necesară pentru transportarea lor poate fi realizată printr-un gradient de Na+.
Cinetica pasajului se realizează cu o viteză maximă şi cu posibilitatea de competiţie între moleculele vecine. Dacă sodiul şi substratul traversează membrana în acelaşi sens, transportul se numeşte “sinport” şi dacă traversarea este în sens opus traversare este de tip “antiport”.
b.Transport activ prin canale şi transportatori pentru Na+, K+, Ca++ şi Cl-:
-canale a căror deschidere şi închidere depinde de diferenţa de potenţial intra/extracelulară (se deschid în timpul depolarizării)
-receptori care pot fi activaţi sau inhibaţi prin diverşi mediatori
-transportatori (ex. pentru Na+ şi Ca++).
Transportul prin exocitoză şi endocitoză
Exocitoza constă în eliminarea din celulă a moleculelor conţinute în vezicule care fuzionează cu membrana plasmatică şi eliberează conţinutul lor la exterior. Acesta este modul de eliberare al mediatorilor.
Endocitoza constă în absorbţia de către o celulă a unei molecule extracelulare; după includerea moleculei într-o veziculă formată prin invaginarea plasmalemei, aceasta pătrunde în citoplasmă. Acest proces este utilitzat de hepatocit pentru a capta diverse molecule mari, cum ar fi, lipoproteinele şi transferina (1, 43).
BIODISPONIBILITATEA ŞI BIOECHIVALENŢA
1. Biodisponibilitatea

Farmacologie
Biodisponibilitatea este cantitatea relativă de substanţă medicamentoasă din doza administrată sub forma unui produs farmaceutic, pe o anumită cale de administrare, care s-a absorbit nemodificată în circulaţia generală (mărimea absorbţiei) precum şi viteza cu care acest proces are loc (viteza absorbţiei)
-mărimea absorbţiei este un parametru cantitativ care are importanţă în cazul medicamentelor care se administrează cronic.
-viteza de absorbţie este un parametru cinetic cu importanţă mai mare în cazul
medicamentelor care se folosesc în doze unice (7, 39)
De obicei biodisponibilitatea se determină în raport cu un preparat de referinţă.
Biodisponibilitatea se calculează folosind aria de sub curba concentraţiei plasmatice în funcţie de timp notata ASC.
Bd% = ASC0/ASCiv x 100
Valori mici ale biodisponibilităţii pot arăta o absorbţie incompletă.
Biodisponibilitatea măsoară proporţia de medicament disponibil pentru acţiune(1, 33, 43).
2. Bioechivalenţa
Bioechivalenţa reprezintă o biodisponibilitate egală, adică absenţa unei diferenţe semnificative a mărimii şi vitezei absorbţiei unei substanţe medicamentoase din forme farmaceutice echivalente sau alternative, administrate în aceeaşi doză molară, în condiţii similare.
Stabilirea bioechivalenţei între două produse farmaceutice, unul care se testează şi celălalt care este produsul de referinţă, se face printr-o evaluare statistică corespunzătoare, respectând normele stabilite pentru substanţa medicamentoasă şi formele farmaceutice studiate.
Atunci când este vorba de o substanţămedicamentoasă nouă, este necesară caracterizarea sa farmacocinetică şi un studiu de biodisponibilitate absolută sau relativă.
Dacă este vorba de un nou produs farmaceutic care conţine o substanţă medicamentoasă aprobată, este necesar un studiu de bioechivalenţă (30, 33, 43).
BIOTRANSFORMAREA MEDICAMENTELOR
Indiferent de modul în care au fost introduse în organism medicamentele, majoritatea suferă un proces de biotransformare.
Biotransformarea constă, de obicei, în reducerea până la dispariţie a activităţii medicamentelor şi grăbirea eliminării lor prin variate procese biochimice.

Farmacologie
Medicamentele sunt transformate prin aceleaşi mecanisme biochimice ca şi metaboliţii endogeni. Dacă medicamentul este o substanţă pe care organismul o utilizează în mod fiziologic, acesta va fi metabolizat conform programelor genetic determinate.
Dacă medicamentele au o structură pentru care organismul nu dispune de mecanismele biochimice necesare, acesta se va elimina nemodificat. Dacă organismul dispune de mecanisme de biotransformare adecvate, medicamentele vor suferi modificările pe care căile metabolice le pot efectua asupra structurii respective.
Medicamentul nu crează căi noi de biotransformare (30).
Biotransformarea poate influenţa efectele unui medicament astfel (30):
-formează un metabolit inactiv dintr-un drog activ,
-formează un metabolit activ dintr-un drog iniţial inactiv,
-formează un metabolit activ dintr-un drog iniţial activ,
-formează un metabolit toxic dintr-un drog iniţial netoxic.
Modificarea asupra medicamentelor depinde şi de starea de funcţionare a căii metabolice care produce transformarea; aceasta poate fi:
-normală
-incomplet dezvoltată (prematuri, nou-născuţi)
-epuizată (prin îmbătrânire)
-alterată (de procese patologice).
De acest lucru trebuie ţinut cont în ajustarea dozelor la pacienţii cu diverse afecţiuni cronice sau la anumite categorii: bătrâni, copii, femei gravide.
Transformările metabolice necesită atât enzime microsomale hepatice, dar şi enzime nemicrosomale din ficat şi alte ţesuturi.
Biotransformarea se realizează în două faze:
● Faza I implică un sistem enzimatic de oxidare cu funcţii mixte, care cresc polaritatea moleculei, adică se măreşte solubilitatea în apă a medicamentelor.
Un rol important în oxidările microsomale îl are citocromul P450, o hemoproteină cu rol în obţinerea de oxigen activ necesar în oxidarea multor medicamente.
Forma oxidată a acestui citocrom este redusă de NADPH – citocrom P450 reductaza.
● Faza II. În această fază au loc reacţii de conjugare, medicamentul combinându-se cu un substrat endogen prin gruparea sa polară, rezultând metaboliţi intens polari.
În general metabolizarea reduce liposolubilitatea şi creşte solubilizarea moleculei.

Farmacologie
Fără aceste mecanisme medicamentele s-ar acumula şi ar duce la intoxicarea organismului (substanţele cu liposolubilitate mare nu pot fi eliminate nici prin bilă, nici prin rinichi, fiind recaptate de celulele tubilor renali).
Metabolizarea se realizează prin următoarele tipuri de reacţii:
1.Oxidări. Reacţia de oxidare a medicamentelor constă într-un proces de hidroxilare care necesită oxigen, NADPH şi un sistem enzimatic micosomial cunoscut sub
numele de monooxigenază.
Sistemul monooxigenazei cuprinde NADPH-citocrom P450-reductaza; acest sistem este lipsit de specificitate şi au fost descrise
a.oxidări microsomale:
-hidroxilarea aromatică (fenobarbitalul, fenitoina, chinidina, warfarina),
-hidroxilare alifatică (amfetamina, amobarbital, fenilbutazonă, spironolactonă)
-reacţii de S-oxidare (clorpromazina, thioridazida)
-N-dezalchilarea aminelor secundare şi terţiare (aminofenazona, codeina, morfina, lidocaina)
-N-oxidarea aminelor terţiare (clorpromazină, nicotină, activarea unor carcinogeni)
-O-dealchilarea esterilor cu formare de alcooli (codeina în morfină, fenacetina în paracetamol, griseofulvină, papaverină)
-S-demetilare (metilthiopurina în mercaptopurina)
-Dezaminare (amfetamina în fenilacetonă)
-Desulfurare (metisazonă, thiopental care se transformă în pentobarbital)
b. Oxidări nemicrosomale sau alcool-oxidarea
2. |
Reacţii de reducere. Se produc sub influenţa unor enzime microsomiale |
|
extrahepatice. |
- |
Nitroreduceri cu formare de amine (cloramfenicol, nitrazepam) |
- |
Cetoreducere cu formare de alcooli (aldosteron, cortizon în hidrocortizon, prednison |
|
în prednisolon) |
3.Reacţii hidrolitice (procaina este hidrolizată în acid paraaminobenzoic şi dietilaminoetanol)
4.Reacţii de sinteză sau de conjugare. Sunt importante pentru metabolizarea şi detoxifierea medicamentelor şi a unor substanţe introduse voluntar în organism. Conjugarea se realizează cu acidul glucuronic, cu acidul acetic, sulfuric sau cu grupări metilice. Glucuronoconjugarea la nivelul grupărilor amino, carboxil, sulfhidril, oxidril este catalizată de glucuroniltransferaza hepatică.

Farmacologie
Exemple de glucuronoconjugare cu formare de glucuronizi: acid acetilsalicilic, acid nicotinic, cloramfenicol, fenacetină, meprobamat (30, 42).
O serie de alte biotransformări sunt catalizate de enzime nemicrosomale (enzime libere solubile) din ficat, plasmă şi alte ţesuturi. Au loc următoarele reacţii de oxidare, de hidroliză, transsulfurare, conjugări cu acid acetic, metilic, sulfat, glicină şi glutation, inclusiv formarea de ribonucleotide şi nucleozide.
Metabolizarea medicamentelor depinde de gruparea funcţională prezentă în moleculă, aceasta indicând tipul de reacţie metabolică.
Biotransformarea decurge, de cele mai multe ori, după o cinetică exponenţială de ordinul I, dependentă de cantitatea de medicament. Concentraţia realizată de dozele uzuale este mult mai mică decât cea necesară saturării enzimelor, ceea ce face ca reacţiile biochimice să nu fie limitate.
Există câteva substanţe, printre care şi alcoolul etilic care sunt metabolizate după o cinetică de ordinul 0, cu ritm constant, indiferent de cantitatea de substrat.
Unele medicamente cum sunt salicilaţii, fenitoina, dicumarolul se metabolizează după o cinetică de ordinul I pentru doze relativ mici şi după o cinetică de ordinul 0, cu o viteză scăzută pentru cantităţile care depăşesc aceste doze, saturând enzimele metabolizante (43).
Metabolizarea drogurilor stereoselective
Mulţi compuşi există în două figuraţii opuse (droguri chiralice). Aceşti enantiomeri pot avea efecte biologice diferite şi pot fi metabolizaţi diferit (levo-ibuprofenul inhibă sinteza de prostaglandine, pe când dextroizomerul său nu)(30).
Deoarece numeroase medicamente sunt de fapt amestecuri racemice (proporţii egale din fiecare stereoizomer) există posibilitatea ca numai jumătate din doza administrată să fie activă, de aceea se recomandă prepararea medicamentelor formate din stereoizomerul activ.
Factori care influenţează metabolizarea medicamentelor
1. Stimularea metabolizării prin inducţie enzimatică. Multe medicamente sunt capabile să activeze propria lor metabolizare, precum şi a altor substanţe active de către enzimele hepatice microsomale.
Din această categorie fac parte:
-hipnoticele (fenobarbitalul)

Farmacologie
-unii hormoni (steroizii anabolizanţi)
-hidrocarburile cancerigene (benzpirenul)
Există trei tipuri de inducţie enzimatică:
● inducţia de tip fenobarbital (cea mai obişnuită) – creşte nivelul citocrom P450 şi a NADPH2citocrom c reductaza ca urmare a depresiei transcripţiei ADN – ARN în nucleu şi o eventuală stabilizare lizozomală. Efectul inductor are spectru larg.
● |
Inducţia |
de tip spironolactonă care produce creşterea nivelului de |
NADPH2citocrom C reductază |
||
● |
Inducţia |
de tip 3-metil colantren care produce o formă modificată a |
citocromului P450 care are o altă specificitate de substrat.
Administrarea a unui inductor enzimatic în timpul unui tratament cu alte medicamente, le poate reduce eficacitatea dacă metabolizarea le inactivează sau le poate creşte activitatea sau toxicitatea dacă metabolizarea acţionează în acest sens (25).
2. Inhibarea metabolizării.
Practic inhibitorii sintezei proteice inhibă fenomenul de inducţie enzimatică şi scad capacitatea de metabolizare a medicamentelor. Inhibarea enzimelor metabolizante este cu importanţă clinică pentru că determină în mod obişnuit o creştere a efectului şi a toxicităţii (semnificaţia este mare când este implicat citocromul P450).
3.Căi specifice de metabolizare există pentru mediatorii neurotransmisiei, hormoni sau alte substanţe chimice produse de organism (vezi farmacologia specială).
4.Legarea de proteinele plasmatice.
Unele medicamente se metabolizează foarte greu, cum ar fi fenilbutazona, pentru că este legată de proteinele plasmatice în proporţie de 99%, cunoscându-se faptul că medicamentele libere, nelegate se metabolizează mult mai uşor.
5. Diferenţe de specie şi diferenţe individuale.
După doze egale de medicament, reacţia terapeutică sau toxică poate fi diferită în funcţie de specie, de aceea extrapolarea rezultatelor de la animale la om poate da, uneori, erori.
Chiar în cadrul aceleiaşi specii apar manifestări diferite, de exemplu HIN folosită în tratamentul tuberculozei este metabolizată mai lent de o parte a populaţiei umane, caracter care se transmite genetic.
Concluzia care rezultă este aceea că pentru practică dozele trebuiesc individualizate, de câte ori este posibil să se determine concentraţia sanguină şi că asocierile medicamentoase pot influenţa metabolizarea.

Farmacologie
6. Vârsta şi sexul.
La persoanele foarte tinere (copii) şi la persoanele în vârstă s-a constatat o sensibilizare la activitatea farmacologică a medicamentelor. Scăderea metabolizării s-a constatat la pubertate şi la bătrâneţe (ar putea fi legată de scăderea activităţii enzimelor metabolizante).
Diferenţe de sex s-au constatat în metabolizarea unor medicamente ca benzodiazepine, estrogeni, salicilaţi.
7. Diverse boli.
Boli hepatice care afectează arhitectura şi funcţiile hepatice şi scad oxidazele microsomale, ceea ce reduce metabolizarea medicamentelor (dozele trebuiesc ajustate). Cancerul hepatic reduce conţinutul de citocrom P450. Bolile cardiace prin reducerea fluxului sanguin hepatic afectează metabolizarea medicamentelor. Insuficienţa respiratorie cronică afectează hidroliza unor medicamente (procaina). Diverse disfuncţii endocrine, pot afecta metabolizarea (diabetul modifică metabolizarea medicamentelor evidenţiată prin valori diferite ale timpilor de înjumătăţire, de exemplu ai fenilbutazonei, tolbutamidei) (30, 43).
EXCREŢIA MEDICAMENTELOR
Medicamentele, dacă au suferit sau nu procese de biotransformare vor fi eliminate din organism prin mai multe căi: biliară, intestinală, prin plămân . Eliminarea prin salivă, prin lapte, prin piele sunt cantitativ minore. Cea mai importantă cale de eliminare este însă calea renală (30).
Pe această cale, medicamentele se elimină prin filtrare glomerulară, substanţele care circulă liber în plasmă având o eliminare mai rapidă faţă de cele care circulă legate.
Capilarele glomerulare, foarte permeabile, filtrează majoritatea medicamentelor cu excepţia compuşilor macromoleculari. Trecerea moleculelor în urina primară este în funcţie de cantitatea de plasmă filtrată (exprimată prin clearance-ul creatininei) şi de măsura în care se leagă de proteinele plasmatice.
Reabsorbţia tubulară se face prin difuziune şi realizează trecerea medicamentului din urina primară prin epiteliul tubular, către interstiţiu şi sânge. Substanţele liposolubile difuzează şi se reabsorb mai rapid; ionii şi moleculele polare nu pot difuza şi rămân în urină. Metabolizarea crescând polaritatea favorizează eliminarea urinii. Reabsorbţia urinară este influenţată şi de pH. Acidifierea urinii creşte disocierea şi favorizează eliminarea substanţelor bazice, alcalinizarea creşte disocierea şi favorizează eliminarea substanţelor acide (ex. acidul acetilsalicilic).
Mecanismul de transport activ are un rol important în eliminarea unor substanţe medicamentoase din organism.

Farmacologie
Există un sistem transportor pentru acizii organici (anioni), care funcţionează pentru medicamentele acide, inclusiv metaboliţii conjugaţi şi altul pentru bazele organice (cationi) care funcţionează pentru medicamentele bazice. Cele două grupe de medicamente pot intra în competiţie pentru secreţia tubulară, micşorându-şi eliminarea (probenecidul diminuează excreţia penicilinei ambele molecule fiind acide).
Rata eliminării medicamentelor depinde şi de starea de funcţionare a rinichiului, eliminarea scăzând odată cu scăderea filtrării glomerulare până la valoarea critică a clearanceului creatininei de 10-20 ml/min.
Insuficienţa renală inaparentă clinic sau cea manifestă pot determina creşterea anormală a nivelelor medicamentului în sânge prin întârzierea eliminării sale ceea ce poate genera efecte adverse.
Calea digestivă constituie o cale de eliminare pentru unele medicamente. Prin salivă se pot elimina medicamente ca bromurile, chinina, metale grele, alcaloizi.
Deoarece unele medicamente realizează în salivă concentraţii asemănătoare celor din plasmă, ele se pot doza în salivă, atunci când recoltarea sângelui prezintă dificultăţi.
Prin bilă se pot excreta: hormonii steroidieni, ampicilina, eritromicina, lincomicina, rifampicina, tetraciclinele, digitoxina, chinina, tubocurarina, vinblastina. Eliminarea prin bilă se face folosind mecanisme transportoare active. Parte dintre substanţele care ajung în intestin odată cu bila se reabsorb şi intră în circuitul enterohepatic, mentinându-se timp îndelungat în organism.
La nivelul intestinului gros, care constituie calea de eliminare a medicamentelor insolubile, se pot observa şi unele medicamente care se elimină prin mucoasa intestinală, cum este morfina.
Eliminarea pulmonară este predominantă pentru substanţele volatile sau gazoase mai ales anestezicele generale.
Eliminarea prin piele poate fi importantă terapeutic în cazul griseofulvinei în micozele cutanate
Prin glanda mamară se pot elimina o serie de substanţe în lapte care pot fi toxice pentru sugar (nicotina, chininina, mercurul) (33, 43).

Farmacologie
CURS2:
Farmacodinamia
DEFINIŢIA
Farmacodinamia studiază efectele medicamentelor, locul şi mecanismul lor de acţiune. Farmacodinamia este ramura farmacologiei care studiază efectele favorabile ale medicamentelor asupra organismului.
Spectrul de cunoaştere a farmacodinamiei implică (11):
1.studiul acţiunilor farmacodinamice şi parametrii care îi caracterizează
2.factorii care influenţează acţiunea farmacodinamică
Activitatea biologică a medicamentului presupune:
-o interacţiune iniţială de ordin chimic sau fizico-chimic cu moleculele organismului - acţiune primară
-se declanşează apoi un complex de reacţii care au ca rezultat efectul farmacologic global (42).
O acţiune farmacodinamică poate fi manifestată în sensul amplificării sau deprimării unui proces fiziolgic sau fiziopatologic.
Potrivit legii fundamentale a farmacodinamicii medicamentul nu crează funcţii noi în organism, acţiunea şi reglarea asupra acestora se realizează pe structurile existente, asupra cărora medicamentul are efect de modelare sau de monitorizare (30).
PRINCIPALII PARAMETRII AI ACŢIUNII FARMACODINAMICE
Acţiunea farmacodinamică este caracterizată de mai mulţi parametri:
Sensul acţiunii. Acţiunea poate fi:
-Stimulatoare (excitantă), obţinându-se prin ridicarea tonusului funcţional
-inhibitoare sau deprimantă.

Farmacologie
De menţionat că medicamentul acţionează pe structurile existente, pe receptorii proprii fiecărui organism, în consecinţă nu există “receptori farmacologici” (ei sunt preformaţi, determinaţi genetic).
Medicamentele nu pot crea nici o funcţie nouă într-un organism ele putând stimula sau inhiba funcţiile pentru care este programat biosistemul respectiv.
Potenţa (intensitatea acţiunii).
Reprezintă capacitatea unei substanţe medicamentoase de a avea activitate biologică.
Potenţa de acţiune este în relaţie cu doza – cu cât potenţa este mai mare cu atât doza este mai mică.
În practică se poate compara activitatea biologică a două sau mai multe substanţe active, făcând raportul dozelor care produc acelaşi efect (bioechivalenţa).
Latenţa
Măsoară timpul scurs de la administrarea unui medicament până la apariţia efectului farmacodinamic. Este dependentă de mai mulţi factori:
-calea de administrare -forma farmaceutică
-strucţura chimică a substanţei -parametrii farmacocinetici.
Eficacitatea
Proprietatea unui medicament exprimată prin efectul maxim posibil (efect terapeutic).
Timpul efectului maxim
Pentru unele categorii de medicamente (anticoagulante, cardiotonice) este necesar să fie cunoscut,pentru a se obţine o eficacitate maximă în timp util.
Selectivitatea.
Reprezintă unul din dezideratele terapiei farmacologice şi în particular ale farmacodinamiei. Reprezintă proprietatea medicamentului de a influenţa un substrat cât mai limitat din organism (majoritatea medicamentelor au un “spectru de acţiune”)

Farmacologie
Durata de acţiune
Cunoaşterea duratei de acţiune a medicamentului este absolut necesară pentru a determina şi adapta intervalul dintre administrări (priza).
Durata de acţiune este dependentă de proprietăţile farmacocinetice. Actualmente se caută forme medicamentoase care se pot administra la intrevale cât mai mari să aibă eficacitate maximă (21).
Locul de acţiune a medicamentului
h- la nivel extracelular sau în rezervoarele de lichid transcelular (sucuri digestive,
LCR, umoarea apoasă, endolimfa, lichid articular). Ex: antiacidele gastrice, enzimele digestive acţionează în tractusul intestinal; heparina neutralizează proteinele de coagulare în sânge; sodiu, calciu, EDTA chelează plumbul extracelular; antibioticele acţionează asupra bacteriilor din LCR.
-la nivel celular:
-la nivelul membranei celulare.
Foarte multe medicamente acţionează asupra membranei celulare pe care o influentează direct sau prin intermediul receptorilor. Se produc:
-modificări ale permeabilităţii
-translocare ionică
-modificare în funcţia unor enzime membranare
-dezorganizarea membranei.
Membranele excitabile conţin canale care constituie sisteme transportatoare pasive pentru ioni conform gradientului de concentraţie. Trecerea pasivă a ionilor condiţionează variaţiile de potenţial, care determină atât excitaţia şi conducerea impulsului, cât şi inhibiţia.
Canalele ionice membranare fac parte dintr-o familie de proteine glicozilate complexe. Ele cuprind câteva peptide dintre care una majoră, mai voluminoasă, include porul apos, un senzor de voltaj, receptorii specifici pentru semnalele chimice şi mecanice de poartă. Celelalte peptide au funcţii de reglare.
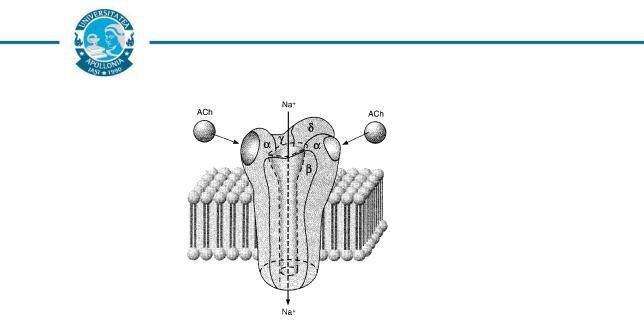
Farmacologie
Fig. 5: Receptorul nicotinic pentru acetilcolină: canal ionic cu mecanism de poartă (după Katzung, 1998).
Specificitatea canalelor ionice este conferită de către un mecanism defiltru dependent de o anumită formă, anumite dimensiuni şi anumite grupări chimice.
Mecanismele de poartă deschid şi închid drumul ionilor realizând activarea, respectiv inactivarea canalelor. Aceste fenomene sunt atribuite deplasării sarcinilor electrice purtate de anumite grupări chimice sau rotaţiei unor dipoli moleculari (aşa cum se presupune pentru canalele de sodiu).
Porţile pot fi comandate electric, prin modificarea potenţialului membranar (canalele pentru Na+ şi cele pentru K+ din membrana axonală sau canalele de Ca++ din miocard şi muşchii netezi vasculari).
Alte canale îşi dechid porţile prin mecanisme chimice, ca urmare a modificărilor conformaţionale determinate de cuplarea unor molecule active cu receptorii specifici (canalele comune pentru Na+ şi K+ din membranele sinaptice sunt deschise sub influenţa transmiţătorului chimic sau a unor molecule analoage).
Anumite toxine influenţează electiv transportul ionilor prin diferite canale, constituind instrumente de studiu preţioase. Astfel tetrodoxina blochează selectiv transportul ionilor de sodiu acţionând în porţiunea externă a canalului respectiv, fără să modifice mecanismul de poartă.
Neurotoxinele din veninul de scorpion inhibă inactivarea conductivităţii sodiului şi activează conductivitatea potasiului.
Neurotransmiţătorii, homonii, autacoizii, medicamentele pot influenţa canalele ionice direct sau prin intremediul unor mecanisme biochimice, ceea ce explică efectele lor.

Farmacologie
Astfel acţionarea receptorilor nicotinici de către acetilcolină şi alţi agonişti colinergici deschide canalul pentru Na+ şi K+, cu influx masiv de ioni de sodiu, depolarizare şi generarea potenţialului post sinaptic excitator.
Anestezicele locale şi generale pătrund prin membrana neuronală lipidică, modificându-i fluiditatea şi interacţionând cu proteinele – consecutiv ele modifică indirect canalele sodiului, interferând mecanismul de poartă şi reducând conductivitatea maximă pentru acest ion, ceea ce poate bloca impulsul nervos.
Canalele calciului de tip L, voltaj dependente, care se găsesc în cantitate mare în miocard şi muşchii vaselor, pot fi blocate prin nifedipină, verapamil sau diltiazem – peptida alfa din componenţa acestor canale conţine receptori specifici pentru aceste substanţe. Blocantele canalelor calciului inhibă consecutiv influxul de Ca++ încetinind procesul de depolarizare la nivelul nodulului sinusal şi atrioventricular, deprimând contractilitatea miocardului şi provocând vasodilataţie.
Receptorii GABA din creier, care formează un complex cu canalele pentru Cl-, sunt acţionaţi de benzodiazepinele tranchilizante, cu deschiderea acestor canale, influx de ioni de clor, hiperpolarizare şi potenţial postsinaptic inhibitor.
Refacerea şi menţinerea potenţialului membranar este asigurată prin mecanisme transportoare – pompe ionice – care funcţionează specific pentru anumiţi ioni, cu consum de energie împotriva gradientului de concentraţie. Pompa de Na+/K+, reprezentată de o ATP-ază sensibilă la ioni şi pompa de calciu menţin concentraţia fiziologică de Na+, K+ şi Ca++. Ele asigură gradientul de concentraţie care condiţionează translocarea pasivă a ionilor prin canalele membranare. Inhibitorii metablolismului energetic blochează pompele ionice, dar nu modifică transportul pasiv prin membranele celulare.
Glicozidele tonicardiace inhibă funcţia unei ATP-aze sarcolemice sensibilă la Na+ şi K+, de la nivelul celulelor miocardice, determinând pierdere de potasiu şi acumulare de sodiu intracelular; ionii de sodiu sunt schimbaţi ulterior cu ionii de calciu din afara celulei, creşterea disponibilului de calciu, fiind responsabilă de acţiunea inotrop pozitivă.
Membranele celulare conţin enzime importante pentru starea membranei şi pentru metabolismul celular: adenilat ciclaza şi guanilat ciclaza, catalizează formarea nucleotizilor ciclici AMPc şi GMPc ; fosfolipaza C care pune în funcţie sistemul fosfatidilinozitol/Ca++şi fosfolipaza A2, care iniţiază formarea PAF şi eicosanoizilor.
