
- •Домашние задания по химии и методические указания по их выполнению для студентов дневной формы обучения
- •Содержание
- •Введение
- •Раздел 1. Основные классы неорганических соединений
- •Раздел 2. Газовые законы. Закон Авогадро и следствия из него. Уравнение Клапейрона-Менделеева. Моль. Молярный объём газов.
- •Примеры решения задач 71-82.
- •Раздел 3. Эквиваленты. Нахождение формул вещества. Стехиометрические расчеты.
- •Раздел 4. Строение атома и периодическая система д.И. Менделеева.
- •Раздел 5. Химическая связь и строение молекул
- •Относительная электроотрицательность атомов
- •Типовые задачи с решениями по разделу 5.
- •Раздел 6 Термохимия. Элементы химической термодинамики.
- •Раздел 7.Окислительно-восстановительные реакции
- •Раздел 8 Скорость химической реакции. Химическое равновесие.
- •Примеры решения задач к разделу 8:
- •Раздел 9.Концентрации растворов. Коллигативные свойства растворов
- •Раздел 10. Растворы электролитов. Константа и степень диссоциации. Водородный показатель. Реакции ионного обмена. Произведение растворимости
- •Типовые задачи с решениями по разделу 10:
- •Раздел 11. Гидролиз солей. Обменные реакции в растворах электролитов
- •Раздел 12.Электродные потенциалы. Химические источники электрической энергии
- •Типовые задачи к разделу 12.
- •Раздел 13. Комплексные соединения
- •Содержание
- •Литература
Раздел 6 Термохимия. Элементы химической термодинамики.
При выплавке чугуна в доменной печи происходят разнообразные химические процессы: разложение карбонатов, восстановление оксидов железа углеродом и оксидом углерода (II), образование карбидов железа, шлака и др.
Вычислить тепловые эффекты химических реакций по стандартным теплотам образования веществ (∆Нº298) (задачи 251-260):
3Fe2O3(k) + CO(г) = 2Fe3O4(k) + CO2(г).
Fe3O4(k) + CO(г) = 3FeO(k) + CO2(г).
FeO(k) + CO(г) = Fe(k) + CO2(г).
Fe2O3(k) + 3CO(г) = 2Fe(k) + 3CO2(г).
Fe3O4(k) + C(k) = 3FeO(k) + CO(г).
FeO(k) + C(k) = Fe(k) + CO(г).
3Fe(k) + 2CO(г) = Fe3C(k) + CO2(г).
CO2(г) + C(k) = 2CO(г).
CaCO3(k) = CaO(k) + CO2(г).
CaO(k) + SiO2(k) = CaSiO3(k).
Металлотермия, т.е. процесс восстановления соединений металлов более активными металлами - метод получения чистых металлов.
Вычислить тепловые эффекты реакций получения металлов (261-265):
V2O5(k) + 5Ca(k) = 2V(k) + 5CaO(k).
Cr2O3(k) + 2Al(k) = 2Cr(k) + Al2O3(k).
TiCl4(ж) + 2Mg(k) = Ti(k) + 2MgCl2(k).
TiCl4(ж) + 4Na(k) = Ti(k) + 4NaCl(k).
UF4(k) + 2Ca(k) = U(k) + 2CaF(k).
Получению металлов часто предшествует процесс обжига сульфидных руд или термическое разложение карбонатных руд. Рассчитать стандартные энтальпии образования оксидов металлов (266-270):
ВаСО3(k) = ВаО(k) + СО2(г); ∆Hх.р.= + 258,7 кДж
СаСО3(k) = СаО(k) + СО2(г); ∆Hх.р.= +179,7 кДж
Sb2S3(k) +
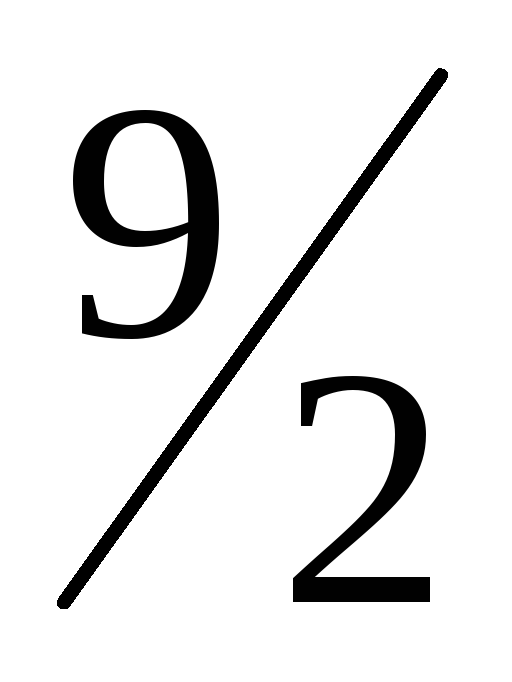 O2(г)
= Sb2O3(k)
+ 3SO2(г);
∆Hх.р.=
-1610,6 кДж
O2(г)
= Sb2O3(k)
+ 3SO2(г);
∆Hх.р.=
-1610,6 кДжМоS2(k) +
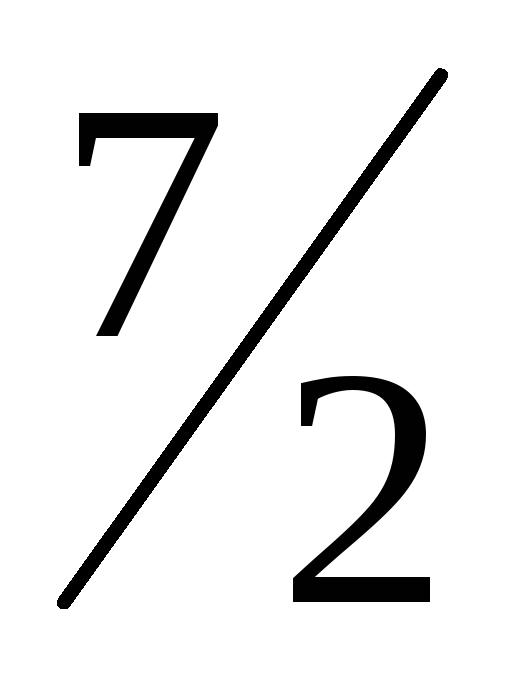 O2(г)
= МоО3(k)
+ 2SO2(г);
∆Hх.р.=
-1112,7 кДж
O2(г)
= МоО3(k)
+ 2SO2(г);
∆Hх.р.=
-1112,7 кДж2ReS2(k) +
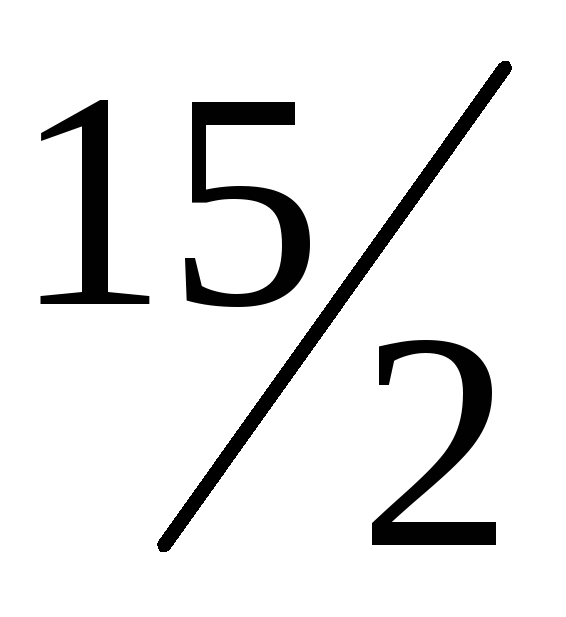 O2(г)
= Re2O7
+ 4SO2(г);
∆Hх.р.=
+430,9 кДж
O2(г)
= Re2O7
+ 4SO2(г);
∆Hх.р.=
+430,9 кДжГазообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4(г) и водяного пара. Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект.
При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2(г). Напишите термохимическое уравнение реакции, вычислите ее тепловой эффект.
Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуется СН4(г) и Н2О(г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана (при н.у).
Вычислите, сколько теплоты выделиться при сгорании 165 л (н.у) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды?
При сгорании газообразного аммиака образуются пары воды и оксид азота (II). Сколько теплоты выделиться при этой реакции, если было получено 44,8 л NO в пересчете на н.у.?
Рассчитать энергию Гиббса и определить возможность восстановления оксидов металлов используя: 1) стандартные значения энергии Гиббса; 2) стандартные значения энтальпий образования и энтропии (276-295):
|
№ задания |
Оксид |
Восстановитель |
Температура, 0C |
|
276 |
TiO2(k) |
C*(k) |
2000 |
|
277 |
TiO2(k) |
Ca(k) |
1500 |
|
278 |
TiO2(k) |
Al(k) |
1500 |
|
279 |
TiO2(k) |
H2(г) |
1500 |
|
280 |
PbO(k) |
C*(k) |
800 |
|
281 |
PbO(k) |
H2(г) |
350 |
|
282 |
Cr2O3(k) |
Si(k) |
1500 |
|
283 |
Cr2O3(k) |
Al(k) |
1800 |
|
284 |
Cr2O3(k) |
Ca(k) |
2000 |
|
285 |
Mo3O4(k) |
C*(k) |
1500 |
|
286 |
Mn3O4(k) |
C**(k) |
1500 |
|
287 |
Mn3O4(k) |
Al(k) |
1500 |
|
288 |
WO3(k) |
H2(г) |
500 |
|
289 |
WO3(k) |
Si(k) |
1000 |
|
290 |
Fe3O4(k) |
C*(k) |
1500 |
|
291 |
Fe3O4(k) |
C**(k) |
1500 |
|
292 |
Fe3O4(k) |
Al(k) |
1700 |
|
293 |
Fe3O4(k) |
Si(k) |
1700 |
|
294 |
Li2O(k) |
Ca(k) |
2000 |
|
295 |
Li2O(k) |
H2(г) |
1000 |
|
* Окисление до СО | |||
|
** Окисление до СО2 | |||
Пользуясь стандартными значениями энтальпий образования и энтропий, определите при какой температуре начнется реакция (296-300):
Fe3O4(k) + CO(г) = 3FeO(k) + CO2(г)
TiO2(k) + 2C(k) = Ti(k) + 2CO(г)
Fe2O3(k) + 3H2(г) = 2Fe(k) + 3H2O(г)
4NH3(г) + 5O2(г) = 4NO(г) + 6 H2O(г)
СН4(г) + СО2(г) = 2 СО(г) + 2Н2(г).
Таблица 2.
Стандартные
энтальпии образования ∆Нº298,
энтропии S![]() и энергия Гиббса образования
и энергия Гиббса образования
![]() G
G![]() некоторых веществ при 298 К (250С).
некоторых веществ при 298 К (250С).
|
Вещество |
∆Нº298, кДж/моль |
Sº298, Дж/моль·К |
|
|
1 |
2 |
3 |
4 |
|
O2 (г) |
0 |
205 |
0 |
|
P2O5 (k) |
-1492 |
114,5 |
-1348,8 |
|
H2O (ж) |
-285,8 |
70,1 |
-237,3 |
|
CaO (k) |
-635,5 |
39,7 |
-604,2 |
|
1 |
2 |
3 |
4 |
|
Ca3(PO4)2 (k) |
-4125,0 |
240,9 |
-3899,5 |
|
CH3OH (ж) |
-238,7 |
126,7 |
166,31 |
|
СО2 (г) |
-393,5 |
213,7 |
-394,4 |
|
С2Н4 (г) |
52,3 |
219,4 |
68,1 |
|
Н2О (г) |
-241,8 |
188,7 |
-228,6 |
|
С (графит) |
0 |
5,7 |
0 |
|
Н2 (г) |
0 |
130,5 |
0 |
|
С2Н6 (г) |
-89,7 |
229,5 |
-32,9 |
|
С2Н6 (ж) |
82,9 |
269,2 |
129,7 |
|
С6Н12О6 (к) |
-1273,0 |
˗ |
-919,5 |
|
С2Н5ОН (ж) |
-277,6 |
160,7 |
-174,8 |
|
Cu (k) |
0 |
33,3 |
0 |
|
MnO2 (k) |
-519,65 |
53,14 |
– |
|
CuO (k) |
-162,0 |
42,6 |
-129,9 |
|
Mn (k) |
0 |
31,76 |
0 |
|
CaCO3 (k) |
-1207,0 |
88,7 |
-1127,7 |
|
Al2O3 (k) |
-1676,0 |
50,9 |
-1582,0 |
|
SO3 (г) |
-395,8 |
256,7 |
-371,2 |
|
Al2(SO4)3 (k) |
-3434,0 |
239,2 |
-3091,9 |
|
PbO2 (k) |
-276,6 |
74,9 |
-218,3 |
|
CO (г) |
-110,5 |
197,5 |
-137,1 |
|
PbO (k) |
-219,3 |
66,1 |
-189,1 |
|
PbS (k) |
-94,28 |
91,20 |
-92,68 |
|
SO2 (г) |
-296,9 |
248,1 |
-300,2 |
|
H2S (г) |
-21,0 |
205,7 |
-33,8 |
|
S (ромб) |
0 |
31,88 |
0 |
|
С12Н22О11 (к) |
-2221 |
360 |
-1544,70 |
|
NH4Cl (k) |
-315,39 |
94,56 |
-343,64 |
|
NaOH (k) |
-426,6 |
64,18 |
-377,0 |
|
NaCl (k) |
-410,9 |
72,36 |
-384,0 |
|
NH3 (г) |
-46,2 |
192,6 |
-16,7 |
|
С2Н2 (г) |
226,8 |
200,8 |
209,2 |
|
S(г) |
129,1 |
227,7 |
– |
|
Н2О2 (ж) |
-187,02 |
105,86 |
-117,57 |
|
N2 (г) |
0 |
191,5 |
0 |
|
Fe (k) |
0 |
27,3 |
0 |
|
Al (k) |
0 |
28,3 |
0 |
|
1 |
2 |
3 |
4 |
|
Fe2O3 (k) |
-822,2 |
87,4 |
-740,3 |
|
H3PO4 (ж) |
-1271,94 |
200,83 |
-1147,25 |
|
HCl (г) |
-92,3 |
186,8 |
-95,2 |
|
Сl2 (г) |
0 |
222,9 |
0 |
|
AgNO3 (т) |
-120,7 |
140,9 |
-32,2 |
|
Ag (т) |
0 |
42,69 |
0 |
|
NO2 (г) |
33,5 |
240,2 |
51,5 |
|
СS2 (ж) |
87,8 |
151,0 |
63,6 |
|
СаН2 (т) |
-175,0 |
42,0 |
– |
|
Са(ОН)2 (т) |
-986,6 |
76,1 |
-896,8 |
|
Sb2S3 (т) |
-160,0 |
166,6 |
-154,5 |
|
FeS (т) |
-95,4 |
67,36 |
– |
|
Sb (т) |
0 |
45,69 |
0 |
Типовые задачи с решениями по разделу 6.
Пример 1. Пользуясь данными таблицы 2 вычислить ∆Нº реакции:
Fe2O3(k) + 3CO(г) = 2Fe(k) + 3 CO2(г)
Решение. По данным таблицы 2 стандартные энтальпии образования Fe2O3, CO, CO2 равны соответственно -822,2, -110,5, -393,5 кДж/моль, (напомним, что стандартные энтальпии образования простых веществ равны нулю), отсюда для реакции находим:
∆Hº = 3·∆Hº(CO2) – 3·∆Hº(CO) – ∆Hº(Fe2O3) = 3·(–393,5) – 3·(–110,5) – (–822,2) = –1180,5 + 331,5 + 822,2 = – 26,8 кДж
Ответ: ∆Hº реакции = –26,8 кДж.
Пример 2. Вычислить энтальпию образования пероксида водорода, если известны термохимические уравнения:
-
H2O2 = H2O +
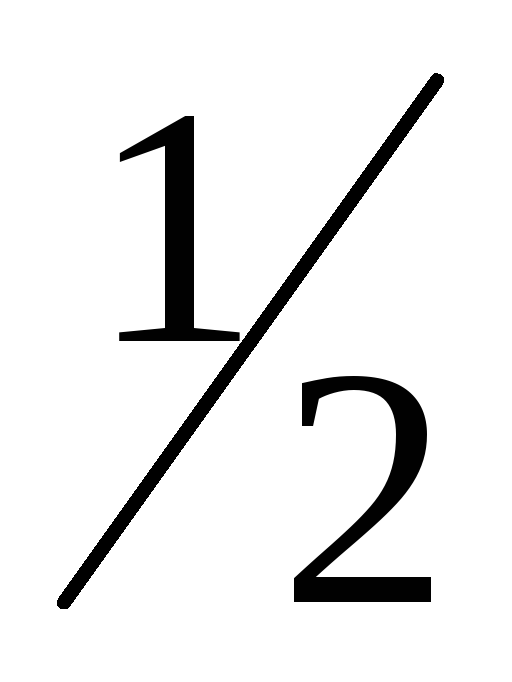 О2
О2
∆Hº1= –98,3 кДж (1)
H2 +
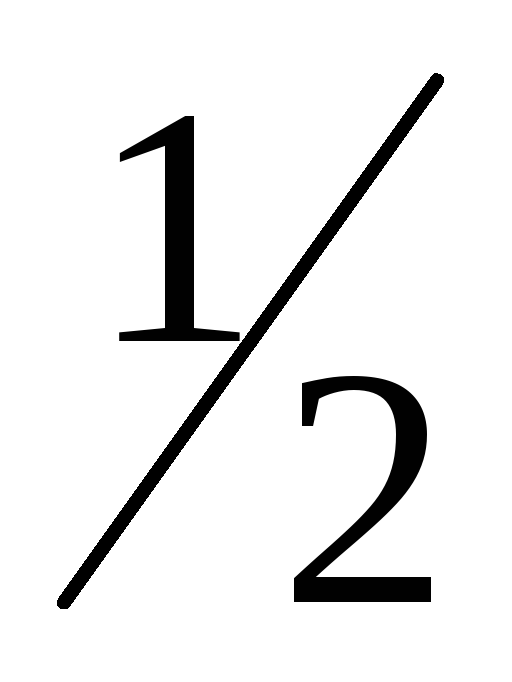 O2
= H2O
O2
= H2O∆Hº2= –284,5 кДж (2)
Решение. По условию задачи необходимо рассчитать тепловой эффект реакции:
Из термохимического уравнения (2) вычтем уравнение (1):
H2
+
![]() O2
– H2O2
= H2O
– H2O
–
O2
– H2O2
= H2O
– H2O
–
![]() О2
+ ∆Hº2
– ∆Hº1
О2
+ ∆Hº2
– ∆Hº1
H2 + O2 = H2O2 + ∆Hº2 – ∆Hº1
∆Hº2 – ∆Hº1 = ∆Hº = x
–284,5 – (–98,3) = ∆Hº = x
x = –186,2 кДж
Ответ: ∆Hº реакции = –186,2 кДж.
Пример 3. Оценить возможность протекания реакции при 200С:
NH3(г) + HCl(г) = NH4Cl(k).
Решение. О возможности протекания реакции судят по значению энергии Гиббса. Из таблицы 2 находим значения энтальпий и энтропий веществ, участвующих в реакции:
NH3(г) + HCl(г) = NH4Cl(k).
-
∆Нº298, кДж/моль
Sº298, Дж/моль·К
HCl(г)
92.3
186.8
NH3(г)
–46.2
192.6
NH4Cl(k)
–315.39
94.56
По следствию из закона Гесса:
∆Нº = ∆Нº(NH4Cl) – ∆Нº(HCl) – ∆Нº(NH3) = –315, 39 – (–92,3) – (–46,2) = –176,89 кДж
∆ Sºреакции = Sº(NH4Cl) – Sº(HCl) – Sº(NH3) = 94,56 – 186,8 – 192,6 = –285 Дж/K= – 0,285 кДж/К
Изменение свободной энергии Гиббса будет равно:
∆Gº = ∆Нº – T · ∆ Sº = –176,89 – 293 · (–0,285) = – 93,39 кДж,
т.е ∆Gº < 0, следовательно, при 20 0С реакция протекает самопроизвольно.
*При решении задач этого раздела следует пользоваться данными таблицы 2.
