- •Домашние задания по химии и методические указания по их выполнению для студентов дневной формы обучения
- •Содержание
- •Введение
- •Раздел 1. Основные классы неорганических соединений
- •Раздел 2. Газовые законы. Закон Авогадро и следствия из него. Уравнение Клапейрона-Менделеева. Моль. Молярный объём газов.
- •Примеры решения задач 71-82.
- •Раздел 3. Эквиваленты. Нахождение формул вещества. Стехиометрические расчеты.
- •Раздел 4. Строение атома и периодическая система д.И. Менделеева.
- •Раздел 5. Химическая связь и строение молекул
- •Относительная электроотрицательность атомов
- •Типовые задачи с решениями по разделу 5.
- •Раздел 6 Термохимия. Элементы химической термодинамики.
- •Раздел 7.Окислительно-восстановительные реакции
- •Раздел 8 Скорость химической реакции. Химическое равновесие.
- •Примеры решения задач к разделу 8:
- •Раздел 9.Концентрации растворов. Коллигативные свойства растворов
- •Раздел 10. Растворы электролитов. Константа и степень диссоциации. Водородный показатель. Реакции ионного обмена. Произведение растворимости
- •Типовые задачи с решениями по разделу 10:
- •Раздел 11. Гидролиз солей. Обменные реакции в растворах электролитов
- •Раздел 12.Электродные потенциалы. Химические источники электрической энергии
- •Типовые задачи к разделу 12.
- •Раздел 13. Комплексные соединения
- •Содержание
- •Литература
Относительная электроотрицательность атомов
|
H 2,1 |
|
|
|
|
|
|
|
Li 0,98 |
Be 1,5 |
B 2,0 |
C 2,5 |
N 3,07 |
O 3,5 |
F 4,0 |
|
Na 0,93 |
Mg 1,2 |
Al 1,6 |
Si 1,9 |
P 2,2 |
S 2,6 |
Cl 3,0 |
|
K 0,91 |
Ca 1,04 |
Ga 1,8 |
Ge 2,0 |
As 2,1 |
Se 2,5 |
Br 2,8 |
|
Rb 0,89 |
Sr 0,99 |
In 1,5 |
Sn 1,7 |
Sb 1,8 |
Te 2,1 |
I 2,6 |
|
Cs 0,79 |
Ba 0,89 |
Tl 2,04 |
Pb 2,33 |
Bi 2,02 |
|
|
В задачах 238-250 объяснить с позиции метода молекулярных орбиталей (МО) возможность образования молекул. Представить энергетическую схему образования молекулы. Определить кратность связи в молекуле.
|
№ задания |
молекула |
№ задания |
молекула |
|
238 |
B2 |
245 |
He2 |
|
239 |
F2 |
246 |
S2 |
|
240 |
Ne2 |
247 |
Li2 |
|
241 |
H2 |
248 |
N2 |
|
242 |
N2 |
249 |
Mg2 |
|
243 |
Cl2 |
250 |
O2 |
|
244 |
O2 |
|
|
Типовые задачи с решениями по разделу 5.
Пример 1: (задачи 201-225)
СsI, BF3, H2
В молекуле CsI - связь ионная. Цезий - s-металл, его атомы легко отдают электроны (ЭОCs=0,79)
Сs0
-
![]()
![]() Cs+
Cs+
Йод – р-элемент VПА группы, типичный неметалл, атомы которого легко принимают электроны (ЭО = 2,6)
I0
+
![]()
![]() I–
I–
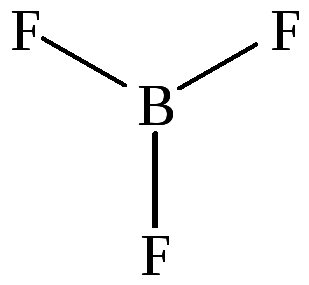
В молекуле BF3 три ковалентные полярные связи B-F. Электроны смещены в сторону фтора, как более электроотрицательного атома (ЭОВ = 2,0; ЭОF = 4,0)
Электронные формулы атомов В и F:
|
|
|
|
|
2p |
|
| ||
|
|
|
|
2s |
↓ |
|
|
|
|
|
|
|
1s |
↓↑ |
|
|
|
|
|
|
5B 1s22s22p1 |
|
↓↑ |
|
|
|
|
|
Ковалентность
бора равна I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p1 |
|
| ||
|
|
|
|
2s2 |
↓↑ |
↓↑ |
↓ |
|
|
|
|
|
1s2 |
↓↑ |
|
|
|
|
|
|
9F 1s22s22p5 |
|
↓↑ |
|
|
|
|
|
Ковалентность фтора равна I |
|
|
В молекуле ковалентность бора равна 3 | |||||||
Значит, атом бора следует перевести в возбужденное состояние, сообщив ему энергию:
|
|
|
В атоме 5В* валентные p-орбитали разного типа, поэтому произойдет sp2 гибридизация (s + p + p) с образованием трех sp2 гибридных орбиталей.
Этому типу
гибридизации (sp2)
соответствует плоская треугольная
молекула, в которой связи расположены
под углом 1200
друг к другу. Все три связи относятся к
типу
![]() - связей (если между двумя атомами
возможна одна связь, то это всегда
- связей (если между двумя атомами
возможна одна связь, то это всегда![]() -
связь).
-
связь).
В молекуле Н2 - связь ковалентная неполярная. Такая связь возникает между двумя одинаковыми атомами. Связь в молекуле Н2 возникла вследствие перекрывания 1s- орбиталей двух атомов водорода и относится к типу
 -связей.
-связей.
Пример 2: (задачи 226-237)
О степени полярности
связи (степени ионности) можно судить
по разности электроотрицательностей
атомов, между которыми образована связь
(![]() ).
Чем больше величина
).
Чем больше величина![]() ,
тем больше степень полярности связи.
,
тем больше степень полярности связи.
Например, для
связей Са-О, Са-N,
Са-С разность электроотрицательностей
(![]() )
соответственно равны 2,46; 2,03; 1,46. Таким
образом, наиболее полярная связь - Са-О,
наименее полярная связь - Са-С.
)
соответственно равны 2,46; 2,03; 1,46. Таким
образом, наиболее полярная связь - Са-О,
наименее полярная связь - Са-С.