
- •Домашние задания по химии и методические указания по их выполнению для студентов дневной формы обучения
- •Содержание
- •Введение
- •Раздел 1. Основные классы неорганических соединений
- •Раздел 2. Газовые законы. Закон Авогадро и следствия из него. Уравнение Клапейрона-Менделеева. Моль. Молярный объём газов.
- •Примеры решения задач 71-82.
- •Раздел 3. Эквиваленты. Нахождение формул вещества. Стехиометрические расчеты.
- •Раздел 4. Строение атома и периодическая система д.И. Менделеева.
- •Раздел 5. Химическая связь и строение молекул
- •Относительная электроотрицательность атомов
- •Типовые задачи с решениями по разделу 5.
- •Раздел 6 Термохимия. Элементы химической термодинамики.
- •Раздел 7.Окислительно-восстановительные реакции
- •Раздел 8 Скорость химической реакции. Химическое равновесие.
- •Примеры решения задач к разделу 8:
- •Раздел 9.Концентрации растворов. Коллигативные свойства растворов
- •Раздел 10. Растворы электролитов. Константа и степень диссоциации. Водородный показатель. Реакции ионного обмена. Произведение растворимости
- •Типовые задачи с решениями по разделу 10:
- •Раздел 11. Гидролиз солей. Обменные реакции в растворах электролитов
- •Раздел 12.Электродные потенциалы. Химические источники электрической энергии
- •Типовые задачи к разделу 12.
- •Раздел 13. Комплексные соединения
- •Содержание
- •Литература
Типовые задачи с решениями по разделу 10:
Пример 1. Вычислите молярную, нормальную, моляльную, концентрацию массовую долю, мольную долю и титр раствора гидроксида натрия, если известно, что 4г NaOH было растворено в 96г воды (плотность раствора равна 1,04 г/см3).
Решение.
1.
Массовая доля (![]() )
показывает, какую часть от общей массы
раствора, составляет масса растворенного
вещества. Массовая доля – безразмерная
величина, ее выражают в долях единицы
или процентах.
)
показывает, какую часть от общей массы
раствора, составляет масса растворенного
вещества. Массовая доля – безразмерная
величина, ее выражают в долях единицы
или процентах.
![]()
где
![]() -
массовая доля (%) растворенного вещества;
-
массовая доля (%) растворенного вещества;![]() -
масса растворенного вещества, г;
-
масса растворенного вещества, г;![]() -
масса раствора, в г.
-
масса раствора, в г.
Так как
масса раствора равна произведению
объема раствора V
на его плотность
![]() ,
то
,
то
![]()
Массовая доля гидроксида натрия равна:
![]()
Моляльная концентрация Сm (моль/кг) показывает количество растворенного вещества, находящегося в 1 кг растворителя:
![]()
где n – количество растворенного вещества, моль; mр-ля – масса растворителя, кг;
Мв-ва – молярная масса растворенного вещества, г/моль.
МNaOH = 40 г/моль.
![]() моль/кг.
моль/кг.
Молярная концентрация раствора (С) показывает количество растворенного вещества, содержащегося в 1л раствора:
![]()
где n – количество растворенного вещества, моль; Vp-pa – объем раствора, л; mв-ва – масса растворенного вещества, г; Мв-ва – молярная масса растворенного вещества, г/моль.
![]()
![]() моль/л
моль/л
4.Нормальная концентрация Сн моль/л показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1л раствора (моль/л):
![]()
где nэ – число молярных масс эквивалентов (эквивалентных масс); Vp-pa – объем раствора, л.
Так как
![]() г/моль,
г/моль,
![]() моль/л.
моль/л.
Мольная (молярная) доля
 вещества в растворе равна отношению
количества данного вещества
вещества в растворе равна отношению
количества данного вещества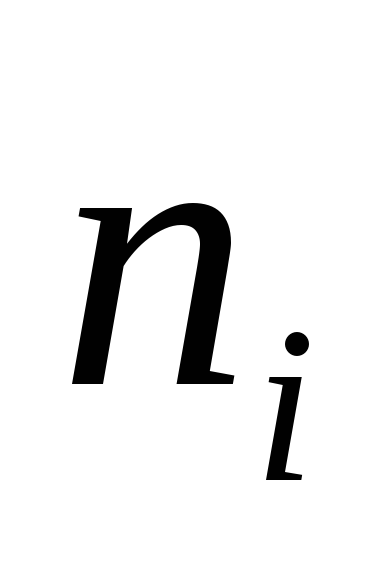 к общему числу всех веществ, содержащихся
в растворе:
к общему числу всех веществ, содержащихся
в растворе:

где
![]() -
количество всех веществ, содержащихся
в растворе:
-
количество всех веществ, содержащихся
в растворе:
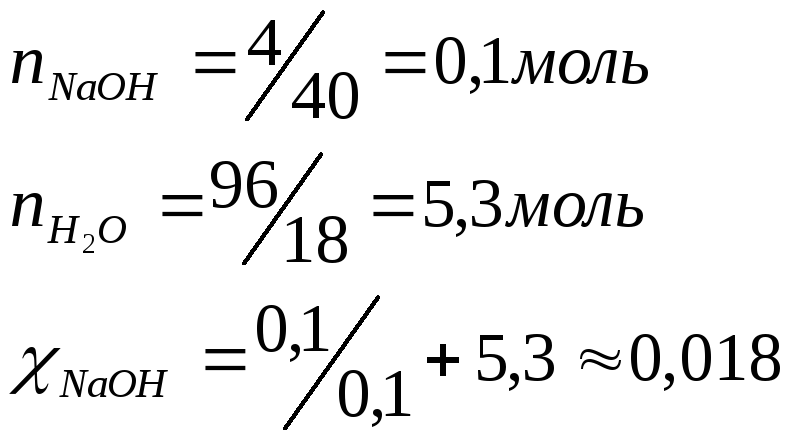
Титр раствора.
Титр раствора (Т) показывает массу растворенного вещества, содержащегося в 1 мл раствора
![]()
где m – масса растворенного вещества, г; Vp-pa – объем раствора, мл.
![]() г/мл.
г/мл.
Пример 2.
Какой объем раствора H2SO4
с массовой долей H2SO4
24% (![]() =1,17
г/мл) требуется для приготовления 10л
0,5М раствора этой кислоты?
=1,17
г/мл) требуется для приготовления 10л
0,5М раствора этой кислоты?
Решение: Определяем массу серной кислоты в 10л 0,5М раствора:
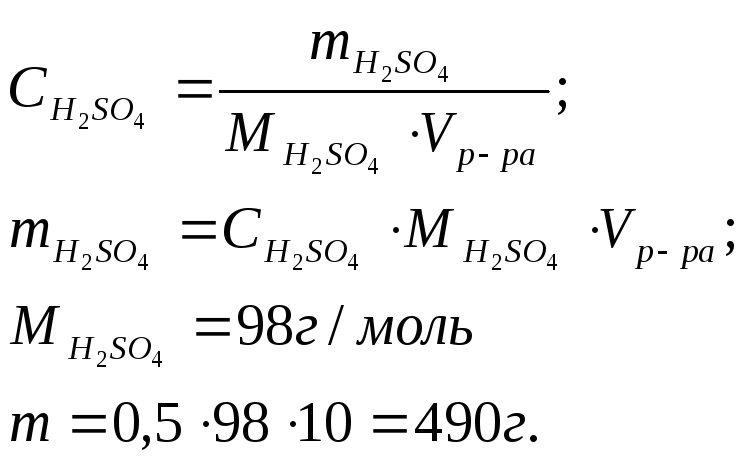
Так как
то
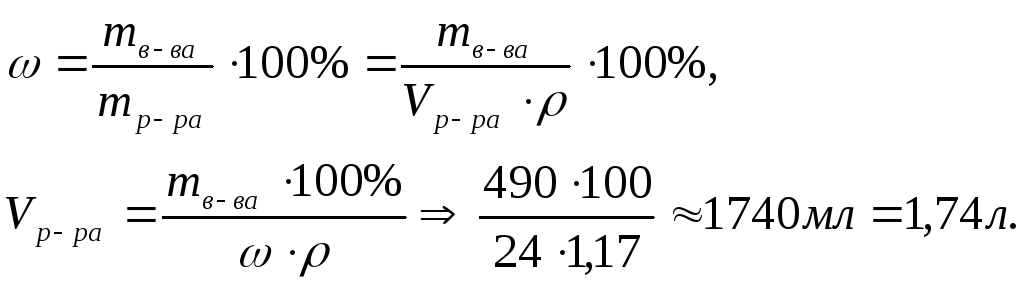
Ответ: для
приготовления 10л 0,5М раствора серной
кислоты необходимо взять 1,14л раствора
H2SO4
кислоты с
![]() .
.
Пример 3. Чему равна молярная концентрация эквивалента кислоты, если известно, что на нейтрализацию 25см3 раствора кислоты израсходовано 12,5см3 0,25н раствора щелочи.
Из закона эквивалентов следует, что количество эквивалентов всех веществ, участвующих в химической реакции, одинаково. Следовательно,

где
![]() и
и![]() -
соответственно, эквивалентная концентрация
1-го и 2-го вещества;V1
и V2
– соответственно, объемы 1-го и 2-го
веществ.
-
соответственно, эквивалентная концентрация
1-го и 2-го вещества;V1
и V2
– соответственно, объемы 1-го и 2-го
веществ.
![]() кислоты
кислоты![]()
Ответ: Сн = 0,125н.
Пример 4. Вычислите осмотическое давление раствора содержащего в 1,4л 126г глюкозы С6Н12О6 при О0С.
Решение: Осмотическое давление раствора определяется по закону Вант-Гоффа:
Росм = Cм RT,
Где См – молярная концентрация раствора, моль/л; R – универсальная газовая постоянная, 8,31 Дж/моль. К; Т – абсолютная температура, К.
![]()
то
![]()
где
![]() г/моль.
г/моль.
Ответ: Росм = 1134 кПа.
Пример 5. Вычислите давление пара над раствором, содержащем 34,2г сахара С12Н22О11 в 45г воды при 650С, если давление паров воды при этой температуре равно 2,5 . 104 Па.
Решение: Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением:
![]()
где р0
– давление
пара над чистым растворителем, р –
давление пара растворителя над раствором,
![]() -
мольная доля растворенного вещества.
-
мольная доля растворенного вещества.
![]()
где n – количество растворенного вещества, моль; N – количество растворителя, моль.

Ответ: р = 2,4 .104 Па.
Пример 6. Определите температуру кипения и замерзания раствора, содержащего 2г нитробензола С6Н5NO2 в 20г бензола. Эбуллиоскопическая и криоскопическая константы бензола соответственно равны 2,57 и 5,10С. Температура кипения чистого бензола 80,20С, температура замерзания 5,40С.
Решение: Согласно закону Рауля, понижение температуры замерзания и повышение температуры кипения раствора прямо пропорционально моляльной концентрации раствора:
![]()
![]()
где
![]() и
и![]() - соответственно, повышение температуры
кипения, и понижение температуры
замерзания раствора,0С;
Е и К – соответственно,
эбуллиоскопическая и криоскопическая
константы растворителя, 0С.
- соответственно, повышение температуры
кипения, и понижение температуры
замерзания раствора,0С;
Е и К – соответственно,
эбуллиоскопическая и криоскопическая
константы растворителя, 0С.
Так как
![]() то
то


Ответ:
![]()
Пример 7. Рассчитайте кажущуюся степень электролитической диссоциации Na2SO4 , если известно, что раствор, содержащий 0,834г Na2SO4 в 1000г воды, замерзает при -0,0280С.
Решение: Na2SO4 является электролитом. Следовательно
![]()
По понижению температуры замерзания определим изотонический коэффициент
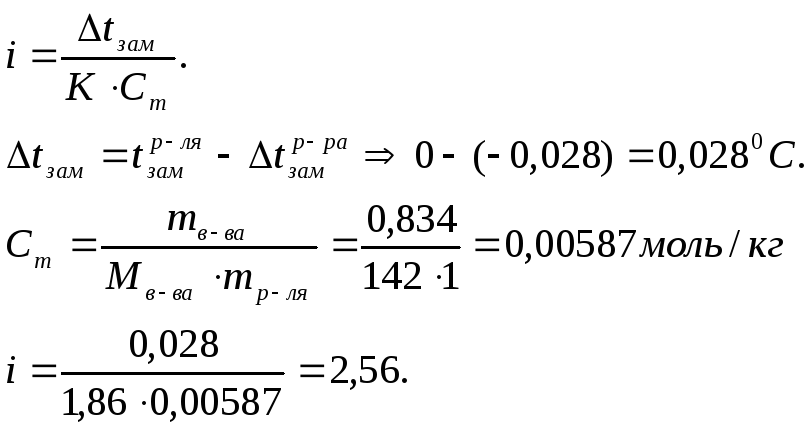
При диссоциации
Na2SO4
![]() 2Na+
+ SO4-2
образуется 3 иона, поэтому кажущаяся
степень диссоциации равна
2Na+
+ SO4-2
образуется 3 иона, поэтому кажущаяся
степень диссоциации равна
![]()
