
Komyak_A_I_Molekulyarnaya_spektroskopia
.pdf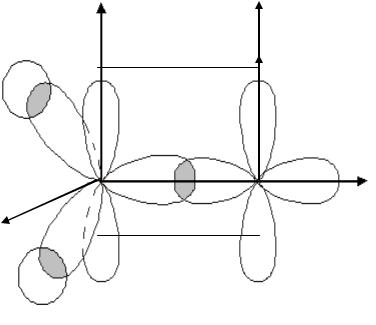
остаются электроны (n электроны атома кислорода), находящиеся на не связывающих орбиталях. Последовательность молекулярных орбиталей и расположение электронов на них выглядит следующим образом:
св 2 св 2 nsp 2 n p x 2 .
Разрыхляющие орбитали и остаются свободными. Таким образом, в группе атомов С = 0 все валентные электроны располагаем на своих орбиталях (для атома кислорода рассматриваем только p- электроны).
Почему на несвязывающих орбиталях у нас получилось по два электрона с различной энергией. Дело в том, что один p-электрон атома кислорода смешивается с s-электроном и частично задействован с - связи с атомом углерода. Расчет показывает, что распределение электронной плотности для него обладает шаровой симметрией. В точечной группе симметрии C2 его орбиталь относится к типу симметрии а1 и по значению энергии расположена ниже орбитали px- электрона. Симметрия свободной орбитали px относится к типу b1, который определяется из рассмотрения операций симметрии для группы C2 . Ось у направлена перпендикулярно плоскости молекулы.
|
y |
|
y |
|
|
|
|
H |
py |
-связь |
|
|
py |
||
|
|
|
|
|
|
-связь |
|
x |
|
|
z |
|
|
|
H
Рис. 6.7. Химические связи в молекуле формальдегида Н2СО. -связь образуется в плоскости, перпендикулярной плоскости молекулы за счет перекрывания
283
Электронная плотность для орбитали -типа относится к типу b2 симметрии. Это проверяется по поведению волновой функции, описывающей распределение pz-электронов, при выполнении операций симметрии. На рис. 6.8. приведена схема расположения уровней энергии валентных электронов молекулы формальдегида и симметрия их молекулярных орбиталей.
Зная симметрию молекулярных орбиталей, можно установить симметрию нижнего электронного состояния как групповое
произведение их симметрий молекулярных орбиталей. Итак
2 nsp 2 n p 2 a1 2 b2 2 a1 2 b1 2 .
Произведение типа симметрии самого на себя всегда дает полносимметричное представление (исключая вырожденные состояния),
т. е. a1 2 a1 или b1 2 a1 . Таким образом, нижнее состояние молекулы формальдегида относится к полносимметричному представлению А1. Переход электрона с заполненной несвязывающей p-орбитали (npx) на разрыхляющую *-орбиталь приводит к спектру поглощения в самой длинноволновой области. На рис 6.8 этот переход обозначается вертикальной стрелкой. Определим симметрию этого перехода. Электрон переходит с молекулярной орбитали симметрии b1 на разрыхляющую орбиталь * симметрии b2. При этом переходе электроны распределяются следующим образом:
a1 2 b2 2 a1 2 b1 2 a1 2 b2 2 a1 2 b1 1 b2 1 .
Симметрия электронного состояния ( *) будет определяться прямым произведением симметрий переходов, или в конечном итоге будет
определяться произведением b1 1 b2 1 .
284

E, см-1 |
а1 |
* |
|
* |
b2 |
n |
b1 |
px |
|
n |
а1 |
sp |
|
|
b2 |
|
а1 |
Рис. 6.8. Схема расположения уровней энергии связывающих и несвязывающих молекулярных орбиталей (МО) молекулы
Н2СО. Справа
Если произвести перемножениеобоз ач натипасимметриясимметрииМО b1 на тип симметрии b2 (см. таблицу характеров для точечной группы симметрии C2 ), то мы получим тип симметрии а2. С точки зрения типов симметрии электронных состояний этот переход обозначаем как A1 A2.
Анализируя таблицу характеров для этого типа перехода, мы видим, что он запрещен в дипольном приближении.
Рассуждая аналогичным образом, найдем тип симметрии перехода npx . Этот переход типа А1 В1, который в дипольном приближении
разрешен.
Таким образом, интерпретируя спектр поглощения формальдегида, который в ближнем ультрафиолете состоит из двух полос 270 нм (слабая) и 185 нм (сильная), можем резюмировать, что первый относится к типу 1A1 1A2 (запрещен в дипольном приближении), а второй - к типу
симметрии 1A1 1B1 |
(разрешен в |
дипольном приближении |
с силой |
|
осциллятора, близкой |
к единице). |
Цифра |
1 слева вверху |
означает |
синглетность перехода, т. е. переходы совершаются без изменения спинового числа ( S 0 ).
Слабое проявление поглощения в области 270 нм может быть связано с вибронным заимствованием интенсивности (см. спектр поглощения бензола). Можно показать, что за счет вибронного взаимодействия колебание b1 в молекуле формальдегида (колебания в молекуле Н2СО распределяется по следующим типам симметрии: N 3a1 b1 2b2 )
может быть ответственно за разрешение первого электронного перехода, так какпрямое произведение А2 на b1 дает тип симметрии B2, который
285

разрешен по правилам отбора. Таким образом, за счет вибронного взаимодействия с участием колебания b1 первый электронный переход в молекуле формальдегида Н2СО частично разрешается.
6.2.3. Молекула бензола С6Н6
В молекуле бензола 30 валентных электронов - 2s- и 2p-электронов атомов углерода (6 4 = 24) и шесть 1s электронов атомов водорода - образуют химические связи. Каждый атом углерода соединен с двумя соседними атомами углерода и одним водородом. При образовании этой молекулы осуществляется для атома углерода sp2-гибридизация. При этом в атоме углерода задействованы два 2р и один 2s электрон. Один электрон атома углерода своей 2рz-орбиталью ориентирован перпендикулярно плоскости и не задействован в -связях гибридной sp2-орбитали. Гибридная орбиталь в плоскости молекулы образует три -связи: две - связи с атомами углерода и одну -связь с атомом водорода. В этих связях задействовано 24 электрона (см. рис. 6.9).
Расположены эти -связи под углом 120° в одной плоскости в полном соответствии с рентгеноструктурными данными. Этим объясняется плоское строение молекулы бензола, имеющей форму правильного шестиугольника. Орбитали негибридизированных шести рz-электронов кольца молекулы расположены перпендикулярно плоскости
(см. рис. 6.10).
На рис. 6.10 изображены граничные поверхности волновых функций р-электронов атомов углерода. Прямые отрезки линий указывают на возможность перекрытия электронных облаков р-электронов.
Каждая р-орбиталь перекрывается с другими р- орбиталями с двух сторон. Поскольку в молекуле бензола все р-орбитали перекрываются друг с другом, то каждый р-электрон может быть около любого из атомов углерода. Эти электроны образуют -связи в молекуле бензола. При этом невозможно указать, каким атомам углерода принадлежит каждая из трех пар электронов, образующих эти связи. Поэтому говорят, что в молекуле бензола -связи являются делокализованными, т. е.-электроны в молекуле бензола свободно передвигаются в плоскости кольца углеродных атомов. Для полного насыщения -связей в молекуле С6Н6 необходимо 12 р-электронов, а в действительности имеется только шесть, т. е. -связи заполнены электронами только наполовину. Поскольку - связи в молекуле бензола являются делокализованными, то
структурную формулу C6H6 изображают следующим образом: |
|
|
|
|
|
. |
|
|
|
||||
286 |
|
|
|
|
|
|

H1
H6 |
|
1 |
|
|
|
H2 |
|
|
|
2 |
|
|
|
|
|
|
6 |
|
|
|
5 |
|
3 |
|
|
|
|
H5 |
|
4 |
|
|
|
H3 |
|
|
|
|
H4
Рис. 6.9 -связи в молекуле бензола
Отрезками прямых показаны делокализованные -связи. О том, что связи в молекуле бензола по своему характеру являются промежуточными между одинарными и двойными свидетельствует тот факт, что их длина, равная 1,40 Å, лежит между длинами одинарной и двойной связей, равных соответственно 1,54 и 1,32 Å (с точностью до 0,02 Ǻ).
|
|
|
|
Молекула бензола имеет плоское |
|
|
2 |
|
|
строение и относится к точечной груп- |
|
|
3 |
|
пе симметрии D6h (см. рис. 4.7 гл. 4). |
||
|
|
|
|||
|
|
|
|
Осью высшего порядка является ось |
|
1 |
|
|
4 |
симметрии шестого порядка, проходя- |
|
|
|
|
щая перпендикулярно плоскости ри- |
||
|
|
|
|
||
6 |
|
5 |
|
сунка. Кроме того, вдоль оси шестого |
|
|
|
|
|
порядка расположены две оси 3-го и |
|
|
|
|
|
одна ось 2-го порядка. В плоскости мо- |
|
|
|
|
|
лекулы, перпендикулярной оси шесто- |
|
Рис. 6.10. Расположение pz |
го порядка, расположены две группы |
||||
осей второго порядка, каждая из кото- |
|||||
орбиталей в молекуле |
|
||||
|
рых состоит из трех элементов (обо- |
||||
бензола |
|
|
|
||
|
|
|
|
||
значены оси соответственно |
|||||
C2 |
и C2 ). Молекула имеет горизонтальную |
||||
плоскость симметрии h (совпадающую с плоскостью ху), три верти-
кальные плоскости и три диагональные плоскости d, одна из которых совпадает с плоскостью yz. Центр инверсии i совпадает с началом координат. Кроме перечисленных элементов симметрии молекула имеет по две зеркально-поворотные оси типа S3 и S6. В итоге получаем точечную
287

группу симметрии D6h, которая включает следующие операции симмет-
рии: I, 2C6, 2C3, C2, 3С2',3C2 , i, 2S3, 2S6, h, 3 d, 3 .
Для отнесения электронных состояний молекулы бензола по типам симметрии воспользуемся методом молекулярных орбиталей (МО), который позволяет находить результирующую симметрию электронного состояния на основании данных о симметрии волновых функций, описывающих это состояние. Будем рассматривать только самые внешние шесть 2р электронов. Для них запишем молекулярную орбиталь в виде
C1 1 C2 2 C3 3 ... C6 6 , |
(6.6) |
где 1, 2,… 6 – атомные pz – орбитали атомов углерода. Коэффициенты Сi находятся из условия Ci2 1 (i = 1, 2, …, 6). Общий вид волновых
i
функций (МО) по Хюккелю можно записать следующим образом:
1 1 |
|
|
1 2 3 4 5 6 , |
|
||||||
6 |
|
|||||||||
2 1 2 |
|
|
|
1 2 3 4 5 6 , |
|
|||||
3 |
|
|||||||||
3 1 2 2 3 5 6 , |
(6.7) |
|||||||||
4 1 2 2 3 5 6 , |
||||||||||
|
||||||||||
5 1 2 |
|
|
1 2 3 4 5 6 , |
|
||||||
3 |
|
|||||||||
6 1 |
|
|
1 2 3 4 5 6 . |
|
||||||
|
6 |
|
||||||||
Решая уравнение Шредингера с указанными волновыми функциями, получим шесть значений энергии Е1, Е2, ...Е6, соответствующих шести МО. Однако, значения энергии Е2 = Е3, и Е4 = Е5 равны, т. е. волновые функции 2 и 3, а также 4 и 5 составляют вырожденные наборы орбиталей. Для установления симметрии этих орбиталей воспользуемся теорией групп.
Атомная орбиталь i атома углерода (2pz-орбиталь) антисимметрична по отношению к плоскости молекулы. Свойства преобразований шести функций i под действием различных элементов симметрии точечной группы D6h можно получить следующим образом. Например, рассмотрим операцию поворота молекулы С6Н6 на 60° вокруг оси шестого порядка. При этой операции функция переходит в 2, а функция 2 в 3 и т.д. Характер этой операции симметрии будет равен нулю, так как при этой операции ни один из атомов не остается на месте. Операция отражения в плоскости молекулы ( h) переводит каждую функцию в саму себя с изменением знака на обратный. Легко показать, что характер этой опера-
288
ции равен 6. Операция отражения в плоскости симметрии, проходящей через атомы С1 и С4, оставляет 1 и 4 без изменений, а функцию 2 переводит в 6, а 3 в 5. Характер этой операции будет равен +2. Аналогичным образом можно рассмотреть и все остальные операции симметрии. Мы получаем таким образом приводимое представление точечной группы симметрии D6h, которое будет иметь следующие характеры:
|
I |
C6 |
C3 |
C2 |
C2' |
C2'' |
i |
S3 |
S6 |
h |
d |
|
Г(R) |
+6 |
0 |
0 |
0 |
-2 |
0 |
0 |
0 |
0 |
-6 |
0 |
+2 |
Этот набор чисел складывается из наборов характеров неприводимых представлений a2u, b2g, e1g, e2u. Следовательно, орбитальные волновые функции, получающиеся из 2pz – атомных функций углерода, всегда должны принадлежать указанным выше неприводимым представлениям, если симметрия молекулы сохраняется D6h.
Первые три орбитали и будут связывающими, и по энергии они расположены ниже, чем остальные три. Первая орбиталь относится к типу симметрии a2u, и 3 составляют вырожденный набор орбиталей типа симметрии e1g с одним узлом в плоскости молекулы. Орбитали исоставляют вырожденный набор разрыхляюших орбиталей с двумя узлами в плоскости молекулы (тип симметрии e2u). – орбиталь характеризуется разрыхляющим характером и содержит три узла в плоскости молекулы (тип симметрии b2g).
Схематически вид орбиталей показан на рис. 6.11. Здесь приведена только часть волновых функций, которая расположена над плоскостью (фаза атомной орбитали на i-м атоме углерода определяется знаком функции i в разложениях).
289

1 |
3 |
|
2 |
4 |
6 |
|
5 |
Рис. 6.11. Форма волновых функций из шести 2р-
орбиталей атомов углерода в молекуле С6Н6
Расстояния от контурных линий, которыми обведены атомы, до каждого из них пропорциональны величине коэффициента при орбитали разложения.
Сплошными линиями обозначены зоны положительных значений молекулярных орбиталей, а штриховыми – зоны отрицательных значений. Узловые плоскости, проходящие через ось z, отмечены штриховыми линиями. Приведенные функции имеют соответсвенно 0, 1, 2, и 3 узловые плоскости. Энергия орбиталей растет с увеличением числа узловых плоскостей. Наименьшей энергией обладает орбиталь симметрии a2u, не имеющая узловых плоскостей. Затем в порядке возрастания энергии следуют e1g и e2u – орбитали. Наконец, самой высокой оказывается орбиталь b2g с тремя узлами в плоскости молекулы.
Общая схема энергетических уровней молекулы бензола приведена на рис.6.12
290

Е, см–1 Е6
b2g
Е4 = Е5 |
|
e2u |
|
Е2 = Е3 |
|
|
e1g |
|
|
|
|||
Е1 |
|
a2u |
||
|
|
|
|
|
Все шесть -электронов молекулы бензола согласно принципу Паули займут два нижних энергетических состояния: 2 электрона на орбитали a2u и 4 электрона на орбитали e1g. Основная конфигурация бензола (учитывается только его -электронная система) записывается следующим образом:
a2u 2 e1g 4 .
С точки зрения теории групп заполненные подоболочки всегда относятся к полносимметричному представлению. Таким образом, нижнее состояние молекулы бензола A1g. При поглощении кванта света электрон из молекулярной орбитали e1g переводится на орбиталь e2u C точки зрения электронной конфигурации это записывается следующим образом
(a2u)2(e1g)4 (a2u)2(e1g)3 (e2u)1.
Для определения симметрии этого состояния надо найти прямое произведение скобок. Однако ясно, что
a2u a2u = a1g, а |
e1g e1g e1g = e1g. |
следовательно, симметрия результирующего состояниия (a2u)2(e1g)3(e2u)1 есть прямое произведение e1g e2u = B2u + B1u + E1u. Симметрия электронных состояний обозначается большими прописными буквами.
Таким образом, первое возбужденное состояние бензола дает три отрбитальных состояния, которые соответствуют случайному вырождению. За счет электронного взаимодействия вырождение снимается, и эти
291
состояния располагаются в порядке возрастания энергии B2u, B1u и E1u. Расположение указанных состояний по энергии производится путем сравнения результатов теоретического расчета с экспериментом. Следовательно, первый длинноволнывой электронный переход типа 1А1g 1B2u
вмолекуле бензола запрещен по симметрии (см. рис. 6.27).
6.3.ПРИНЦИП ФРАНКА – КОНДОНА ДЛЯ МНОГОАТОМНЫХ МОЛЕКУЛ
Прежде чем рассматривать электронные спектры конкретных молекул, предварительно познакомимся с одним из важнейших ус-
ловий, формирующих электронно-колебательные спектры много-
атомных молекул, принципом Франка – Кондона. Он впервые был сформулирован Франком и обоснован в квантовой механике Кондо-
ном и касался электронно-колебательного спектра двухатомной мо-
лекулы. Основывался он на адиабатическом приближении, т. е.
предполагалось, что в двухатомной молекуле имеются частицы (яд-
ра), которые движутся сравнительно медленно по отношению к электронам. Поэтому во многих задачах механики можно рассмат-
ривать движение электронов в поле неподвижных ядер. Формули-
ровка этого принципа выглядела следующим образом: при погло-
щении света переход электрона из нижнего электронного состояния в верхнее (возбужденное) происходит настолько быстро, что за это время ни скорость ядер, ни положение их в пространстве заметно не изменяется. Применение этого принципа к многоатомным молеку-
лам позволяет понять многие черты формирования электронно-
колебательного спектра многоатомной молекулы.
Особенность многоатомной нелинейной молекулы, по сравнению с двухатомной состоит в том, что многоатомная молекула имеет
292
