
- •Ііі. Змістовий модуль 2
- •Хвильова функція та її фізичний зміст. Рівняння Шредінгера
- •Спектральні серії випромінювання атомів. Досліди Резерфорда. Постулати Бора. Квантово-механічна інтерпретація постулатів Бора. Принцип відповідностей. Досліди Франка і Герца
- •Квантові числа в атомі. Квантування енергії моменту імпульсу та проекції імпульсу. Досліди Штерна і Герлаха. Спін і магнітний момент електрона
- •Принцип Паулі. Електронні шари складних атомів
- •Спектри багатоелектронних атомів. Ефект Зеємана
- •Природа характеристичних рентгенівських променів. Закон Мозлі
- •Поняття про хімічний зв’язок і валентність. Молекулярні спектри
- •Спонтанне та індуковане випромінювання. Квантові генератори (лазери), їх застосування
- •Практичне заняття 2.1 Тема: Хвилі де Бройля Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.2 Тема: Рівняння Шредінгера Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.3
- •Тема: Постулати Бора. Квантові числа в атомі.
- •Періодична система елементів д.І. Менделєєва
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.4 Тема: Характеристичне рентгенівське випромінювання Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Перелік компетентностей другого змістового модуля
- •Рівняння Шредінгера. Атом водню за Бором. Закон Мозлі Задачі
Природа характеристичних рентгенівських променів. Закон Мозлі
Характеристичне рентгенівське випромінювання виникає внаслідок того, що потужне катодне проміння, проникаючи у глибину електронних оболонок атомів, вириває електрони з нижніх шарів і спричиняє вихід їх за межі атома. Якщо, наприклад, електрон буде вирваний з шару К, то на його місце переміститься електрон з якого-небудь дальшого шару L, M, і т.д. На вивільнене місце у дальшому шарі перейде електрон з ще дальшого шару. При таких переходах електронів у важких атомах випромінюються фотони рентгенівського проміння. Оскільки енергія фотонів визначається різницею енергетичних рівнів атомів даної речовини, то випромінювання такого типу дає лінійчатий спектр, характерний для речовини анода.
Я кщо
енергія електронів, які бомбардують,
збільшується (збільшується напруга між
катодом та анодом), то на фоні суцільного
спектра рентгенівського випромінювання
з’являються лінійчаті спектри. Частота
цих ліній у спектрі залежить від природи
речовини, з якої виготовлений анод. Тому
дане випромінювання називаютьхарактеристичним,
оскільки
воно характеризує анод.
кщо
енергія електронів, які бомбардують,
збільшується (збільшується напруга між
катодом та анодом), то на фоні суцільного
спектра рентгенівського випромінювання
з’являються лінійчаті спектри. Частота
цих ліній у спектрі залежить від природи
речовини, з якої виготовлений анод. Тому
дане випромінювання називаютьхарактеристичним,
оскільки
воно характеризує анод.
Електрон, що має досить велику енергію, може вирвати інший електрон (віддати йому частину енергії), що знаходиться на глибинних забудованих електронних оболонках анода.
Внаслідок цього на “вакантне” місце електрона, що вирвався, переміщається електрон з верхнього енергетичного стану, після чого випромінюється фотон характеристичного рентгенівського випромінювання.
Схема виникнення рентгенівських спектрів
Рентгенівські
спектри складаються з декількох серій,
що позначаються буквами
![]() .
Кожна серія має певну кількість ліній,
які позначаються
.
Кожна серія має певну кількість ліній,
які позначаються![]() ,
…(
,
…(![]() ,
…;
,
…;![]() …і т.д.) (рис. 2.19).
…і т.д.) (рис. 2.19).
У
1913 році англійський вчений Мозлі
встановив закон, що визначає частоти в
характеристичних спектрах речовини в
залежності від атомного номера
![]() .
.
Закон Мозлі
 ,
,
де
![]() − стала Бальмера -Рідберга,
− стала Бальмера -Рідберга,![]() ;
;
![]() −атомний
(порядковий) номер;
−атомний
(порядковий) номер;
![]() −стала
екранування (фізичний зміст: поправка
до сили, з якою електрон притягується
до ядра; цю дію ядра послаблюють електрони,
розміщені до нього ближче, ніж перехідний
електрон;
−стала
екранування (фізичний зміст: поправка
до сили, з якою електрон притягується
до ядра; цю дію ядра послаблюють електрони,
розміщені до нього ближче, ніж перехідний
електрон;
![]() для
для![]() - серії,
- серії,![]() для
для![]() - серії);
- серії);
![]() −енергетичний
рівень, на який переходить електрон;
−енергетичний
рівень, на який переходить електрон;
![]() −енергетичний
рівень, з якого переходить електрон.
−енергетичний
рівень, з якого переходить електрон.
Зазвичай закон Мозлі виражають формулою:
![]() ,
,
де
![]() − функція атомного номера елемента,
− функція атомного номера елемента,![]() − константа.
− константа.
Значення закону Мозлі: дозволяє за визначеною частотою рентгенівських ліній встановити атомний номер даного елемента; закон Мозлі довів справедливість ядерної моделі та періодичний закон системи елементів Менделєєва.
Поняття про хімічний зв’язок і валентність. Молекулярні спектри
Валентність та хімічний зв’язок
Валентністю називають здатність атомів елементів утворювати хімічні зв’язки. Кількісно валентність характеризується числом. Її можна розглядати як здатність атома віддавати чи приєднувати певне число електронів зовнішніх електронних оболонок (валентних електронів).
У випадку іонного зв’язку валентність – це число відданих чи приєднаних даним атомом електронів. У випадку ковалентного зв’язку валентність дорівнює числу усуспільнених електронних пар. Багато елементів можуть мати різну валентність залежно від того, до яких сполук вони входять.
Енергія і спектри молекул
Повна енергія молекули складається з кількох частин:
1)
![]() – енергії руху електронів в атомах
молекули;
– енергії руху електронів в атомах
молекули;
2)
![]() – енергії коливального руху ядер атомів,
які входять до складу молекули, навколо
їхніх положень рівноваги;
– енергії коливального руху ядер атомів,
які входять до складу молекули, навколо
їхніх положень рівноваги;
3)
![]() – енергії обертального руху молекул
як цілого.
– енергії обертального руху молекул
як цілого.
Повна енергія молекули:
![]() .
.
Коливальна енергія визначається за формулою:
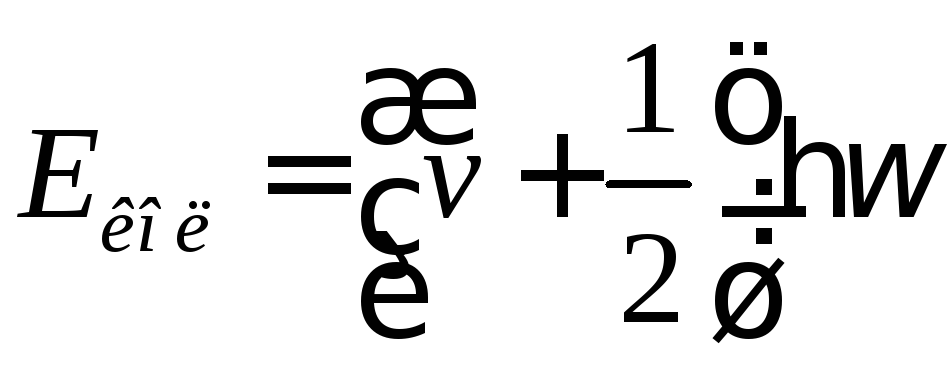 ,
,
де
![]() – коливальне квантове число.
– коливальне квантове число.
Обертальна енергія
 ,
,
де J = 0, 1, 2, 3,... – обертальне квантове число; I – момент інерції молекули відносно осі, яка проходить через її центр мас.
Тоді повну енергію молекули можна записати так:
 .
.
За правилом частот Бора, частота кванта, що його випромінює молекула під час зміни свого енергетичного стану, така:
 ,
,
де
![]() – зміна відповідної частини енергії
молекули.
– зміна відповідної частини енергії
молекули.
Можливі тільки такі зміни коливальної і обертальної енергій молекули, при яких коливальне і обертальне квантові числа змінюються на одиницю, тобто для цих квантових чисел має виконуватися правило добору:
![]() ;
;
![]() .
.
Як показують експерименти та теоретичні дослідження, складові повної енергії молекули задовольняють такі нерівності:
![]() .
.
Саме цим пояснюється існування частот молекулярних спектрів у різних діапазонах електромагнітних хвиль.
Як
відомо, спектри випромінювання і
поглинання оборотні. Зручніше вивчати
спектри поглинання. Тому розглянемо
утворення саме цих спектрів молекули.
Доти, доки енергія
![]() кванта, який падає на речовину, не
дорівнюватиме найменшій можливій
різниці енергій між двома найближчими
енергетичними рівнями молекули,
поглинання світла не відбувається і
лінії спектра поглинання не утворюються.
Поглинання починається при довжинах
хвиль приблизно 0,1 – 1 мм, тобто
в далекій інфрачервоній частині спектра,
і відповідає зміні обертальної енергії
молекули. Утворюється спектральна лінія
обертального спектра. Поглинання світла
в інфрачервоній області з довжиною
хвилі від 1 до 10мкм
викликає переходи між коливальними
енергетичними рівнями в молекулі,
внаслідок чого утворюється коливальний
спектр молекули. Проте виникають і
обертальні переходи, тобто збуджуються
коливально-обертальні спектри.
Коливально-обертальний спектр складається
з групи дуже близьких ліній, які
відповідають різним обертальним
переходам. Якщо спектральний прилад
має низьку роздільну здатність, ці лінії
зливаються в одну смугу, яка відповідає
певному коливальному переходу.
кванта, який падає на речовину, не
дорівнюватиме найменшій можливій
різниці енергій між двома найближчими
енергетичними рівнями молекули,
поглинання світла не відбувається і
лінії спектра поглинання не утворюються.
Поглинання починається при довжинах
хвиль приблизно 0,1 – 1 мм, тобто
в далекій інфрачервоній частині спектра,
і відповідає зміні обертальної енергії
молекули. Утворюється спектральна лінія
обертального спектра. Поглинання світла
в інфрачервоній області з довжиною
хвилі від 1 до 10мкм
викликає переходи між коливальними
енергетичними рівнями в молекулі,
внаслідок чого утворюється коливальний
спектр молекули. Проте виникають і
обертальні переходи, тобто збуджуються
коливально-обертальні спектри.
Коливально-обертальний спектр складається
з групи дуже близьких ліній, які
відповідають різним обертальним
переходам. Якщо спектральний прилад
має низьку роздільну здатність, ці лінії
зливаються в одну смугу, яка відповідає
певному коливальному переходу.
У видимій та ультрафіолетовій областях спектра енергії квантів достатньо для того, щоб викликати переходи молекул між різними електронними енергетичними рівнями. Проте водночас збуджуються і коливальні переходи, тобто утворюються електронно-коливальні спектри молекули. Електронно-коливальний спектр у видимій і близькій до неї областях являє собою систему з кількох груп смуг. Таким чином, усі спектри молекули мають вигляд смуг, які складаються, у свою чергу, з окремих ліній. Тому спектри молекули називають смугастими.
Отже, спектри випромінювання і поглинання поділяються на три групи:
1) суцільні, що їх утворюють нагріті тверді тіла;
2) лінійчаті, які утворюються атомами речовин, що перебувають у газоподібному стані;
3) смугасті, що утворюються молекулами газоподібних речовин.
Комбінаційне розсіювання світла
Розсіювання світла – явище взаємодії світла з речовиною, в результаті якого змінюється напрям поширення світлових променів і виникає невласне світіння речовини.
У
1928 році радянські вчені Ландсберг та
Мандельштам і одночасно індійські
фізики Раман та Крішнан відкрили явище,
що отримало назву комбінаційне
розсіювання світла,
що пояснюється квантовою теорією
взаємодії випромінювання з речовиною,
за якою елементарний
одиничний
акт розсіювання світла розглядається
як поглинання частинкою речовини фотона,
який падає на неї з енергією
![]() .
Внаслідок розсіювання світла випромінюється
вторинний фотон з частотою, що відрізняється
від
.
Внаслідок розсіювання світла випромінюється
вторинний фотон з частотою, що відрізняється
від![]() на певну величину
на певну величину![]() .
.
Згідно квантової теорії, процес розсіювання світла можна розглядати як непружне співударяння фотонів з молекулами. При цьому фотон може віддати молекулі чи отримати від неї лише такі кількості енергії, які рівні різницям двох її енергетичних рівнів.
Вивчення комбінаційного розсіювання дає багато відомостей про будову молекул; можна визначити власну частоту коливання молекул, судити про характер симетрії молекули. За допомогою цього методу здійснюють аналіз складних молекулярних сумішей, особливо органічних молекул.
Люмінесценція
Люмінесценцією називається не теплове випромінювання тіл, яке збуджується різними факторами і має тривалість більшу за період світлових хвиль (10-10 с). Люмінесценція належить до нерівноважного випромінювання, оскільки збуджується додатковими джерелами енергії. Люмінесценція виникає при переході електрона в атомі з більш віддаленої орбіти на ближчу до ядра орбіту. Спектр люмінесценції містить лінії з певною довжиною хвилі і залежить від структури даного атома. Атом може випромінювати лише в тому випадку, якщо він знаходиться у збудженому стані, тобто якщо електрони попередньо переведені на більш високі орбіти. Існує декілька видів люмінесценції, які розрізняють за причиною її збудження.
Фотолюмінесценція, яка виникає при світловому збудженні.
Електролюмінесценція, що виникає при збудженні електричним полем.
Катодолюмінесценція, причиною якої є опромінення електронами.
Хемілюмінесценція, яка супроводжує, наприклад, процеси гниття.
За тривалістю збудженого стану атомів розрізняють:
флуоресценція, що збуджується більш короткохвильовим електромагнітним випромінюванням чи потоком частинок (електронів, протонів,
 -
частинок та ін.); швидко затухає: час
світіння
-
частинок та ін.); швидко затухає: час
світіння ;
;фосфоресценція – флуоресценція у вигляді залежного від температури після свічення, що виникає після припинення опромінення; тривалий час світіння: більше
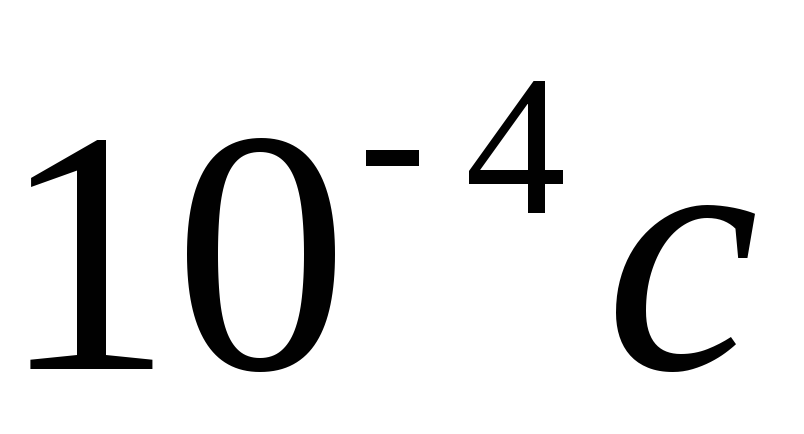 .
.
У природі явище люмінесценції спостерігають при північному сяйві, світінні деяких комах, мінералів, гнитті дерев тощо. Люмінесценція може мати суцільний, лінійчатий і смугастий спектри випромінювання, лінії яких визначаються складом люмінофору – речовини, що випромінює люмінесцентне світіння.
Люмінесценція
широко використовується для створення
потужних та економічних джерел світла
(ртутні, натрієві, неонові лампи денного
світла). Аналіз спектра люмінесценції
дає змогу визначити незначні домішки
(порядку
![]() %)
у речовині.
%)
у речовині.
