
- •Ііі. Змістовий модуль 2
- •Хвильова функція та її фізичний зміст. Рівняння Шредінгера
- •Спектральні серії випромінювання атомів. Досліди Резерфорда. Постулати Бора. Квантово-механічна інтерпретація постулатів Бора. Принцип відповідностей. Досліди Франка і Герца
- •Квантові числа в атомі. Квантування енергії моменту імпульсу та проекції імпульсу. Досліди Штерна і Герлаха. Спін і магнітний момент електрона
- •Принцип Паулі. Електронні шари складних атомів
- •Спектри багатоелектронних атомів. Ефект Зеємана
- •Природа характеристичних рентгенівських променів. Закон Мозлі
- •Поняття про хімічний зв’язок і валентність. Молекулярні спектри
- •Спонтанне та індуковане випромінювання. Квантові генератори (лазери), їх застосування
- •Практичне заняття 2.1 Тема: Хвилі де Бройля Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.2 Тема: Рівняння Шредінгера Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.3
- •Тема: Постулати Бора. Квантові числа в атомі.
- •Періодична система елементів д.І. Менделєєва
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.4 Тема: Характеристичне рентгенівське випромінювання Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Перелік компетентностей другого змістового модуля
- •Рівняння Шредінгера. Атом водню за Бором. Закон Мозлі Задачі
Принцип Паулі. Електронні шари складних атомів
У результаті вивчення хімічних та фізичних властивостей елементів Д. І. Менделєєв встановив, що із зростанням атомної маси елементів їх властивості періодично повторюються. У 1869 р. він побудував періодичну систему елементів. Це було одним з найвизначніших відкриттів XIX ст. На основі періодичного закону Менделєєва були передбачені нові, ще невідомі елементи, які було відкрито тільки через деякий час (галій, скандій, германій, гелій та ін.). Проте в чотирьох місцях таблиці вищий порядковий номер треба було надати елементам з меншою атомною масою: 18 – Аr 39,944; 27 – Co 58,94; 52 – Те 127,61; 90 – Th 232,05; 19 – К 39,100; 28 – Ni 58,69; 53 – J 126,91; 91 – Pa 231. Ці місця потребували додаткових пояснень.
Важливе значення для пояснення системи Менделєєва з погляду внутрішньої будови атомів мали праці Мозлі, Бора, Зоммерфельда і Паулі.
У процесі вивчення будови атома було встановлено, що в основу класифікації елементів треба покласти не атомну масу, а зарядове число ядра атома Z, що відповідає порядковому номеру елемента в таблиці Менделєєва. Дослідження показали, що подібність фізико-хімічних властивостей елементів, які належать одному періоду, поширюється також на їх атомні спектри. Так, подібні між собою спектри всіх лужних металів, спектри всіх лужноземельних елементів і т. д.
Відповідно до квантової механіки, яка описує внутрішній механізм будови атома, періодичність у властивостях елементів є наслідком періодичності у заповненні електронних шарів в атомах. Під електронним шаром розуміють сукупність електронів, стан руху яких характеризується однаковим значенням головного квантового числа п. Новий період таблиці Менделєєва відкривається елементом, в якого починає формуватися новий шар; отже, номер періоду збігається з величиною головного квантового числа електронного шару, найбільш віддаленого від атомного ядра. Саме кількістю і розміщенням зовнішніх так званих валентних електронів в атомі визначаються фізико-хімічні властивості елементів.
Порядок
заповнення шарів електронами і можлива
кількість електронів у кожному шарі
визначаються принципом
мінімуму енергії та
принципом
Паулі. Відповідно
до принципу мінімуму енергії, заповнення
електронами шарів у незбуджених атомах
відбувається в порядку заміщення місць,
що відповідають мінімуму енергії атома.
При цьомуслід зауважити, що енергія стану електрона
в атомі залежить в основному від квантових
чиселп
і
l.
Тому в кожному електронному шарі, що
характеризується головним квантовим
числом п,
розрізняють
ще електронні підгрупи, які характеризуються
однаковим квантовим числом l.
Суть принципу Паулі така. У результаті
аналізу схеми спектральних термів
різних атомів швейцарський фізик Паулі
у 1924 р. дійшов висновку, що в атомі
не може бути двох або більше електронів,
які б перебували в однакових станах.
Оскільки
стан кожного електрона в атомі
характеризується чотирма квантовими
числами п,
l, m,
s,
то за принципом Паулі, в тому самому
атомі (або в будь-якій квантовій системі)
не може бути хоча б двох електронів з
однаковою сукупністю чотирьох квантових
чисел.
Підрахуємо, яку максимальну кількість електронів може включати один шар, що йому відповідає задане головне квантове число п. Згідно з принципом Паулі всі ці електрони мають відрізнятися хоча б одним квантовим числом із чотирьох.
Отже, відомо, що стан кожного електрона в атомі характеризується чотирма квантовими числами:
– головним
квантовим числом n = 1,2,
3,...,![]() ;
;
– орбітальним квантовим числом l = 0, 1, 2,..., (n - 1);
– магнітним квантовим числом m = 0, ±1, ±2, ±3,..., ± l;
– магнітним
спіновим квантовим числом
 .
.
За
принципом Паулі можна визначити кількість
електронів, які мають однакові чотири,
три, два і одне квантове число. Наприклад,
максимальна кількість
![]() електронів, які перебувають у станах,
що визначаються чотирма квантовими
числами, така:
електронів, які перебувають у станах,
що визначаються чотирма квантовими
числами, така:
![]() або
1.
або
1.
Максимальна
кількість
![]() електронів, які перебувають у станах,
що визначаються трьома квантовими
числами:
електронів, які перебувають у станах,
що визначаються трьома квантовими
числами:
![]() ,
,
тобто відрізняються орієнтацією спінів.
Максимальна
кількість
![]() електронів, які перебувають у станах,
що визначаються двома квантовими
числами:
електронів, які перебувають у станах,
що визначаються двома квантовими
числами:
![]() .
.
За останнім числом знаходять максимальну кількість так званих еквівалентних, або іменованих, електронів у п-му шарі багатоелектронного атома, а саме в ньому може бути:
(l = 0); s-електронів 2,
(l = 1); p-електронів 6,
(l = 2); d-електронів 10,
(l = 3); f-електронів 14 і т. д.
Максимальна
кількість
![]() електронів, які перебувають у станах,
що визначаються одним квантовим числом:
електронів, які перебувають у станах,
що визначаються одним квантовим числом:
 .
.
Отже, відповідно до принципу Паулі, максимальна кількість електронів в одному електронному шарі атома дорівнює 2n2, де п – головне квантове число або номер електронного шару атома.
Звичайно електронні шари атомів позначають символами:
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
K |
L |
M |
N |
O |
P |
Q |
У таблиці 2.1 наведено максимальну кількість електронів, які перебувають у станах, що характеризуються певними значеннями головного й орбітального квантових чисел.
Якщо
електрони перебувають у деяких станах
із певними значеннями квантових чисел
n
і l,
вважається відомою так звана електронна
конфігурація. Наприклад, основний стан
атома кисню можна записати символічною
формулою так:
![]() .
На першому місці стоїть цифра, яка
визначає головне квантове число, на
другому – символ, який позначає
орбітальне квантове число, а його верхній
індекс відповідає кількості електронів,
які мають однакове головне та орбітальне
квантові числа.
Саме
принцип Паулі пояснює будову періодичної
системи елементів Д. І. Менделєєва.
.
На першому місці стоїть цифра, яка
визначає головне квантове число, на
другому – символ, який позначає
орбітальне квантове число, а його верхній
індекс відповідає кількості електронів,
які мають однакове головне та орбітальне
квантові числа.
Саме
принцип Паулі пояснює будову періодичної
системи елементів Д. І. Менделєєва.
Таблиця 2.1
|
n |
Оболонка |
Кількість електронів у станах |
Максимальна кількість електронів | ||||
|
|
|
s
|
p
|
d
|
f
|
g
|
|
|
1 |
К |
2 |
– |
– |
– |
– |
2 |
|
2 |
L |
2 |
6 |
– |
– |
– |
8 |
|
3 |
М |
2 |
6 |
10 |
– |
– |
18 |
|
4 |
N |
2 |
6 |
10 |
14 |
– |
32 |
|
5 |
О |
2 |
6 |
10 |
14 |
18 |
50 |
|
|
… |
… |
… |
… |
… |
… |
… |
Максимально
можливе число електронів у даній оболонці
(кількість станів у електронній оболонці):
![]() .
.
Періодична система елементів Менделєєва (1869 р.)
Хімічні й фізичні властивості елементів пояснюються схожістю забудови електронних оболонок їх атомів, що здійснюється за двома принципами (таб. 2.2):
принцип Паулі;
принцип мінімальної енергії електрона.
Таблиця 2.2
|
період |
Z |
елемент |
Шари | ||||||
|
K 1s |
L 2s2p |
M 3s3p3d |
N 4s4p4d4f |
O 5s5p5d5f |
P 6s6p6d |
Q 7s | |||
|
І |
1 |
H |
1 |
|
|
|
|
|
|
|
2 |
He |
2 | |||||||
|
ІІ |
3 |
Li |
2 |
1 |
|
|
|
|
|
|
4-9 |
Be-F |
| |||||||
|
10 |
Ne |
2 |
2;6 |
|
|
|
|
| |
|
ІІІ |
11 |
Na |
2 |
2;6 |
1 |
|
|
|
|
|
12-17 |
Mg-Cl |
| |||||||
|
18 |
Ar |
2 |
2;6 |
2;6 |
|
|
|
| |
|
IV |
19 |
K |
2 |
2;6 |
2;6;- |
1 |
|
|
|
|
20 |
Ca |
2 |
2;6 |
2;6;- |
2 |
|
|
| |
|
21 |
Sc |
2 |
2;6 |
2;6;1 |
2 |
|
|
| |
|
22-28 |
Ti-Ni |
| |||||||
|
29 |
Cu |
2 |
2;6 |
2;6;10 |
1 |
|
|
| |
|
30-35 |
Zn-Br |
| |||||||
|
36 |
Kr |
2 |
2;6 |
2;6;10 |
2;6 |
|
|
| |
|
… |
… |
… |
… |
… |
… |
… |
… |
… |
… |
Найважливіше
при побудові періодичної системи −
зарядове число (порядок зростання
![]() ).
).
Кожен період починається із забудови наступної електронної оболонки. У деяких випадках буває недобудованою зовнішня оболонка, оскільки електрони в атомі розташовані таким чином, що вся система повинна мати мінімальну кількість енергії (як і будь-яка система). Виконується принцип Паулі: в атомі жодні два електрони не можуть мати всі співпадаючі квантові числа.
Про
те, що система прямує до мінімальної
енергії, говорить той факт, що в періодичній
системі є два типи елементів: лантаноїди
та актиноїди (в лантаноїдах добудовується
4 шар; щодо актиноїдів,
![]() має 32 електрони в четвертому шарі).
має 32 електрони в четвертому шарі).
Розглянемо послідовність заповнення електронами станів в атомах деяких хімічних елементів, які перебувають в основному стані.
Z = 1.
Атом
водню.
В атомі водню єдиний електрон перебуває
у стані 1s,
який характеризується квантовими
числами n = 1,
l = 0,
m = 0,
 .
.
Z = 2.
Атом
гелію.
В атомі гелію існує два електрони. Другий
електрон цього атома також може перебувати
у стані 1s,
тобто n = 1,
l = 0,
m = 0,
але спін другого електрона має бути
орієнтований протилежно спіну першого:
для одного з них
 ,
а для другого –
,
а для другого –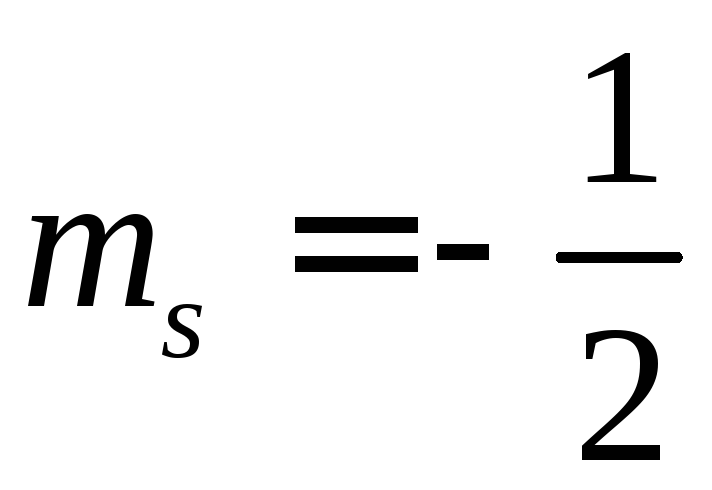 .
Так цілком заповнюєтьсяK
-
оболонка, що відповідає завершенню
першого періоду системи Менделєєва.
.
Так цілком заповнюєтьсяK
-
оболонка, що відповідає завершенню
першого періоду системи Менделєєва.
Z = 3. Атом літію. Атом літію має три електрони. Однак за принципом Паулі третій електрон атома літію не може розміститися на K - оболонці і займає найнижчий енергетичний стан на L - оболонці. Таким станом є стан 2s: n = 2, l = 0, m = 0. Літій розпочинає другий період періодичної системи.
Z = 4 – 10. Четвертий електрон берилію (Z = 4) перебуває також у стані 2s, а п'ятий електрон бору (Z = 5) має набути високого енергетичного стану 2р, тобто n = 2, l = 1. До неону (Z = 10) електрони всіх атомів розміщуються в підоболонці з l = 1 і n = 2. У неону максимально можлива кількість таких електронів у цьому стані дорівнює 6. Таким чином, L - оболонку неону цілком заповнено, і на цьому завершується другий період періодичної системи Менделєєва.
Z = 11. Атом натрію. Одинадцятий електрон натрію розміщується вже в М - оболонці і набуває найнижчого стану 3s. Далі послідовно заповнюється M - оболонка, і в аргону (Z = 18) закінчується заповнення всіх станів підоболонки Зр. На цьому завершується третій період періодичної системи.
Z = 19. Атом калію. Дев'ятнадцятий електрон калію мав би перебувати у стані 3d в M - оболонці. Однак хімічні та оптичні властивості калію, як показує дослід, аналогічні властивостям літію і натрію, валентний електрон яких перебуває в s-стані. Отже, починаючи з калію, коли ще не заповнено 3d підоболонку М - оболонки, уже заповнюється N - оболонка. Це означає, що енергія електрона у стані 4s менша, ніж у стані 3d. Спектроскопічні та хімічні властивості кальцію (Z = 20) показують, що його двадцятий електрон також перебуває у стані 4s N - оболонки. Починаючи зі скандію (Z = 21), поновлюється нормальне заповнення підоболонки 3d, яке закінчується у міді (Z = 29). Далі, до криптону (Z = 36) відбувається нормальне заповнення N - оболонки. Криптон завершує четвертий період періодичної системи елементів.
Далі аналогічно починає заповнюватися стан 5s О - оболонки, коли не заповнено N - оболонку. Починаючи з ітрію (Z = 39) і до паладію (Z = 46), заповнюється підоболонка 4d.
Описані закономірності щодо послідовності заповнення електронних підоболонок і оболонок в атомах хімічних елементів повторюються далі в кожному періоді.
Отже, періодичність хімічних властивостей елементів пояснюється повторюваністю електронних конфігурацій у зовнішніх електронних підоболонках в атомах сімей елементів.
Теоретичне пояснення періодичного закону Менделєєва – це найвидатніше досягнення квантової фізики.
