
- •V. Змістовий модуль 4
- •Структурні особливості кристалів
- •Елементи квантової фізики кристалів
- •Поняття про квантові статистики
- •Властивості металів
- •Зонна теорія кристалів. Утворення енергетичних зон у кристалах
- •Закони збереження в мікросвіті. Сучасна фізична картина світу. Досягнення та проблеми сучасної фізики. Роль українських вчених у розвитку фізики
- •Практичне заняття 4.1 Конденсований стан речовини Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Перелік компетентностей четвертого змістового модуля
- •Конденсований стан речовини.
V. Змістовий модуль 4
Квантові явища в твердих тілах.
Сучасна фізична картина світу.
Роль українських вчених у розвитку фізики
Теоретичне ядро
Конденсований стан речовини
Речовина може перебувати в газоподібному, рідкому або твердому стані. Фазовий перехід газ – рідина, газ – тверде тіло називають конденсацією. Тому рідкий і твердий стани речовини називають її конденсованим станом.
Властивості речовини в газовій фазі істотно відрізняються від властивостей речовини в конденсованому стані.
Основна причина відмінності властивостей – це різні відстані між молекулами в газі, у рідині та у твердому тілі.
Ця відстань пропорційна до кореня кубічного з густини.
Розглянемо звичайну воду. Густина фаз у потрійній точці така:
газ
–
![]() ;
;
рідина
–
![]() ;
;
тверде
тіло (лід) –
![]() .
.
Отже, відстані між молекулами газу приблизно в 20 разів більші, ніж відстані між молекулами рідини чи твердого тіла. Згадаймо, що сили взаємодії між молекулами зменшуються зі зростанням відстані r між ними. Так, сили притягання зменшуються обернено пропорційно до сьомої степені зазначеної відстані:
 .
.
Тому сили взаємодії між молекулами газу дуже малі порівняно із силами в конденсованому стані.
Молекули газу практично вільні. Кожна молекула може незалежно від інших молекул виконувати поступальний, обертальний і коливальний рухи. Інакше кажучи, молекули газу мають поступальні, обертальні та коливальні ступені вільності.
У конденсованому стані між молекулами діють величезні сили, і вони обмежують вільність руху. Молекули практично не можуть ні обертатися, ні рухатися поступально. Відстані між ними можуть змінюватися дуже мало. Молекули можуть виконувати лише коливання навколо деяких положень рівноваги, тобто в молекул конденсованої фази є тільки коливальні ступені вільності. Великі сили взаємодії приводять до того, що на відміну від газу речовина в конденсованому стані зберігає свій об'єм. Малі відстані між молекулами конденсованої фази і великі сили взаємодії неминуче приводять до того, що молекули в просторі розміщені впорядковано. Ідеальний порядок спостерігається в ідеальному кристалі. Говорять, що там існує далекий порядок. Це означає, що коли ми рухатимемося від деякого структурного елемента у певному напрямі, то через однакові відстані неодмінно виявлятимемо ті ж самі структурні елементи. Такий стан і називають далеким порядком.
Молекули в рідинах уже мають деяку змогу зсуватися одна відносно одної, тому певний порядок існує тільки в розміщенні найближчих сусідів. Такий стан називають близьким порядком. Нагадаємо, що в газі молекули рухаються цілком хаотично. На відміну від суто індивідуального поводження молекул газу в конденсованому стані спостерігаються елементи колективного поводження молекул.
Зазначені особливості конденсованого стану вкрай ускладнюють вивчення твердих тіл і рідин. Проте головні труднощі зумовлюються тим, що атоми й молекули підпорядковані квантовим закономірностям. З огляду на це, нам доведеться не тільки замислитися над формулюванням і розв'язуванням відповідних задач з великим числом структурних елементів, а й розглянути зовсім нові квантові статистичні розподіли.
Кристали
Кристалами називають тверді тіла, які мають тривимірну періодичну атомну структуру. Ця періодичність (далекий порядок), що існує на атомному рівні, приводить до того, що кристали мають форму правильних симетричних многогранників. Такі правильні многогранники можуть утворюватися з рідини або з газу тільки за рівноважних умов.
Великі поодинокі правильні кристали називаються монокристалами. Більшість твердих тіл – це полікристали. Вони складаються з безлічі дрібних монокристалів, зорієнтованих безладно. Їх ще називають кристалітами, або кристалічними зернами. Кристалів безліч. Кожна хімічна речовина в цьому термодинамічному стані має цілком певну кристалічну структуру.
Зауважимо, що тверде тіло не обов'язково має бути кристалом. Цілком можлива поява твердого тіла, в якого відсутній далекий порядок, а спостерігається лише близький порядок. Власне, це дуже переохолоджена рідина. Такі тіла називають аморфними тілами. Так, поряд із кристалічним кварцом існує плавлений аморфний кварц.
К ласифікація
кристалів
ласифікація
кристалів
Класифікація за характером сил взаємодії
Розрізняють іонні, атомні, молекулярні та металеві кристали.
І онні
кристали.
У вузлах кристалічної решітки
розміщені іони різних знаків
(рис. 4.1). Наприклад, у кристалі кухонної
солі (NaCl)
в одних вузлах містяться позитивні
іони натрію (
онні
кристали.
У вузлах кристалічної решітки
розміщені іони різних знаків
(рис. 4.1). Наприклад, у кристалі кухонної
солі (NaCl)
в одних вузлах містяться позитивні
іони натрію (![]() ),
в інших – негативні іони хлору (
),
в інших – негативні іони хлору (![]() ).
Зв'язок між нимигетерополярний.
Найчастіше іонні кристали утворюються
різними солями.
).
Зв'язок між нимигетерополярний.
Найчастіше іонні кристали утворюються
різними солями.
Атомні або валентні кристали. У вузлах містяться нейтральні атоми, між якими діє гомеополярний зв'язок. Він здійснюється парами валентних електронів і має направлений характер (рис. 4.2). Атомні кристали мають, як правило, складну форму. Такий тип кристала характерний для напівпровідників, вуглецю і багатьох органічних речовин.
Молекулярні кристали. У вузлах решітки містяться нейтральні молекули (рис. 4.3). Зв'язок між ними здійснюється слабкими Ван-дер-Ваальсовими силами, здебільшого дисперсійними. Геометрія кристалів не дуже складна. Такі кристали мають парафін, аргон, вуглекислий газ, азот.
М еталеві
кристали.
У вузлах решітки містяться позитивні
іони металу, а в просторі між ними вільні,
колективізовані валентні електрони у
вигляді електронного газу. Електрони
«стягують» позитивні іони (рис. 4.4).
Виникає металевий
зв'язок.
Форма металевих кристалів здебільшого
найпростіша.
еталеві
кристали.
У вузлах решітки містяться позитивні
іони металу, а в просторі між ними вільні,
колективізовані валентні електрони у
вигляді електронного газу. Електрони
«стягують» позитивні іони (рис. 4.4).
Виникає металевий
зв'язок.
Форма металевих кристалів здебільшого
найпростіша.
Класифікація за типом симетрії
У кожному кристалі можна виокремити мінімальний об'єм, геометрія якого повторюється по всьому кристалу. Його називають елементарною кристалічною коміркою. Кристал речовини ніби «набирається» з елементарних комірок простим приєднанням, дзеркальним приєднанням або приєднанням з поворотом.
Кожна
елементарна комірка являє собою
паралелепіпед і характеризується
шістьма параметрами (рис. 4.5). Відстані
від узятого вузла решітки до сусідніх
вузлів називають сталою
кристалічної решітки,
або довжиною
ребер,
та позначають буквами
![]() .
Ці відстані становлять близько
.
Ці відстані становлять близько![]() .
Кути між ребрами (
.
Кути між ребрами (![]() )
називаютькутами
елементарної комірки.
)
називаютькутами
елементарної комірки.
Усе розмаїття кристалічних решіток вдається описати за допомогою 230 просторових груп, які можна звести всього до семи кристалографічних сингоній (таблиця 4.1). За такою класифікацією заздалегідь передбачається, що атом може перебувати тільки у вузлі паралелепіпеда елементарної комірки. Така комірка називається примітивною коміркою (ПК). Проте атом цілком може додатково розміститися ще й у центрах граней паралелепіпеда. Тоді решітку називають гранецентричною (ГЦ).
Якщо додатковий атом міститься в центрі комірки, то виникає об'ємноцентрична решітка (ОЦ). Якщо такий атом у центрі протилежних граней, то утворюється базоцентрична решітка (БЦ). Наприклад, кристал ромбічної сингонії може мати три різновиди.
Проте не всі сингонії можуть мати всі три різновиди решіток. З'ясувалося, що всього налічується 14 типів тривимірних решіток. Їх називають решітками Браве (табл. 4.1).
Розшифрування структури кристалів уможливлюється після спостереження дифракції рентгенівських променів і елементарних частинок на впорядкованій об'ємній структурі кристала.
Т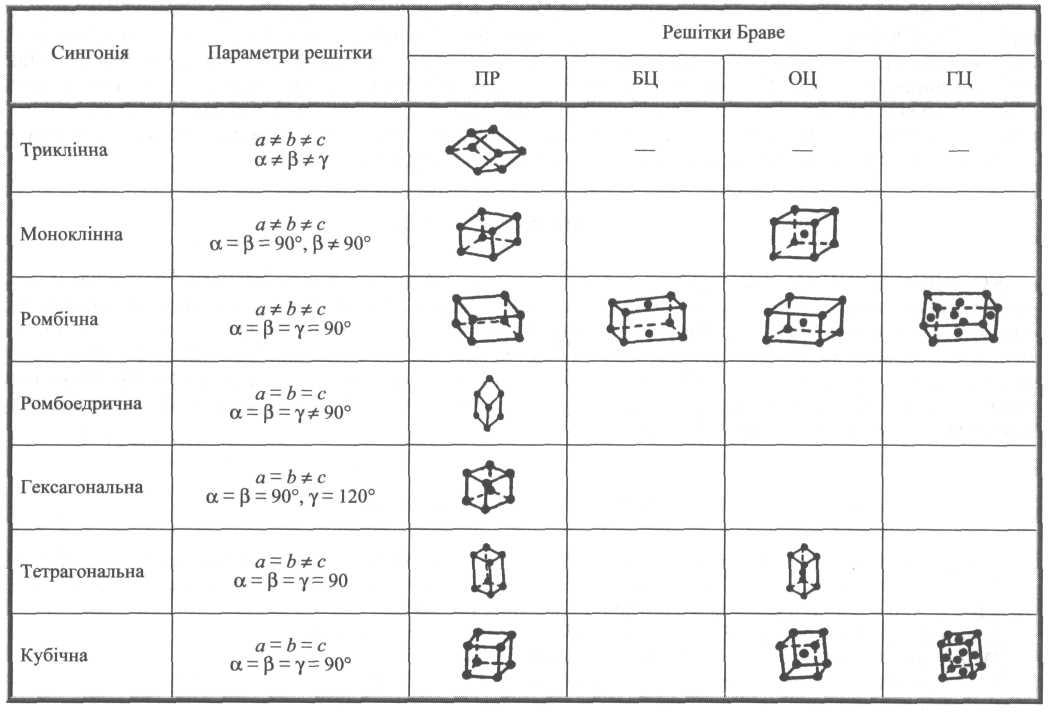 аблиця
4.1
аблиця
4.1
