
- •Ііі. Змістовий модуль 2
- •Хвильова функція та її фізичний зміст. Рівняння Шредінгера
- •Спектральні серії випромінювання атомів. Досліди Резерфорда. Постулати Бора. Квантово-механічна інтерпретація постулатів Бора. Принцип відповідностей. Досліди Франка і Герца
- •Квантові числа в атомі. Квантування енергії моменту імпульсу та проекції імпульсу. Досліди Штерна і Герлаха. Спін і магнітний момент електрона
- •Принцип Паулі. Електронні шари складних атомів
- •Спектри багатоелектронних атомів. Ефект Зеємана
- •Природа характеристичних рентгенівських променів. Закон Мозлі
- •Поняття про хімічний зв’язок і валентність. Молекулярні спектри
- •Спонтанне та індуковане випромінювання. Квантові генератори (лазери), їх застосування
- •Практичне заняття 2.1 Тема: Хвилі де Бройля Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.2 Тема: Рівняння Шредінгера Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.3
- •Тема: Постулати Бора. Квантові числа в атомі.
- •Періодична система елементів д.І. Менделєєва
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Практичне заняття 2.4 Тема: Характеристичне рентгенівське випромінювання Приклади розв’язання задач
- •Задачі для самостійного розв’язування та домашнього завдання
- •Перелік компетентностей другого змістового модуля
- •Рівняння Шредінгера. Атом водню за Бором. Закон Мозлі Задачі
Спектральні серії випромінювання атомів. Досліди Резерфорда. Постулати Бора. Квантово-механічна інтерпретація постулатів Бора. Принцип відповідностей. Досліди Франка і Герца
Досліди Резерфорда. Ядерна модель атома
Вчення про атомну структуру речовини виникло ще в стародавні часи. І майже до кінця позаминулого століття під атомом розуміли неподільну частинку матерії. У кінці ХІХ ст. відбулися відкриття, які довели, що атом є складна електронно-нуклонна система.
У 1897 році Томсон вивчав катодне випромінювання, внаслідок чого був відкритий електрон. До цього часу про складну структуру атома свідчило явище електролізу. Тоді вже вчені вважали, що атом має власну будову, але яку саме, − питання залишалось відкритим.
У 1896 році Беккерель відкрив явище радіоактивності, що підтверджувало складну структуру атома.
На основі всіх експериментів щодо вивчення структури атома у 1903 році Томсон запропонував таку модель атома: атом − це рівномірно заповнена позитивною електрикою сфера, усередині якої знаходяться електрони; число їх таке, що їх сумарний заряд дорівнював би позитивному заряду (рис. 2.7.а).
Ц я
модель ще мала назву“кексу
з родзинками”.
Електрони коливались навколо положення
рівноваги і фактично були (кожен з них)
лінійним гармонійним осцилятором. Цим
пояснювався лінійчатий спектр атома.
я
модель ще мала назву“кексу
з родзинками”.
Електрони коливались навколо положення
рівноваги і фактично були (кожен з них)
лінійним гармонійним осцилятором. Цим
пояснювався лінійчатий спектр атома.
Позитивні сторони моделі Томсона:
ця модель пояснювала електричну нейтральність атома.
Недоліки моделі Томсона:
не було зрозумілим, як атом залишався стабільною одиницею;
яким чином електрони були розподілені всередині атома.
Виникла необхідність (доки модель не спростована, − вона дійсна) виявити характер розподілу позитивного та негативного заряду в атомі. Для цього необхідно було провести зондування атома (бомбардувати атом).
Цей дослід провів Резерфорд у 1906 році; в якості частинок, що здійснювали бомбардування атома, виступали α-частинки (ядра гелію) (рис. 2.8).
Відкритий
пучок α-частинок направлявся на металеву
фольгу, проходив її і потрапляв на екран,
до складу якого входив сірчистий цинк.
Внаслідок взаємодії α-частинки з
сірчистим цинком відбувався спалах, що
фіксувався мікроскопом. Вся установка
знаходилася у вакуумі з метою не взаємодії
α-частинок з молекулами повітря. Екран
з мікроскопом могли обертатись навколо
фольги на кут
![]() .
.
В
 наслідок
спостережень було встановлено, що значна
кількість α-частинок через металеву
фольгу проходить без відхилення, проте
були частинки, які відхилялись на кут180о
(рис. 2.9),
тобто
повертались до джерела опромінення.
наслідок
спостережень було встановлено, що значна
кількість α-частинок через металеву
фольгу проходить без відхилення, проте
були частинки, які відхилялись на кут180о
(рис. 2.9),
тобто
повертались до джерела опромінення.
Р езерфорд
прийшов до висновку, що в атомі є сильне
електромагнітне поле, яке носить
позитивний характер. Маса цього
позитивного заряду сконцентрована в
невеликому об’ємі і розміщується в
центрі атома. На основі цих уявлень
Резерфорд запропонував власну модель
атома:атом
−
це система зарядів; у центрі знаходиться
важке ядро із зарядом
езерфорд
прийшов до висновку, що в атомі є сильне
електромагнітне поле, яке носить
позитивний характер. Маса цього
позитивного заряду сконцентрована в
невеликому об’ємі і розміщується в
центрі атома. На основі цих уявлень
Резерфорд запропонував власну модель
атома:атом
−
це система зарядів; у центрі знаходиться
важке ядро із зарядом
![]() і
радіусом
і
радіусом![]() ;
електрони рухаються навколо ядра, а
радіус останньої орбіти порядку
;
електрони рухаються навколо ядра, а
радіус останньої орбіти порядку![]() (рис. 2.9.а).
(рис. 2.9.а).
Позитивні сторони моделі Резерфорда:
ця модель пояснювала електричну нейтральність атома;
дає уявлення про розташування електронів в атомі.
Недоліки моделі Резерфорда:
не було зрозумілим, як атом залишався стабільною одиницею (згідно класичної електродинаміки, частинка, яка рухається з прискоренням, випромінює електромагнітну хвилю, при цьому частинка втрачає енергію, а отже, і швидкість. Електрон рухається з прискоренням навколо ядра і внаслідок цих міркувань повинен впасти з часом на ядро. Насправді цього не відбувається.);
нічого невідомо про параметри руху електронів на цих орбітах.
Постулати Бора. Модель атома за Бором
Ядерна модель Резерфорда вступала у протиріччя з класичною електродинамікою: електрон, обертаючись навколо ядра, повинен випромінювати електромагнітну хвилю, оскільки він обертається з доцентровим прискоренням, і врешті повинен впасти на ядро. Проте дослід та життя показали, що атом є стабільною одиницею протягом тривалого часу. Крім того, якщо електрон повільно наближається до ядра, спектр атома має бути суцільним. Дослід же показав, що спектр випромінювання атома лінійчатий. І тоді постало питання: відмовитись від ядерної моделі Резерфорда чи відмовитись від застосування класичної електродинаміки щодо атома.
У 1913 році датський фізик Нільс Бор формулює такі три постулати:
в атомі існують особливі стаціонарні стани, що характеризуються енергіями
 ,
при яких електрони рухаються орбітами,
не випромінюючи енергію;
,
при яких електрони рухаються орбітами,
не випромінюючи енергію;при переході атома з одного стаціонарного стану, енергія якого більша, в стан з меншою енергією відбувається випромінювання, і значення енергії дорівнює
 ;
тут
;
тут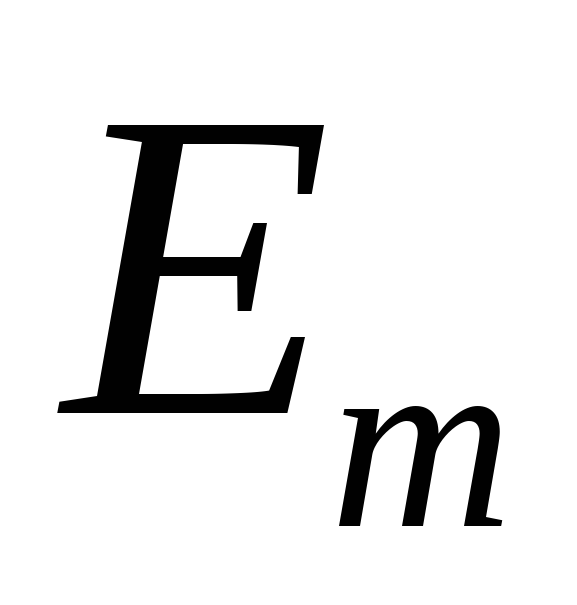 більша від
більша від ;
при переході з рівня меншої енергії на
рівень з енергією більшою відбувається
поглинання;
;
при переході з рівня меншої енергії на
рівень з енергією більшою відбувається
поглинання;момент імпульсу електрона в атомі квантується. (
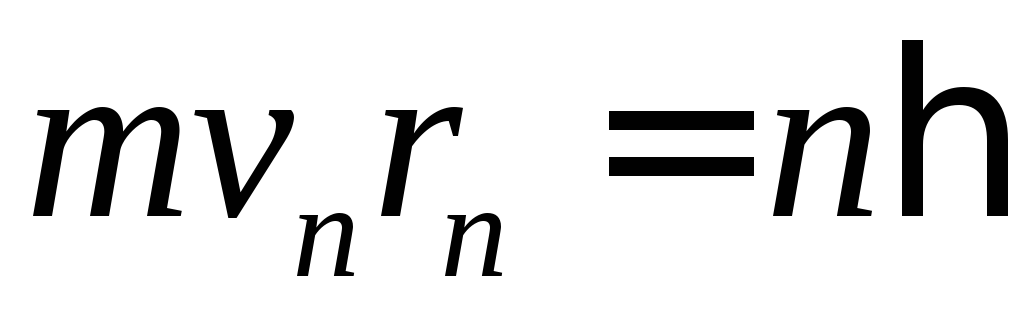 ,
де
,
де − номер орбіти,
− номер орбіти, − швидкість електрона на орбіті,
− швидкість електрона на орбіті, − радіус орбіти. Електрон може перебувати
лише на тій орбіті, де є певне значення
моменту імпульсу.).
− радіус орбіти. Електрон може перебувати
лише на тій орбіті, де є певне значення
моменту імпульсу.).
Досліди Франка і Герца
Постулати Бора суперечили класичній фізиці, тому необхідний був експеримент, який би підтвердив існування стаціонарних станів та правило частот (другий постулат Бора). Такий дослід був проведений у 1913 році Франком і Герцем.
У становка
складалась із посудини, в яку було впаяно
три електроди: катод, анод і сітка
(рис. 2.10). Посудина заповнювалась
парами ртуті при низькому тиску. Між
катодом і сіткою створювалась напруга,
що регулювалась потенціометром. За
допомогою цієї напруги та напруги
постійної, що підігрівала катод, з
поверхні електроду електрони вилітали,
прискорювались, збільшуючи свою енергію,
взаємодіяли з атомами ртуті і досягали
сітки. Між сіткою та анодом створювалась
слабка затримуюча різниця потенціалів
у 0,5 В.
Метою цього поля було затримати електрони,
що проходили через сітку (не дати
потрапити на анод).
становка
складалась із посудини, в яку було впаяно
три електроди: катод, анод і сітка
(рис. 2.10). Посудина заповнювалась
парами ртуті при низькому тиску. Між
катодом і сіткою створювалась напруга,
що регулювалась потенціометром. За
допомогою цієї напруги та напруги
постійної, що підігрівала катод, з
поверхні електроду електрони вилітали,
прискорювались, збільшуючи свою енергію,
взаємодіяли з атомами ртуті і досягали
сітки. Між сіткою та анодом створювалась
слабка затримуюча різниця потенціалів
у 0,5 В.
Метою цього поля було затримати електрони,
що проходили через сітку (не дати
потрапити на анод).
Е кспериментально
була встановлена залежність сили струму
між сіткою і анодом від напруги
(рис. 2.11).
кспериментально
була встановлена залежність сили струму
між сіткою і анодом від напруги
(рис. 2.11).
При
взаємодії електрона з атомами ртуті
(збільшення напруги між катодом і
сіткою) спочатку відбувалася пружна
взаємодія, тобто енергія електрона
змінювалася лише під впливом
електричного поля, і атом не забирав
енергію від електрона. При
![]() електрони мають енергію 4,9 еВ,
це якраз відповідає першому потенційному
збудженню атома ртуті. За цієї умови
відбувається непружна взаємодія. Атоми
сприймали цю енергію від електронів і
переходили в збуджений стан, тобто в
інший стаціонарний стан, що характеризується
більшою енергією. З одного боку це
виявлялось за випромінюванням атомів
ртуті, з іншого – раптовим спадом струму
через гальванометр (рис. 2.11). Електрони
на шляху між катодом і сіткою зазнали
одного, двох або більше непружних
зіткнень з атомами, втрачали свою енергію
і не могли внаслідок гальмування напруги
попасти на анод; струм через гальванометр
різко спадав.
електрони мають енергію 4,9 еВ,
це якраз відповідає першому потенційному
збудженню атома ртуті. За цієї умови
відбувається непружна взаємодія. Атоми
сприймали цю енергію від електронів і
переходили в збуджений стан, тобто в
інший стаціонарний стан, що характеризується
більшою енергією. З одного боку це
виявлялось за випромінюванням атомів
ртуті, з іншого – раптовим спадом струму
через гальванометр (рис. 2.11). Електрони
на шляху між катодом і сіткою зазнали
одного, двох або більше непружних
зіткнень з атомами, втрачали свою енергію
і не могли внаслідок гальмування напруги
попасти на анод; струм через гальванометр
різко спадав.
З'ясувалося,
що певне значення енергії електронів,
яку можуть поглинати атоми ртуті,
відповідає прискорювальній напрузі
![]() ;
;![]() ;
;![]() ;
;![]() і т. д., тобто кратне 4,86В.
Виходить, що енергетичні стани атома
дискретні і атом може поглинати тільки
певні порції енергії:
і т. д., тобто кратне 4,86В.
Виходить, що енергетичні стани атома
дискретні і атом може поглинати тільки
певні порції енергії:
![]() і
т. п.,
і
т. п.,
де
![]() – енергія відповідно 1-го, 2-го, 3-го
стаціонарного стану.
– енергія відповідно 1-го, 2-го, 3-го
стаціонарного стану.
Отже, перший постулат Бора підтверджено!
Під
час експериментів виміряли довжину
хвилі ультрафіолетового випромінювання,
яке випускали збуджені електронним
ударом атоми ртуті, вона дорівнювала
2537 Å.
Це випромінювання відбувалося під час
переходу атома ртуті зі збудженого
стану з енергією
![]() до основного енергетичного стану з
енергією
до основного енергетичного стану з
енергією![]() .
Скориставшись правилом частот Бора,
можна обчислити цю довжину хвилі:
.
Скориставшись правилом частот Бора,
можна обчислити цю довжину хвилі:
![]() ,
,
але
![]() .
.
Тоді можна визначити довжину хвилі випромінювання:
 .
.
Теоретичні розрахунки повністю збігаються з даними експерименту! Отже, підтверджено експериментально і другий постулат Бора!
Третій постулат Бора? Цей постулат експериментально не перевірявся і, як побачимо далі, виявився геніальною здогадкою Бора про квантованість орбітального моменту імпульсу!
Теорія Бора дає змогу обчислити радіуси орбіт електронів в атомі, енергію стаціонарного стану електрона в атомі, довести формулу Бальмера-Рітца, дістати теоретичне значення сталої Рідберга.
Бор вважав, що рух електрона у воднеподібній системі відбувається по коловій орбіті радіуса r під дією кулонівської сили притягання до ядра, яка створює доцентрове прискорення:
 ,
,
де
m
– маса електрона; υ – швидкість руху
електрона по орбіті; e – заряд
електрона;
![]() – діелектрична стала.
– діелектрична стала.
Бор застосував свої постулати для пояснення властивостей найпростішого атома − атома водню.
Визначимо швидкість руху електрона орбітою, радіуси орбіт та енергію електрона на відповідних орбітах:
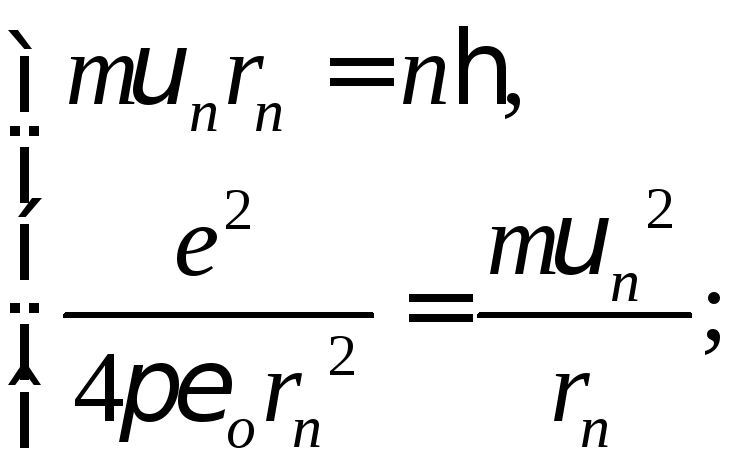
1)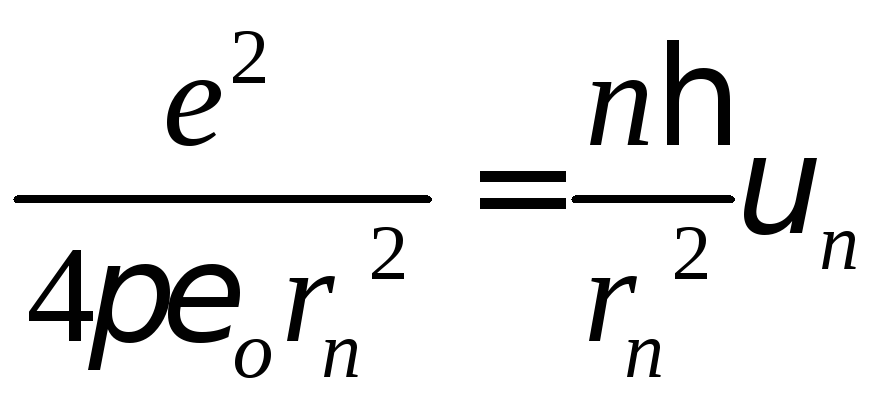 ;
;![]()
 ;
;
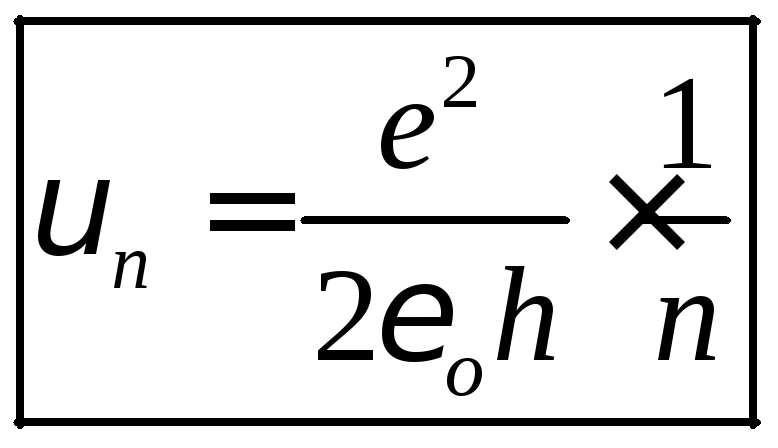 ,
,
швидкість квантується і є оберненопропорційною до номера орбіти;
2) ;
;
![]()
![]()
 –радіус
n-ї
орбіти,
–радіус
n-ї
орбіти,
де n = 1,2,3,... .
Радіус першої орбіти Бора електрона при n = 1 такий:
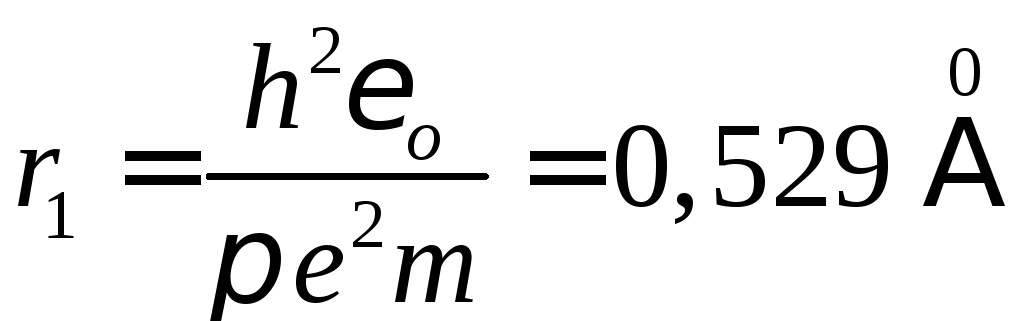 .
.
Формулу для визначення радіусів орбіт електрона в атомі можна записати ще так:
![]() .
.
Отже, орбіти, по яких обертаються електрони в атомі, можуть мати не будь-які, а тільки певні квантові значення, що визначаються цілим числом n;
3)
![]() − енергія електрона на будь-якій орбіті,
що складається із суми кінетичної
− енергія електрона на будь-якій орбіті,
що складається із суми кінетичної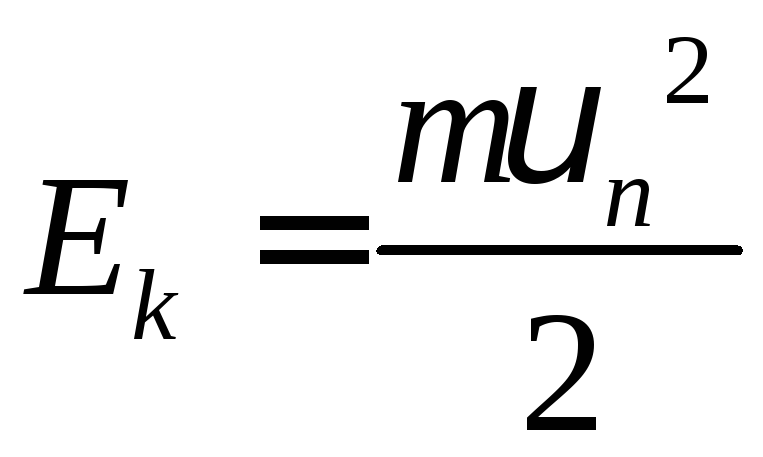 та потенціальної
та потенціальної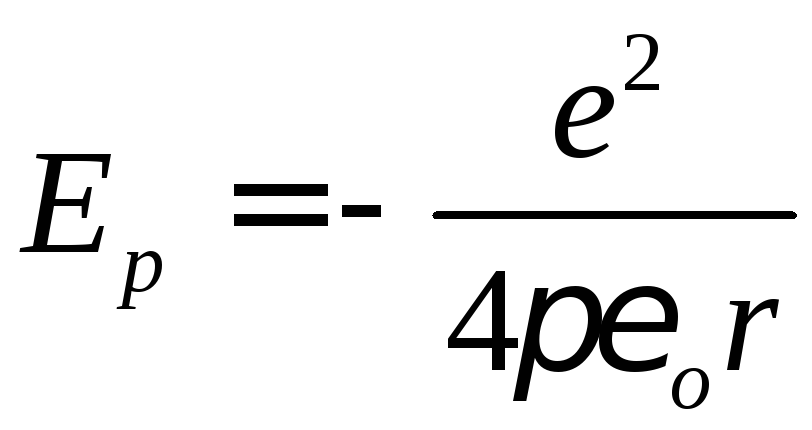 (добуток заряду електрона на потенціал
електричного поля ядра в точці, де
перебуває електрон) енергій.
(добуток заряду електрона на потенціал
електричного поля ядра в точці, де
перебуває електрон) енергій.
Знак мінус ставимо тому, що енергія електрона на нескінченності вважається такою, що дорівнює нулю, а при наближенні до ядра вона зменшується. Зрозуміло, що кінетична енергія електрона на будь-якій стаціонарній орбіті чисельно повинна бути меншою від потенціальної енергії притягання електрона до ядра, бо інакше електрон вилетів би за межі дії ядра.
Енергію електрона можна записати:
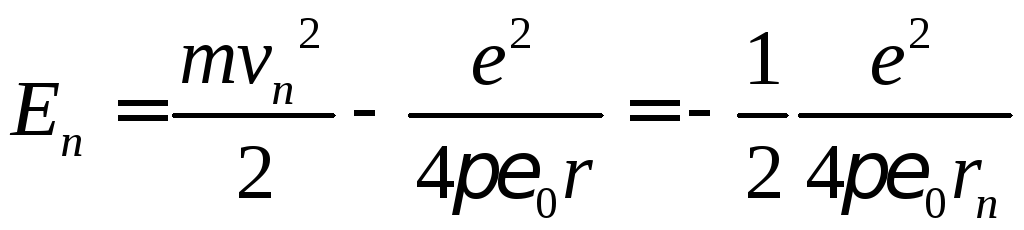 .
.
Підставивши радіус n-ї орбіти, дістанемо:
 ,
,
тобто
енергія
![]() -ї
орбіти оберненопропорційна квадрату
номера орбіти.
-ї
орбіти оберненопропорційна квадрату
номера орбіти.
Енергія основного (першого) стану електрона при n = 1:
 .
.
Формулу для визначення повної енергії електрона в атомі можна записати ще так:
 .
.
Енергія електрона в атомі набуває низки квантованих значень, які визначаються цілим числом n.
Використавши
другий постулат Бора (правило частот),
отримаємо вираз для визначення частоти
електромагнітної хвилі, що випромінюється
електроном при переході з
![]() -ї
на
-ї
на![]() -ту
орбіту:
-ту
орбіту:
 ,
,
де
 − стала Рідберга.
− стала Рідберга.
Спектральні лінії атома водню
Одним з методів визначення внутрішньої будови атома можуть бути спектри випромінювання або поглинання. Це можливо завдяки тому, що кожен атом володіє лише йому властивим спектром. На цьому базується спектральний аналіз, відкритий ще в 1860 році.
У 1885 році Бальмер вивчав спектр водню і відкрив закономірність, що частоти, які відповідають різним лініям спектра водню, можна розрахувати за формулою:
 ,
,
де
R
− стала
Рідберга,
![]() ;
;![]() .
.
У спектроскопії прийнято записувати цю формулу через хвильове число, що показує, скільки довжин хвиль вміщується в одиниці довжини:
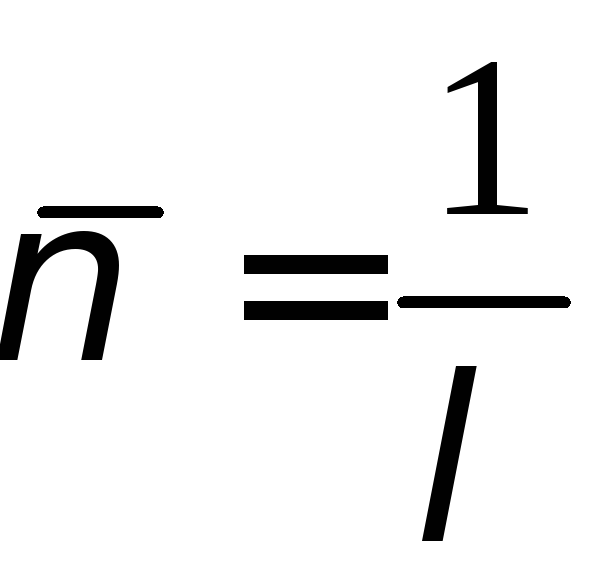 .
.
Тоді
 ,
де
,
де
![]() ;
;
 ,
,
де
![]() ,
,
![]() відповідає
лінії
відповідає
лінії
![]() ,
,![]() − лінії
− лінії![]() ,
,![]() − лінії
− лінії![]() .
.
Продовжуючи досліди Бальмера, Рітц прийшов до висновку, що існує декілька серій ліній, і що серія Бальмера описує лише видимий спектр. Рітц запропонував більш загальну формулу для розрахунку хвильового числа:
 ,
,
де
![]() − натуральні числа, більші від 3.
− натуральні числа, більші від 3.
Для визначення частоти формула Бальмера-Рітца має вигляд:
 ,
,
де
![]() − спектральні терми.
− спектральні терми.
Було
встановлено, що при
![]() серія відповідає ультрафіолетовій
області; вона має назвусерії
Лаймана.
серія відповідає ультрафіолетовій
області; вона має назвусерії
Лаймана.
![]() −серія
Бальмера
(видима область);
−серія
Бальмера
(видима область);
![]() −серія
Пашена
(інфрачервона область);
−серія
Пашена
(інфрачервона область);
![]() −серія
Брекета
(інфрачервона область);
−серія
Брекета
(інфрачервона область);
![]() −серія
Пфунда
(інфрачервона область).
−серія
Пфунда
(інфрачервона область).
Принцип Рітца-Рідберга: будь-яка частота довільної спектральної лінії може бути представлена у вигляді різниці спектральних терм (рис. 2.12).

