
- •Основи вакуумної та кріогенної техніки
- •Чернівці
- •Частина 1. Вакуумна техніка Розділ 1. Фізика вакууму
- •1.1.1. Поняття про вакуум і тиск
- •1.1.2. Газові закони і одиниці вимірювання тиску
- •Повітря – основна газова суміш, з якою доводиться мати справу у вакуумній техніці: n2 – 78,1%; o2 – 21%; Ar – 0,9%; cо2 – 0,03%; Ne – 1,8·10-3%; He – 5,2·10-4%; h2 - 5·10-5% (по скл).
- •1.1.3. Функція розподілу молекул газу за швидкостями
- •1.1.4. Час адсорбції. Ступінь покриття гладкої поверхні молекулами газу
- •1.1.5. Середня довжина вільного шляху
- •1.1.6. Поняття про ступені вакууму
- •Розділ 2. Фізичні процеси у вакуумі
- •1.2.1. В’язкість газів. Переніс тепла. Дифузія в газах
- •1.2.2. Температурна рівновага тисків. Режими течії газу
- •1.2.3. Течія газів через отвори та по трубопроводах
- •1.2.4. Електричні явища у вакуумі
- •Розділ 3. Сорбційні явища
- •1.3.1. Сорбційні сили і процеси
- •1.3.2. Тиск насичених парів
- •1.3.3. Випаровування. Конденсація. Хемосорбція. Фізична адсорбція
- •1.3.4. Швидкість сорбції
- •1.3.5. Розчинність газів у твердих тілах
- •1.3.6 Дифузія газів у твердих тілах
- •Розділ 4. Одержання вакууму та вимірювання тисків
- •1.4.1. Вакуумна система та її принципіальна схема. Основні параметри вакуумних насосів
- •1.4.2. Вакуумні насоси
- •1.4.3. Вимірювання величини тиску за допомогою теплових та електронних перетворювачів
- •1.4.4. Розрахунок і проектування вакуумних систем. Типові вакуумні системи
- •1.4.5 Методи пошуку натікання в системах. Пастки
- •Частина 2. Кріогенна техніка Розділ 1. Зберігання і переливання гелію
- •2.1.1. Посудини для зберігання рідкого гелію
- •2.1.2. Термоакустичні коливання
- •2.1.3. Вимірювач швидкості випаровування
- •2.1.4. Вимірювачі рівня
- •2.1.5. Сифони
- •2.1.6. Газові аналізатори
- •Розділ 2. Кріостати. Конструювання низькотемпературних установок
- •2.2.1. Використання як кріостату посудини для зберігання гелію
- •2.2.2. Простий кріостат загального призначення
- •2.2.3. Скляні посудини Дьюара
- •2.2.4. Металеві посудини Дьюара
- •2.2.5. Зниження температури. Плівка гелію
- •Частка об’єму рідкого гелію, яка залишається після його охолодження з 4,2 к до вказаних температур в результаті випаровування іншої частини гелію
- •2.2.6. Кріостат для температур нижче 1 к
- •2.2.7. Застосування гелію-3.Температури нижчі 1 к
- •Розділ 3. Вимірювання температури
- •Розділ 4. Регулювання температури
- •2.4.1. Регулювання тиску парів
- •2.4.2. Регулювання температури вище 4,2 к
- •Розділ 5. Зрідження газів з використанням ефекту Джоуля — Томсона (метод Лінде)
- •Список літератури
- •Основи вакуумної та кріогенної техніки
Повітря – основна газова суміш, з якою доводиться мати справу у вакуумній техніці: n2 – 78,1%; o2 – 21%; Ar – 0,9%; cо2 – 0,03%; Ne – 1,8·10-3%; He – 5,2·10-4%; h2 - 5·10-5% (по скл).
Одиниця тиску в системі СІ – 1 Па (паскаль), чисельно рівний 1 Н/м2. 1 гПа = 102 Па.
Співвідношення між одиницями тиску:
1 атм (фізична) = 1,01·105 Па = 1,01·106 дин/см2 = 1,03·104 кгс/м2 = 1,03 кгс/см2 = 1,01 бар =760 мм рт. ст. = 760 торр.
1.1.3. Функція розподілу молекул газу за швидкостями
Користуючись
гіпотезами про існування стаціонарного
розподілу молекул за швидкостями і про
ізотропність простору газових молекул,
а також враховуючи, що згідно зі
співвідношенням
![]() середньоквадратична швидкість Vкв=
середньоквадратична швидкість Vкв=![]() ,
Максвелл одержав функцію розподілу
молекул газу за швидкостями, яка носить
його ім’я:
,
Максвелл одержав функцію розподілу
молекул газу за швидкостями, яка носить
його ім’я:
 ,
,
де dnV – кількість молекул, швидкості яких знаходяться в межах від V до V+dV.
Швидкість, при якій спостерігається максимум розподілу, називається найбільш ймовірною швидкістю:
Vйм=![]() .
.
Для
вакуумних розрахунків необхідно знати
середньоарифметичну
![]()
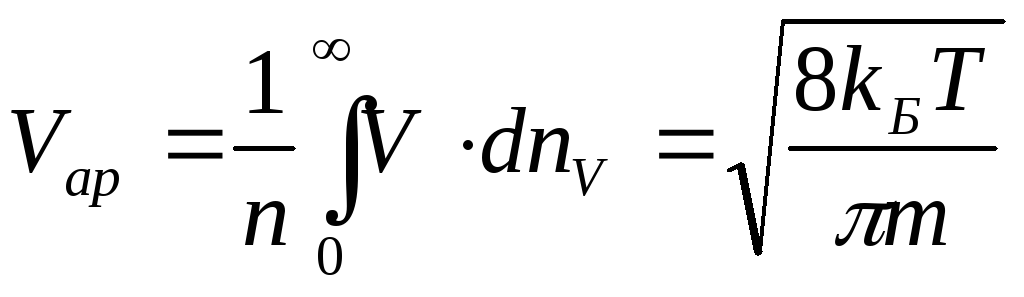 і
середньоквадратичну
і
середньоквадратичну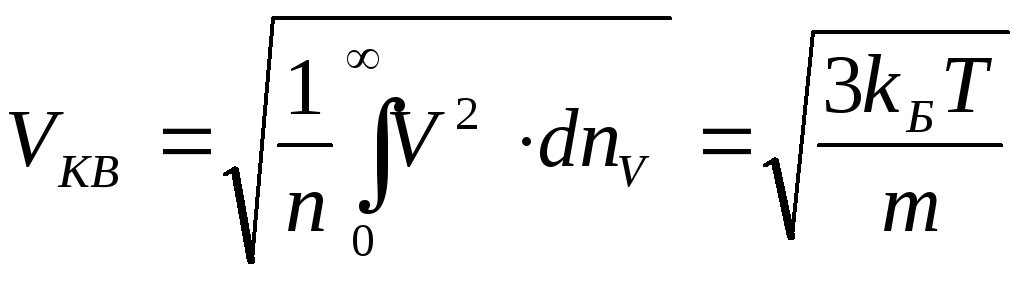 швидкості. Співвідношення між швидкостями
рівнеVйм:
Vар:Vкв=
1:1,128:1,225.
швидкості. Співвідношення між швидкостями
рівнеVйм:
Vар:Vкв=
1:1,128:1,225.
1.1.4. Час адсорбції. Ступінь покриття гладкої поверхні молекулами газу
Ударяючись у поверхню твердого тіла, молекули адсорбуються. Час адсорбції або час перебування молекул в адсорбованому стані залежить від теплоти адсорбції і описується рівнянням Френкеля:
![]() ,
,
де Qa – теплота адсорбції, розрахована на 1 кмоль газу; τ0 – мінімальний час перебування молекули в адсорбованому стані (τ0 10-13с). (Для N2, O2, CO, Ar – Qa 12000-20000 кДж/кмоль при Т = 293 К, τа 10-10 с, а при Т = 77 К τа 1с; для парів води і масел Qa 80000 к Дж/кмоль, при Т = 293 К τа 102 с, а при Т = 77 К τа 1043 с).
Ступінь покриття поверхні молекулами газу:
![]() ,
,
де f – ймовірність поглинання молекули газу на вільній поверхні (для наближених розрахунків вважають f = 1); аm – кількість молекул, необхідна для утворення моношару на поверхні твердого тіла.
Ця формула справедлива при таких допущеннях:
теплота адсорбції постійна і не залежить від кількості поглинутого газу;
всі молекули, які ударяються в поверхню твердого тіла, адсорбуються з ймовірністю f , яка не залежить від кількості поглинутого газу.
Ці допущення справедливі при ступенях покриття, значно менших за одиницю.
Розрахунок за цією формулою для атмосферного азоту при Р = 7,9 ∙ 104 Па (591 торр), Т = 298 К; f = 1; τ0 = 10-13 с; Qa = 14700 кДж/кмоль; R = 8,31 кДж/(кмоль∙К); am = 9,6∙10-18 м-2 , m = 4,65∙10-26 кг; kБ = 1,37∙10-23 Дж/К дає значення ступеня покриття Θ = 9∙10-3, тобто азот в таких умовах покриває менше 0,01 вільної поверхні.
1.1.5. Середня довжина вільного шляху
Направлений молекулярний потік, який містить в початковий момент N0 молекул газу, за рахунок зіткнення з іншими молекулами з частотою K за час dt зменшується на величину dN = - NKdt. Проінтегрувавши цей вираз, одержимо N = = N0∙e-Кt = N0 ∙e-l/L, де L = V / K – середня довжина вільного шляху молекул газу, яка визначається відношенням швидкості молекул до кількості зіткнень в одиницю часу; l = V∙t – довжина шляху молекули за час t.
Зіткнення
відбувається, якщо віддаль між центрами
молекул буде не більшою за діаметр
молекули dM.
Будемо вважати, що одна молекула має
радіус dM
, а всі інші молекули – математичні
точки з нульовим радіусом. При русі зі
швидкістю Vар
в газі з
молекулярною концентрацією n
за одну секунду така уявна молекула
опише об’єм
![]() і відчує
і відчує![]() зіткнень.
зіткнень.
Середня довжина вільного шляху буде:
![]()
Врахування відносних швидкостей руху молекул газу дасть:
![]()
![]()
Залежність від температури (експериментальна):
![]()
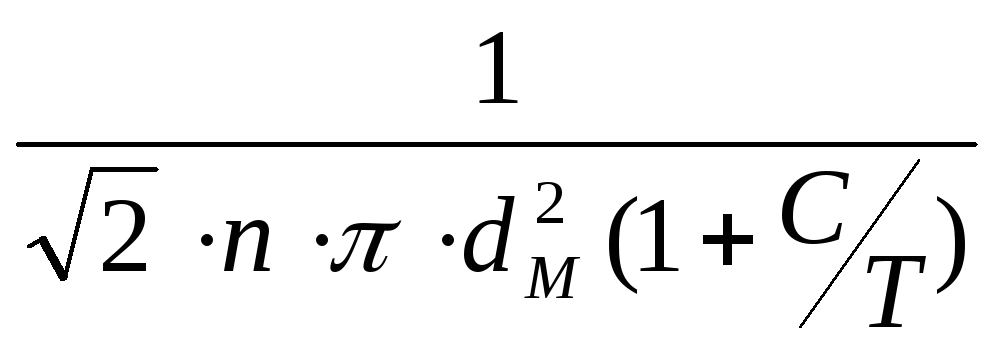
де С – постійна Сезерленда; або із рівняння газового стану
![]()
 ;
;
L =0,63/р – для повітря, де р – в Па, а L – в см.
