
- •ОГЛАВЛЕНИЕ
- •ПРЕДИСЛОВИЕ
- •МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ»
- •Работа 1.1. Планирование эксперимента и построение модели на примере выращивания микроорганизмов
- •Работа 1.2. Модели роста микроорганизмов
- •Вопросы:
- •Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров
- •Вопросы:
- •МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
- •Задачи:
- •Работа 2.1. Типы ферментационных процессов
- •Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом
- •Вопросы:
- •Вопросы:
- •Вопросы:
- •Вопросы:
- •Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта
- •Работа 2.7. Методы анализа содержания основных (общий азот, белок)
- •Вопросы:
- •Работа 2.8. Методы анализа запасных (полисахара, биополимеры) клеточных макромолекул
- •Вопросы:
- •МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ
- •Работа 3.1. Выделение ферментов (на примере светящихся белков)
- •Вопросы:
- •Работа 3.2. Методы детекции ферментативной активности
- •Вопросы:
- •Задачи:
- •Работа 5.1. Иммобилизация микробных клеток
- •Вопросы:
- •Вопросы:
- •МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ
- •Вопросы:
- •Вопросы:
- •МОДУЛЬ 7. СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОТЕХНОЛОГИЯ
- •Вопросы:
- •МОДУЛЬ 8. ПЕРСПЕКТИВЫ РАЗВИТИЯ БИОТЕХНОЛОГИИ
- •СПИСОК ЛИТЕРАТУРЫ

МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.3. Проточные культуры: хемостат, турбидостат
9. При достижении температуры культуры 30 0С начнется рост культу-
ры;
10.Периодически (через 30 мин) отбирать пробы для определения оптической плотности культуры. При оптической плотности культуры 0,1 (без разведения) включить насос-дозатор на минимальную скорость протока
(0,1 ч-1);
11.Ежечасно определять ОП культуры;
12.При увеличении ОП постепенно увеличивать скорость протока среды до состояния steady-state ( величина Х, г/л – постоянна);
13.Вычислить значение удельной скорости роста культуры, определить время достижения состояния steady-state, получить культуру (хранить в холодильнике) для последующих занятий.
Вопросы:
1.Вчемпринципиальное отличие проточной культуры от периодической?
2.Каковы основныетребованиякорганизации проточной ферментации?
3.Каковы преимущества проточной культуры?
4.Что позволяет техника проточных культур?
Работа2.4. Проведение процесса ферментации слимитированием субстрата
Цель: освоение техники ведения процесса выращивания микроорганизмов с лимитированием субстрата для нахождения условий роста, влияющих на биохимическую программу синтеза макромолекул.
Процессы микробного синтеза делятся на два типа: 1). процессы, связанные с ростом биомассы и происходящие параллельно со скоростью размножения клеток, и 2). процессы, происходящие или ускоряющиеся при замедлении скорости роста клеток. Оптимизация обоих типов процессов осуществляется различными путями в зависимости от того, насколько совпадают (или не совпадают) оптимизация скорости роста со скоростью синтеза макромолекул той или иной природы.
Процесс роста – это процесс синтеза первичных метаболитов (аминокислот, органических кислот, витаминов, нуклеотидов, промежуточных продуктов катаболизма) и их сборка в основные клеточные макромолекулы (белки, нуклеиновые кислоты, полимеры, образующие клеточную стенку). Рост и синтез этих продуктов максимален, когда клетка максимально обеспечена субстратом. В периодической культуре это имеет место в экспоненциальной – начале линейной фазы роста. Таким образом, оптимизация процесса накопления максимальной биомассы клеток в культуре и синтеза первичных продуктов обмена сводится к оптимизации условий питания и созданию условий сбалансированного роста для культуры. Накопление продуктов обмена, происходящих во второй фазе развития культуры (конец линейной – ста-
Введение в биотехнологию. Метод. указания по лабораторным работам |
-27- |

МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.4. Проведение процесса ферментации с лимитированием субстрата
ционарная фаза), – запасных соединений (полифосфатов, полисахаров, липидов) или вторичных продуктов обмена (антибиотиков, терпенов, стероидов), имеет для микробной технологии большое значение. Накопление запасных соединений в клетках имеет место при несбалансированном росте вследствие исчерпания из среды какого-либо биогена и лимитирования процесса синтеза основных макромолекул. Синтез вторичных продуктов обмена (идиолитов) имеет место в случае замедления и остановки роста клеток в конце развития популяции (конец стационарной фазы – фаза отмирания), когда происходит дерепрессия ферментов, катализирующих реакции образования данных соединений и репрессированных на стадии сбалансированного роста. Оптимизация процесса синтеза запасных соединений и вторичных метаболитов более сложна, так как требует специальных знаний о закономерностях образования тех или иных макромолекул и специфических подходов в каждом конкретном случае.
При лимитации роста микроорганизмов отдельными элементами минерального питания происходит замедление скорости роста клеток, сопровождающееся значительными изменениями химического состава, главным образом, соотношения основных и запасных макромолекул. Выявление принципиальных закономерностей этих изменений открывает широкие возможности для направленного изменения составом микробной биомассы и целевого получения конкретных продуктов микробиологического синтеза. Более того, помимо изменения направленности биохимической программы синтеза основных и запасных соединений лимитация роста клеток тем или иным минеральным элементом позволяет дополнительно регулировать химическую структуру отдельных соединений, входящих в состав клеток.
Отправным моментом является изменение соотношения C/N в питательной среде. Клетки, лимитированные по азоту и не способные синтезировать основные соединения (белки и нуклеиновые кислоты), потребляя углерод, направляют его на образование различных безазотистых соединений углеводной и липидной природы. Качественный состав запасных соединений, синтезируемых при лимитации роста микроорганизмов по азоту на фоне избытка углерода (увеличение отношения C/N), определяется спецификой фи- зиолого-биохимических свойств конкретных микробных видов, а также штаммов.
Материалыиоборудование:
1.Музейная культура штамма R. eutrophus B–5786;
2.Стерильный раствор базового фосфатного буфера для среды;
3.Маточные стерильные растворы микроэлементов, железа лимоннокислого, сульфата магния и хлористого аммония;
4.Шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, резиновые пробки с микробиологическими фильтрами;
5.Термостатируемая качалка (или шейкер-инкубатор).
Введение в биотехнологию. Метод. указания по лабораторным работам |
-28- |

МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.4. Проведение процесса ферментации с лимитированием субстрата
Ходработы:
1.Приготовить 4 варианта среды с различными концентрациями хлористого аммония в среде (0,8; 0,4; 0,2 и 0,1 г/л):
–в микробиологическом боксе к 0,5 л фосфатного буфера над спиртовкой (или в боксе-ламинаре) добавить 2,5 мл стандартного раствора железа, 1,5 мл раствора микроэлементов, 2 мл раствора сульфата магния и требуемый объем раствора хлорида аммония (в 1 мл которого содержится 100 мг соли); раствор углеродного субстрата (из расчета 5 – 10 г/л фруктозы);
–около 200 мл среды отбросить;
–оставшиеся 300 мл среды засеять инокулятом, смыв культуру с одной музейной пролбикиго (использовать шпатели);
–инокулят разлить в три ферментационные колбы по 100 мл (три би о- логические повторности), используя стерильную мерную посуду;
–колбы закрыть ватно-марлевыми пробками;
–колбы подписать (например, 1а, 1б, 1в);
–на ФЭК измерить оптическую плотность (без разведения) каждого инокулята;
–колбы установить на качалку.
2.В течение 3–4 дней проводить измерения оптической плотности культуры и по калибровочной кривой – определить концентрацию биомассы
вкультуре Х, г/л.
3.Данные занести в табл. 2.3.
Таблица 2.3
Показатели роста культуры R. eutropha при различной обеспеченности азотом
Группа |
|
Текущие |
|
|
|
|
показатели |
|
|
|
|
культуры |
|
|
|
T, 0C |
ОП |
Х, г/л |
|
№ 1 |
|
|
|
|
Время от |
|
|
|
|
начала |
|
|
|
|
|
|
|
|
|
опыта, ч |
|
|
|
|
|
|
|
|
|
№ 2 |
|
|
|
|
Время от |
|
|
|
|
начала |
|
|
|
|
|
|
|
|
|
опыта, ч |
|
|
|
|
|
|
|
|
|
№ 3 |
|
|
|
|
Время от |
|
|
|
|
начала |
|
|
|
|
|
|
|
|
|
опыта, ч |
|
|
|
|
|
|
|
|
|
№ 4 |
|
|
|
|
Время от |
|
|
|
|
начала |
|
|
|
|
|
|
|
|
|
опыта, ч |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Введение в биотехнологию. Метод. указания по лабораторным работам |
-29- |

МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.4. Проведение процесса ферментации с лимитированием субстрата
Вопросы:
1.В чем специфика метаболизма водородокисляющих хемоавтотрофных микроорганизмов?
2.В чем основные трудности культивирования газоиспользующих микроорганизмов?
3.Что позволяет фиксировать в ходе культивирования водородных бактерий метод Шлегеля?
Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста
микроорганизмов с лимитированием субстрата
Цель работы: обучение нахождению основных характеристик микробной культуры на основе экспериментальных результатов.
Скорость роста является одним из основных показателей, характеризующих адекватность условий ферментации для микроорганизмов. Скорость роста (увеличение биомассы) организмов с бинарным делением в хорошо перемешиваемой среде в периодической культуре будет пропорциональна концентрации микробной биомассы:
dX/d t= µX, |
(1) |
где dX/dt – скорость роста, Х – биомасса, µ – коэффициент пропорциональности («удельная скорость роста»); параметр аналогичен сложным процентам (например, если удельная скорость роста равна 0,1 ч–1, значит увеличение биомассы равно 10 % в час). Если величина µ постоянна, как это бывает в установившемся режиме культивирования, то интегрирование представленного уравнения дает
lnX = lnX0 +µ t,
(2)
где Х0 – биомасса в начальный период времени t.
График зависимости lnX от времени будет иметь вид прямой линии с наклоном µ.
Валовая (или общая) скорость роста v характеризуется абсолютным приростом биомассы за единицу времени:
v=dX/dt.
(3)
Введение в биотехнологию. Метод. указания по лабораторным работам |
-30- |
МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста .
Обе величины, удельная и общая скорость роста, характеризуют данную культуру в данных условиях и не являются количественной характеристикой штамма.
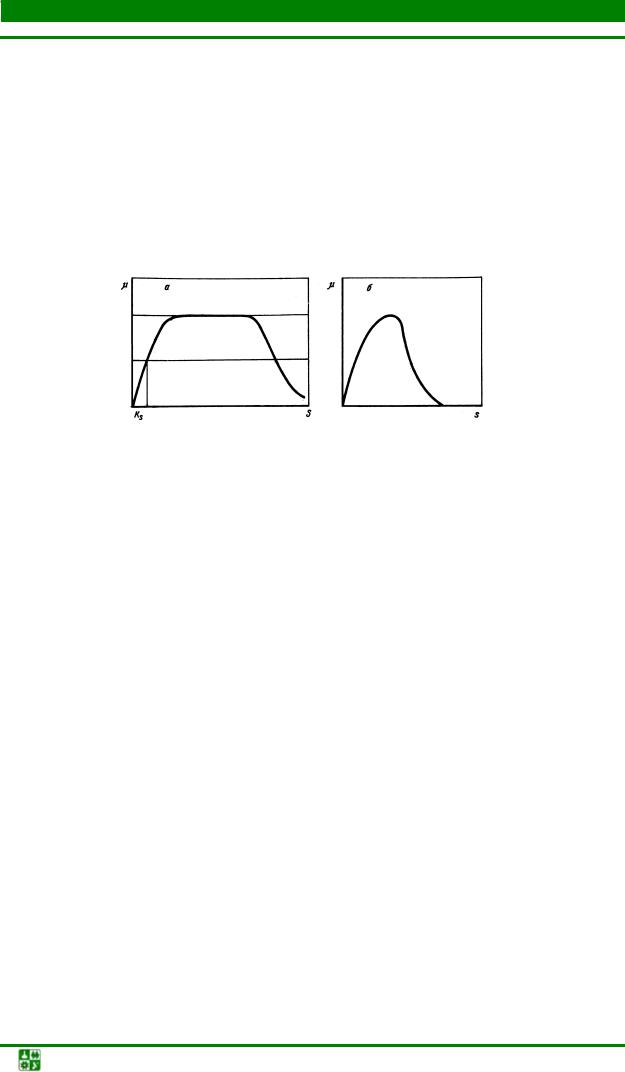
Рост культуры µ характеризуется кривой зависимости плотности популяции (биомассы) Х от концентрации субстрата S, обычно имеющей широкое плато (зону независимости величины биомассы от концентрации биогена) (рис. 2.6, а). Когда скорость роста микробной культуры ограничена не дефицитом субстрата, а воздействием ингибитора, кривая зависимости величины биомассы от концентрации ингибитора имеет иной вид (рис. 2.6, б).
Рис. 2.6. Зависимость скорости роста микробной культуры от концентрации субстрата: а – зависимость µ от S (концентрации минерального субстрата); б – зависимость µ от I (концентрации ингибитора)
Продуктивностьпроцесса микробного роста характеризуется количеством продукта, получаемого на единицу объема биореактора в единицу времени. Продуктивность процесса зависит от многих факторов: активности продуцента, значений коэффициента выхода продукта из потребленного субстрата, количества активной биомассы в ферментере:
П = qs Yp/s X, г/л ч,
(4)
где qs – скорость потребления субстрата (метаболический коэффициент), Yp/s – выход продукта (экономический коэффициент), X – концентрация био-
массы, P – продукт, S – субстрат.
Выход продукта Y (экономический коэффициент) определяется как количе-
ство продукта, получаемого из данного количества субстрата:
Y = X/Sо – S,
(5)
где S и So – конечная и исходная концентрации субстрата.
Данный коэффициент выражает эффективность использования субстрата для получения целевого продукта и является очень важной характеристикой, так как непосредственно связан с продуктивностью и позволяет непосредственно влиять на себестоимость конечного продукта. Экономический
Введение в биотехнологию. Метод. указания по лабораторным работам |
-31- |
МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста .
коэффициент имеет четкий физический смысл, характеризующий степень перехода энергии, заключенной в субстрате, в продукт. Данная величина необходима для расчетов и прогнозирования процесса в целом и используется в качестве параметра для контроля и управления ходом различных процессов и сопоставления их эффективности.
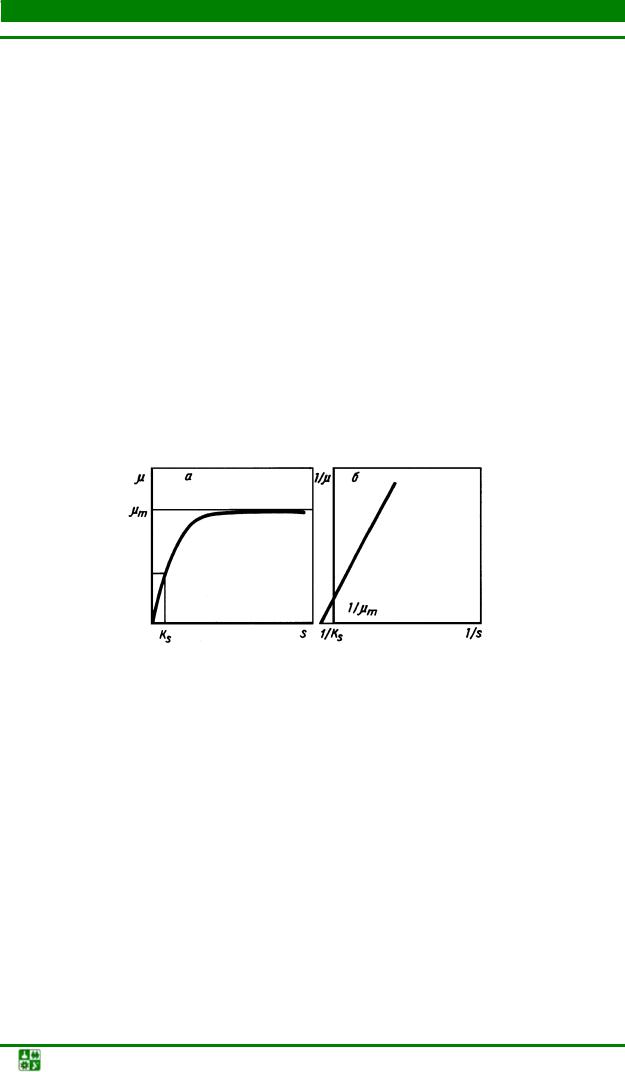
Основой для изучения кинетики роста микробных культур является метод острых опытов; этим методом определяют основные показатели роста: субстратную константу Ks, константу ингибирования Ki, максимальную скорость роста µmax и влияние на них внешних факторов. Для этого клетки из экспоненциальной фазы роста помещают на короткий промежуток времени в среды с различной концентрацией исследуемого субстрата и через короткий промежуток времени t2 – t1 измеряют плотность культуры и вычисляют удельную скорость роста по уравнению (2). В контроле скорость роста не лимитирована субстратом, в экспериментальных пробах – лимитирована заданной концентрацией исследуемого субстрата. Полученные результаты обрабатываются по методу обратных величин Лайнуевера и Берка, µmax и Ks строится график зависимости 1/ и 1/S, после этого графически находятся величины (рис. 2.7).
Рис. 2.7. Схема определения µmax и Ks методом обратных величин (по Лайнуеверу и Берку): а – зависимость µ от S: б – прямая отсекает 1/µmax и 1/Ks
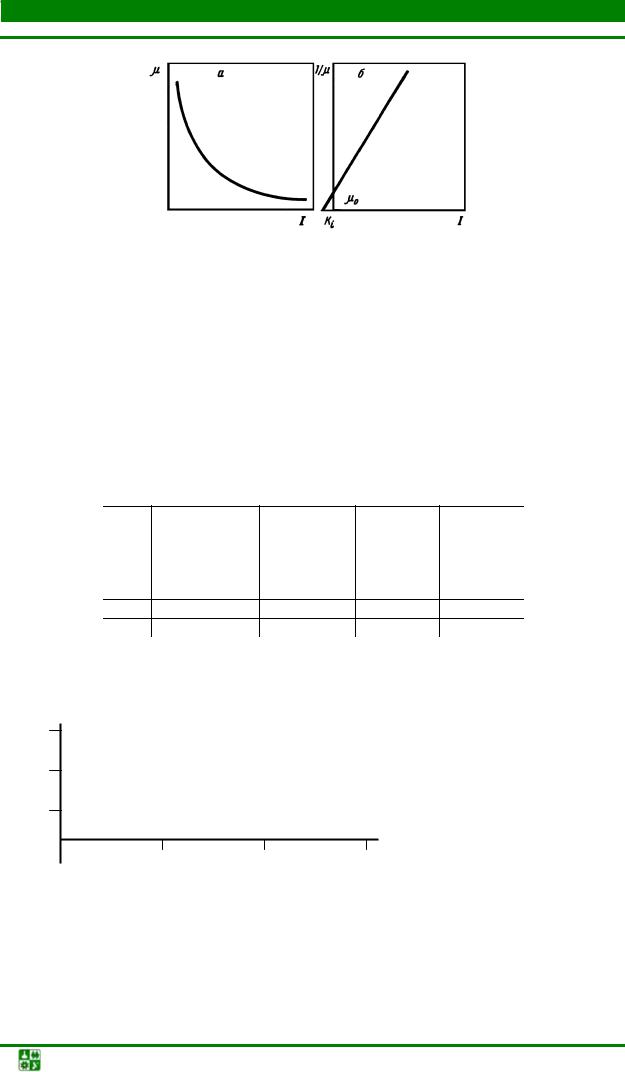
Аналогичным способом находят константу ингибирования (Ki), к пробам растущей культуры добавляют различные дозы ингибитора и заменяют скорость роста при различных концентрациях последнего. Далее строится
график, по которому графически определяют искомые величины: µmax и Ki
(рис. 2.8).
Введение в биотехнологию. Метод. указания по лабораторным работам |
-32- |
МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста .
Рис. 2.8. Схема определения µmax и Ki методом обратных величин (по Лайнуеверу
и Берку): а – зависимость µ от I: б – прямая отсекает 1/µmax и 1/ Ki
Материалыиоборудование:
Персональный компьютер.
Ходработы:
1. Используя известные уравнения, определить значения удельной скорости роста при заданных (четырех) концентрациях азота в среде (из результатов табл.1), а также вычислить продуктивность культуры и экономический коэффициент по азоту. Значения занести в табл. 2.4.
Таблица 2.4
Влияние концентрации NH4Cl в среде на характеристики культуры R. Еutropha
NH4Cl, Средняя (ва- |
Удельная |
Продук- |
Экономи- |
|
г/л |
ловая) ско- |
скорость рос- |
тивность |
ческий |
|
рость роста |
та R.eutropha |
культуры, |
коэффи- |
|
R.eutropha |
|
г/л ч |
циент |
|
|
|
|
Y, г/г |
2. Построить график зависимости удельной скорости роста бактерий R.eutropha от концентрации NH4Cl в среде.
μ, 1/ч
NH4Cl, г/л
3. Используя графоаналитический метод Лайнуевера – Берка построить график зависимости обратных величин удельной скорости роста от обратной величины концентрации азота в среде.
Введение в биотехнологию. Метод. указания по лабораторным работам |
-33- |
