
- •ОГЛАВЛЕНИЕ
- •ПРЕДИСЛОВИЕ
- •МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ»
- •Работа 1.1. Планирование эксперимента и построение модели на примере выращивания микроорганизмов
- •Работа 1.2. Модели роста микроорганизмов
- •Вопросы:
- •Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров
- •Вопросы:
- •МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
- •Задачи:
- •Работа 2.1. Типы ферментационных процессов
- •Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом
- •Вопросы:
- •Вопросы:
- •Вопросы:
- •Вопросы:
- •Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта
- •Работа 2.7. Методы анализа содержания основных (общий азот, белок)
- •Вопросы:
- •Работа 2.8. Методы анализа запасных (полисахара, биополимеры) клеточных макромолекул
- •Вопросы:
- •МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ
- •Работа 3.1. Выделение ферментов (на примере светящихся белков)
- •Вопросы:
- •Работа 3.2. Методы детекции ферментативной активности
- •Вопросы:
- •Задачи:
- •Работа 5.1. Иммобилизация микробных клеток
- •Вопросы:
- •Вопросы:
- •МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ
- •Вопросы:
- •Вопросы:
- •МОДУЛЬ 7. СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОТЕХНОЛОГИЯ
- •Вопросы:
- •МОДУЛЬ 8. ПЕРСПЕКТИВЫ РАЗВИТИЯ БИОТЕХНОЛОГИИ
- •СПИСОК ЛИТЕРАТУРЫ

МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.1. Типы ферментационных процессов
Материалыиоборудование:
1.Термостатируемая качалка-шейкер для культивирования микроорганизмов;
2.Лабораторный ферментационный комплекс «BioFlo”;
3.Опытное производство биополимеров.
Ходработы:
Проведение экскурсии и знакомство с типами ферментационных процессов:
-периодическим аэробным жидкофазным;
-проточным в лабораторном ферментере на гетеротрофном субстрате;
-проточном в лабораторном ферментере на газовом субстрате;
-посещение опытного производства биополимеров.
Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом
Цель работы: обучение технике культивирования микроорганизмов в режиме периодического процесса.
Культуры микроорганизмов можно подразделять на «открытые» и «закрытые» системы. Закрытой называют такую систему, в которой хотя бы один из существенных компонентов не может ни поступать в систему, ни покидать ее. Простая периодическая культура, содержащая ограниченное первоначальное количество питательного субстрата, служит примером закрытой системы. В закрытой системе скорость роста биомассы должна стремиться к нулю либо из-за недостатка субстрата, либо из-за непереносимости продукта при его дальнейшем накоплении. Такие системы всегда находятся в неустойчивом состоянии. Процесс выращивания микроорганизмов до недавнего времени представлялся довольно простым, идущим через ряд принципиально общих стадий, приводящих к получению из ничтожного количества посевного материала значительного количества биомассы или биомассы и продуктов метаболизма. Кривая роста – это суммарная запись истории роста культуры. Фазы роста не столько изучались, сколько просто описывались.
После лаг-периода наблюдается максимальная скорость роста, затем рост прекращается либо из-за недостатка источников питания, либо из-за накопления ингибирующих продуктов, либо из-за некоторых изменений в физических свойствах среды. После того как биомасса достигнет максимума, наступает стационарная фаза, в которой количество биомассы остается постоянным. Затем, раньше или позже, количество биомассы уменьшается в результате метаболических процессов, связанных с поддержанием жизнедеятельности, или автолиза. Продолжительность экспоненциального роста частично зависит от начальной концентрации субстрата, лимитирующего рост. Кажущееся замедление роста, стационарная фаза и фаза отмирания могут наступить, если возникнут некоторые условия, летальные для организ-
Введение в биотехнологию. Метод. указания по лабораторным работам |
-20- |
МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом
мов. При этом наблюдаемая скорость роста будет определяться разностью между действительной скоростью роста и скоростью отмирания клеток.
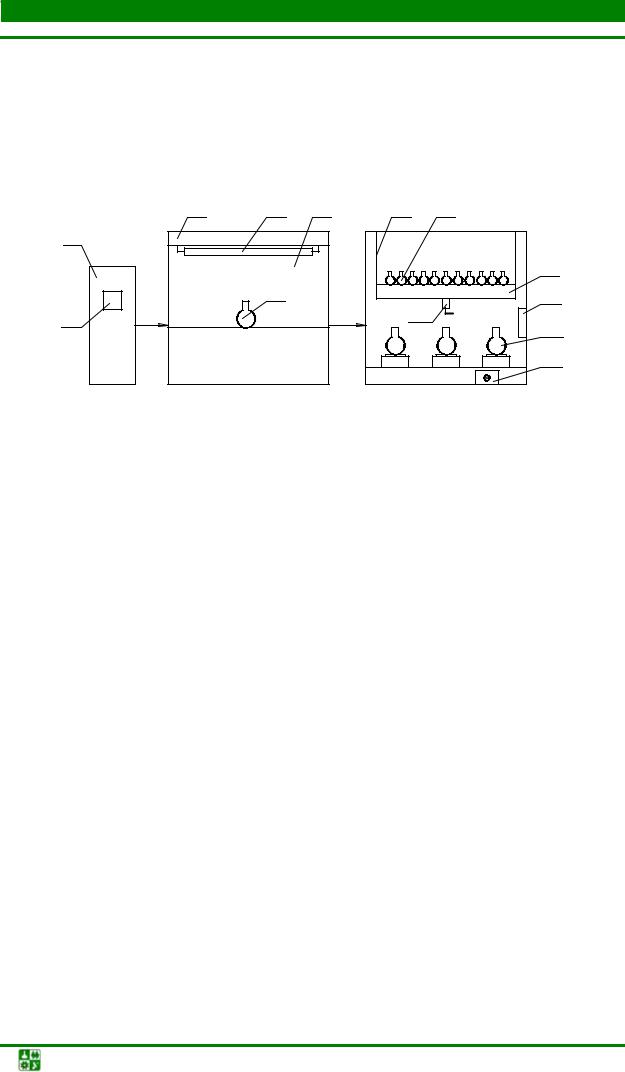
Простейшее лабораторное оборудование для выращивания микроорганизмов в периодическом режиме включает термостатируемую качалку или магнитные мешалки, на которые устанавливаются колбы (рис.
2.2).
6 |
4 |
3 |
1 |
|
|
|
5 |
|
2 |
|
|
7 |
8 |
|
9 |
|
11 |
|
10 |
|
12 |
|
13 |
Рис. 2.2. Аппаратурная схема культивирования микроорганизмов в периодическом режиме: 1 – бытовой холодильник; 2 – коллекция штаммов;
3 – бокс-ламинар; 4 – УФ-облучатели; 5 – колба; 6 – фильтр НЕРА; 7 – качалка; 8 – колбы; 9 – платформа для колб; 10 – электродвигатель; 11 – блок термостабилизации;
12 – колбы на магнитных мешалках; 13 – регулятор тока
Материалыиоборудование:
1.Музейная культура штамма R. eutrophus B-5786;
2.Стерильный раствор базового фосфатного буфера для среды;
3.Маточные стерильные растворы микроэлементов, железа лимоннокислого, сульфата магния и хлористого аммония;
4.Шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, резиновые пробки с микробиологическими фильтрами;
5.Термостатируемая качалка, газгольдер, вакуумный насос, газовые субстраты (водород, кислород, углекислота).
Ходработы:
1.Приготовить питательную среду для выращивания бактерий: в микробиологическом боксе к 0,5 л основной среды (фосфатный буфер) в стерильных условиях над спиртовкой добавить 2,5 мл стандартного раствора железа, 1,5 мл раствора микроэлементов, 2 мл раствора сульфата магния и требуемый объем раствора хлорида аммония (в 1 мл которого содержится 100 мг соли); углеродный субстрат (из расчета 10 г/л фруктозы).
2.Инокулят разлить в три ферментационные колбы по 100 мл (пять биологических повторностей для периодической культуры и 5 – для культуры с подпиткой субстратом), используя стерильную мерную посуду.
3.Колбы плотно закрыть резиновыми пробками;
4.Колбы подписать (например, 1а, 1б, 1в и т.д.);
Введение в биотехнологию. Метод. указания по лабораторным работам |
-21- |

МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом
5.Измерить исходную оптическую плотность культуры;
6.Колбы установить на качалку;
7.В 5 колб для культивирования с подпиткой субстратом через 12, 24 и 36 ч после начала роста культуры внести добавку углеродного субстрата ( из расчета 1-2 г/л л);
8.Периодически производить отбор проб для измерения оптической плотности культуры на ФЭК и микроскопирования клеток.
9.Данные занести в табл. 2.1.
Таблица 2.1
Показатели роста культуры R. eutropha в ходе развития периодической культуры
Группа |
|
Исходные |
Текущие |
|
||
|
|
показатели ино- |
показатели |
|
||
|
кулята |
|
|
культуры |
|
|
|
ОП |
|
Х, г/л |
ОП |
|
Х, г/л |
№ 1 |
|
1 |
|
|
|
|
Время от на- |
|
2 |
|
|
|
|
чала опыта, ч |
|
3 |
|
|
|
|
|
|
|
||||
|
|
4 |
|
|
|
|
|
|
|
|
|
||
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
№ 2 ( с под- |
|
1 |
|
|
|
|
питкой субстратом) |
|
2 |
|
|
|
|
Время от на- |
|
3 |
|
|
|
|
чала опыта, ч |
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
10. По результатам эксперимента построить кривую накопления биомассы культур.
Вопросы:
1.Каковы основные требования к организации периодического культивирования микроорганизмов?
2.Какие основные характеристики микробного роста в периодической культуре?
3.Каковы отличия и преимущества периодического режима культивирования микроорганизмов с подпиткой субстратом?
Работа 2.3. Проточныекультуры: хемостат, турбидостат
Цель: дать представление о методах, инструментальном оформлении и возможностях метода проточных культур.
Метод проточного культивирования вошел в микробиологию и базируется на процессах химической технологии. Принцип проточного культивиро-
Введение в биотехнологию. Метод. указания по лабораторным работам |
-22- |
МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.3. Проточные культуры: хемостат, турбидостат
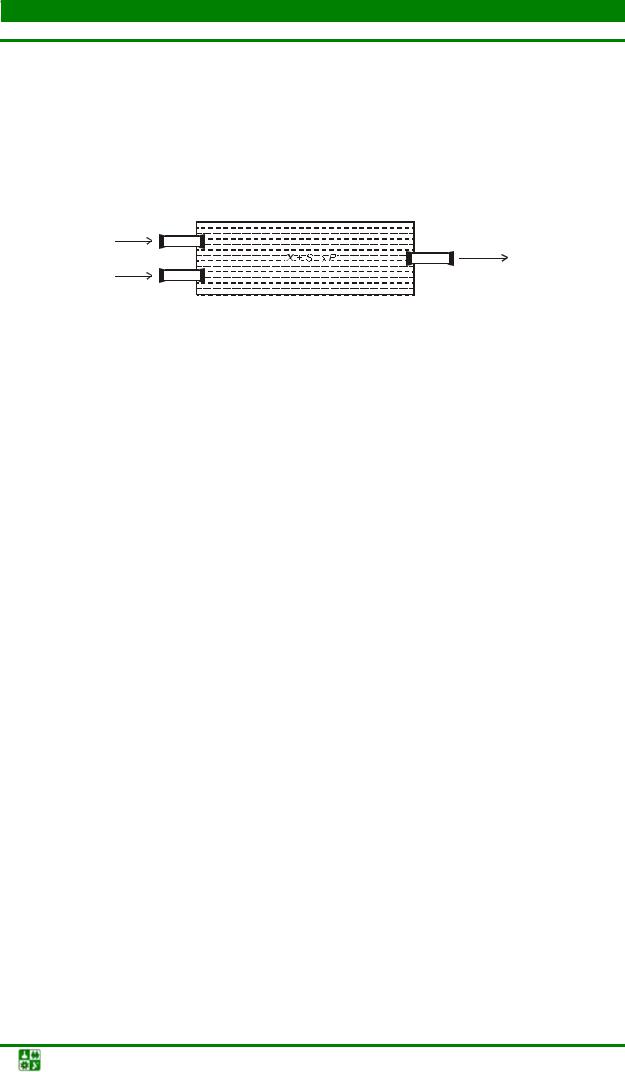
вания состоит в том, что в сосуд, где размножаются микр оорганизмы, непрерывно подается свежая питательная среда и одновременно вытекает такой же объем культуры. По такому принципу организуются два различных процесса культивирования: процесс полного вытеснения и процесс полного смешения. В первом случае сосуд для выращивания представляет собой трубку, тубулярный ферментер, в которой втекают среда и посевной материал и вытекает культура. Перемешивание не производится (рис. 2.3).
Х0
Х0 + S0 + P
S0
Рис. 2.3. Схема тубулярного биореактора полного вытеснения: sr – концентрация субстрата в поступающей среде; i – то же в вытекающей среде;
s1 – то же в фе рментере; плотности: х± – подаваемой популяции, х2 – вытекающей культуры; х – популяции в ферментере
Подобным образом можно культивировать микроорганизмы, не требующие аэрации. У одного конца ферментера, куда подается среда и культура, клетки находятся в начале стадии роста; по мере прохождения клетками трубки культура "стареет", исчерпывается субстрат, накапливаются продукты метаболизма и перед вытеканием культура находится в состоянии, аналогичном стационарной фазе роста периодической культуры. Таким образом, в трубке воспроизводится полная кривая роста, ноне во времени, а в пространстве.
Непрерывные процессы. В непрерывных процессах биообъектпостоянно поддерживается в экспоненциальной фазе роста. Обеспечивается непрерывный приток свежей питательной среды в биореактор и отток из него культуральной жидкости, содержащей клетки и продукты их жизнедеятельности. Фундаментальным принципом непрерывных процессов служит равновесие между приростом биомассы за счет деления клеток и их убылью в результате разбавления свежей средой:
μ= D ,
где μ — удельная скорость роста клеток, D — коэффициент разбавления (скорость убыли концентрации клеток). Различают хемостатный и турбидостатный режимы непрерывного культивирования.
В процессе полного смешения рост происходит в емкости – ферментере при интенсивном перемешивании (рис. 2.4).
Введение в биотехнологию. Метод. указания по лабораторным работам |
-23- |

МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.3. Проточные культуры: хемостат, турбидостат
1 |
2 |
1 |
2 |
3 |
|
|
4 |
|
|
|
|
5 |
|
6 |
|
|
3 |
|
|
A Б
Рис. 2.4. Схемы биореакторов для проточного культивирования микроорганизмов: А – хемостат; Б – турбидостат с автоматической регуляцией оптической плотности; 1 – поступление среды, 2 – мешалка, 3 – сток культуры, 4 – насос, 5 – фотоэлемент, 6 – источник света
Перемешивание достигается продуванием воздуха или работой мешалки либо тем и другим способом одновременно. Во всей массе культуры условия должны быть совершенно одинаковыми. Этот метод культивирования называется гомогенно-непрерывным или гомогеннопроточным. В ферментере создаются условия, соответствующие одной точке кривой роста. При быстром протоке среды эти у словия близки к быстрому экспоненциальному росту, при медленном – приближаются к условиям стационарной фазы. При таком методе культивирования может быть воспроизведена любая периодическая культура от начала замедления роста после экспоненциальной фазы и до конца стадии замедления роста. В установившемся режиме скорость протока среды равняе т- ся удельной скорости роста культуры. При этом культура находится в устойчивом состоянии динамического равновесия и обладает способностью подстраиваться к изменениям условий.
При хемостатном режиме культивирования в биореактор с постоянной контролируемой скоростью вливают питательную среду, один из компонентов которой, часто Ог, поступает в количестве, не достаточном для обеспечения максимальной скорости роста культуры. В этом случае реактор с биообъектом приобретает свойства саморегулирующейся системы, автоматически удовлетворяющей равенству μ= D . Если первоначально скорость разбавления и вымывания биомассы превышает скорость роста клеток, то наступает разбавление культуры свежей средой. Это ведет к повышению концентрации компонента, ограничивающего рост, вследствие чего скорость роста культуры увеличивается. Как только μ превысит D, в реакторе начинает концентрироваться биомасса. Увеличивающаяся популяция клеток все активнее «выедает» субстрат, его концентрация падает, что, в свою оч е- редь, ведет к торможению роста культуры. Таким образом, после серии затухающих колебаний скорость роста культуры становится равной скорости ее разбавления.
Введение в биотехнологию. Метод. указания по лабораторным работам |
-24- |

МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.3. Проточные культуры: хемостат, турбидостат
Биореактор, работающий в хемостатном режиме культивирования, называют хемостатом. Он включает: 1) устройство для вливания питательной среды; 2) выпускное приспособление для оттока культуральной жидкости с клетками; 3) систему контроля скорости протока (рис. 2.4, А).
Один из простейших вариантов хемостата содержит насос, постоянно нагнетающий питательную среду в биореактор, и выпускную трубу, по которой жидкость из биореактора вытекает, как только ее уровень поднимается выше горловины этой трубы. Альтернативный вариант — выпускная труба входит в полость биореактора сверху и нижний обрез ее горловины соответствует уровню, выше которого жидкость не должна подниматься. Если этот уровень превышен, избыток культуральной среды с клетками отсасывается насосом, подсоединенным к выпускной трубе.
Турбидостатный режим культивирования основан на прямом контроле концентрации биомассы. Наиболее распространено измерение светорассеяния содержимого биореактора с помощью фотоэлемента. Сигнал от фотоэлемента управляет скоростью протока жидкости, в свою очередь определяющего скорость роста культуры (рис. 2.4, Б). Повышение концентрации клеток и соответственно светорассеяния автоматически приводят к ускорению протока жидкости, разбавляющей культуру, и, наоборот, убыль биомассы компенсируется замедлением протока.
Концентрация клеток может оцениваться также по косвенным критериям (по измерению рН, убыли субстрата или накоплению продуктов жизнедеятельности). Непрерывное культивирование, осуществляемое в одном биореакторе, обозначается как одностадийное. Многостадийное культивирование с последовательным или каскадным расположением реакторов позволяет внедрить принцип дифференцированных режимов в непрерывные биотехнологические процессы. Эти дифференцированные режимы не сменяют друг друга во времени, а одновременно осуществляются в последовательно расположенных аппаратах. Например, в первом из биореакторов создают оптимальные условия для роста культуры, а во втором — для биосинтеза целевого продукта.
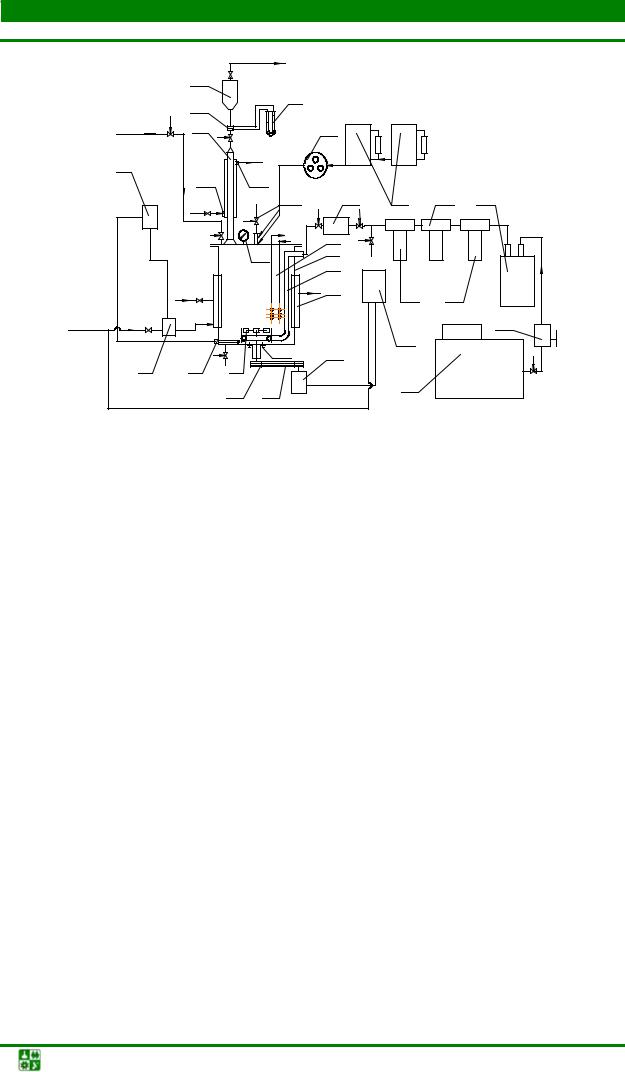
Принципиальная схема лабораторного биореактора (ферментера) представлена на рис. 2.5.
Введение в биотехнологию. Метод. указания по лабораторным работам |
-25- |
МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ
Работа 2.3. Проточные культуры: хемостат, турбидостат
|
|
|
|
оборотныйвоздух |
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
10 |
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пар |
ВР21 |
11 |
ВР20 |
|
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
27 |
|
28 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
ВЗ5 |
|
ВР21 |
13 |
16 |
23 |
26 |
|
|
|
|
|
|
ВР2 |
|
|
|
|
|
|
ВР10 |
|
|
ВР18 |
|
|
|
|
|
|
|
|
|
|
воздух |
||
|
|
|
|
|
4 |
ВР3 |
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
30 |
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
3 |
|
|
|
|
|
|
ВЗ |
|
|
|
22 |
|
24 |
|
|
вода |
|
|
|
|
|
||
|
ВЗ6 |
|
|
|
|
|
|
|
|
вода |
|
|
|
|
|
20 |
|
25 |
|
|
|
|
|
|
29 |
17 |
|
|
|
|
7 |
|
6 |
22 |
|
|
|
||
|
|
ВР5 |
|
|
|
|
ВР15 |
||
|
|
|
|
18 |
19 |
|
14 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
Рис. 2.5. Аппаратурная схема ферментёра-инокулятора: 1 – биореактор; 2 – барботёр; 3 – теплообменная рубашка; 4 – измерительная ячейка; 5 – турбинная мешалка;
6 – термопара; 7 – регулирующий клапан; 8 – контактный термометр; 9 – дифференциальный манометр; 10 – диафрагма; 11 – конденсатор; 12 – сепаратор;
13 – фильтр стерилизации воздуха; 14 – компрессор; 15 – перистальтический насос; 16 – ёмкости для подпитывающих растворов; 17 – электродвигатель; 18 – шкив; 19 – ремень привода; 20 – электро-контактный манометр; 22 – 24, 26 фильтры;
25 – редуктор; 27 – вход и выход воды; 28 – штуцер; 29 – крепёжные гайки; 30 – манометр
Материалыиоборудование:
1.Лабораторный ферментационный комплекс «Bio-Flo»;
2.Стерильные растворы для приготовления питательной среды;
3.Инокулят (посевная культура);
4.ФЭК;
5.Стеклянная посуда, колбы, мерные стаканы, пипетки, бюксы.
Ходработы:
1.В микробиологическом боксе (или боксе-ламинаре) из маточных стерильных растворов приготовить 1 л питательной среды;
2.В обработанную УФ-облучателями комнату внести необходимое оборудование (среда, инокулят);
3.Склянку со средой соединить с насосом-дозатором, подключенным к ферментеру;
4.В ферментер влить инокулят (1 л);
5.Включить аэропомпу;
6.Включить систему перемешивания и термостабилизации;
7.Замерить исходную оптическую плотность (ОП) инокулята;
8.Фиксировать в рабочем журнале (таблица 2.2) температуру культу-
ры;
Введение в биотехнологию. Метод. указания по лабораторным работам |
-26- |
