
- •П.А. Киселев, с.Б. Бокуть курс лекций по физической химии
- •Введение
- •Лекция 1. Газовые законы
- •1.1. Температура и нулевой закон термодинамики
- •1.2. Законы поведения идеальных газов: уравнение состояния идеального газа
- •1.3. Кинетическое уравнение газов
- •1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
- •1.5. Закон парциальных давлений Дальтона
- •Лекция 2. Первое начало термодинамики и термохимия
- •2.1. Вводная часть
- •2.2. Некоторые понятия, используемые в термодинамике
- •2.3. Формулировка первого начала термодинамики
- •2.4. Применение первого начала термодинамики к различным процессам
- •2.5. Теплота химической реакции (общие положения)
- •2.6. Закон Гесса
- •2.7. Следствие из закона Гесса
- •Лекция 3. Второе начало термодинамики и его применение
- •3.1. Основной смысл и значение второго закона термодинамики
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировка и математическое выражение второго начала термодинамики
- •3.4. Изменение энтропии изолированной системы
- •3.5. Статистическая природа второго начала термодинамики
- •Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
- •4.1. Формулировка третьего начала термодинамики
- •4.2. Абсолютные и стандартные значения энтропии
- •4.3. Расчеты изменения энтропии в различных процессах
- •1. Расчеты изменения энтропии при изотермических процессах
- •2. Расчет изменения энтропии в неизотермических процессах
- •3. Расчет изменения энтропии сложного процесса
- •4.4. Расчет изменения энтропии при протекании химического процесса
- •4.5. Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
- •Лекция 5. Химические реакции как открытые в термодинамическом смысле системы. Направление протекания химических реакций. Равновесные химические реакции
- •5.1. Понятие о химическом потенциале
- •5.2. Экзергонические и эндергонические реакции
- •5.3. Взаимосвязь энтальпийного и энтропийного факторов в качестве критерия самопроизвольного протекания химической реакции
- •5.4. Понятие о равновесии химической реакции. Обратимые и необратимые реакции
- •5.5. Уравнение изотермы химической реакции и вывод закона действующих масс
- •5.6. Зависимость константы химического равновесия от температуры
- •Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
- •6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
- •6.2. Летучесть
- •6.3. Идеальный раствор
- •6.4. Фазовая диаграмма содержит зоны, линии и тройную точку
- •6.5. Уравнение Клаузиуса-Клапейрона
- •6.6. Коллигативные свойства растворов
- •6.7. Понижение точки замерзания и повышение точки кипения растворов
- •6.8. Осмотическое давление
- •6.9. Растворы электролитов
- •Лекция 7. Растворы электролитов
- •7.1. Общие сведения о теории электролитической диссоциации
- •7.2. Сильные и слабые электролиты
- •7.3. Закон разведения
- •7.4. Сильные электролиты
- •7.5. Ионная сила
- •7.6. Произведение растворимости
- •7.7. Электролитическая диссоциация воды
- •7.8. Концентрация водородных ионов
- •7.9. Буферные растворы
- •7.10. Механизм действия буферных растворов
- •7.11. Буферная емкость
- •Лекция 8. Основные понятия химической кинетики
- •8.1. Химическая реакция
- •8.2. Механизм химической реакции
- •8.3. Исходные, конечные и промежуточные вещества
- •8.4. Глубина превращения реакции
- •8.5. Гомогенные и гетерогенные реакции
- •8.6. Скорость химической реакции
- •8.7. Измерение скорости реакции
- •8.8. Порядок реакции и константа скорости реакции
- •8.9. Молекулярность реакции
- •8.10. Количественные соотношения между скоростью реакции и концентрацией реагента
- •8.11. Реакция второго порядка
- •8.12. Уравнение скорости реакции третьего порядка
- •8.13. Уравнение скорости реакции нулевого порядка
- •8.14. Определение порядка реакции
- •8.15. Теоретические основы химической кинетики
- •8.15.1. Теория активных соударений
- •8.15.2. Теория активированного (переходного) комплекса (переходного состояния)
- •8.15.3. Вывод основного уравнения теории переходного состояния
- •8.15.4. Термодинамическая форма основного уравнения теории переходного состояния
- •8.15.5. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
- •Лекция 9. Основы кинетики и механизма ферментативных реакций. Гомогенный и гетерогенный катализ
- •9.1. Понятие катализа
- •9.2. Основы теории гомогенного катализа
- •9.3. Основы теории гетерогенного катализа
- •9.4. Ферменты как биологические катализаторы
- •9.5. Кинетика реакций, катализируемых ферментами
- •9.6. Физический смысл величин Km и Vmax
- •9.7. Уравнение Михаэлиса-Ментен и ферментативные механизмы
- •9.8. Общее уравнение скорости
- •Лекция 10. Электрохимия
- •10.1. Введение в электрохимию
- •10.2. Термодинамика электрохимических систем
- •10.3. Электродный потенциал
- •10.4. Двойной электрический слой на границе между металлом и раствором электролита
- •10.5. Зависимость плотности заряда от концентрации электролита
- •Лекция 11.Электродные и безэлектродные электрохимические системы
- •11.1. Правила записи эдс и электродных потенциалов электрохимических систем
- •11.2. Типы электродов
- •11.3. Диффузионный и межжидкостный потенциалы
- •На электродах протекают реакции
- •11.5. Концентрационные цепи
- •Лекция 12. Поверхностные явления и адсорбция
- •12.1. Общая характеристика поверхностных явлений
- •12.2. Поверхностные явления в дисперсных системах
- •12.3. Поверхностное натяжение и природа вещества
- •12.4. Термодинамика поверхностных явлений в однокомпонентных системах
- •12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
- •12.6. Уравнение Томсона
- •12.7. Капиллярные явления
- •Лекция 13. Адсорбция
- •13.1. Уравнение адсорбции Гиббса
- •13.2. Обзор сорбционных явлений
- •13.3. Природа адсорбционного взаимодействия
- •13.4. Термическое уравнение адсорбции. Изотерма адсорбции
- •13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
- •Литература
- •Содержание
10.3. Электродный потенциал
При погружении металлической пластинки (электрода) в раствор электролита между пластинкой и раствором возникает скачок потенциала. Почему это происходит? в узлах кристаллической решетки металла находятся положительно заряженные ионы. В результате взаимодействия с полярными молекулами растворителя они отрываются и переходят в раствор. Параллельно происходит и обратный процесс. Если в первый момент скорость процесса перехода ионов из раствора в металл меньше скорости прямого перехода, то металл приобретает избыточный отрицательный заряд. Положительно заряженные ионы не удаляются от поверхности металла, а накапливаются у его поверхности. В результате образуется двойной электрический слой, в котором и возникает скачок потенциала.
Возможна и такая ситуация, когда скорость перехода ионов из раствора больше скорости перехода ионов в раствор. В этом случае поверхность металла зарядится положительно. Со временем и в том, и в другом случае в системе установится равновесие, поскольку переход в раствор и из раствора каждого последующего иона будет сопряжен с преодолением все большего энергетического барьера, связанного с возрастанием заряда металла (например, отрицательного при переходе ионов в раствор).
Таким образом, по мере увеличения отрицательного заряда будет уменьшаться разность электрохимических потенциалов мири разность скоростейV1иV2. Изменение электрохимических потенциалов будет сопровождаться изменением скачка потенциала на границе металл – раствор. В конце концовм=ри установится динамическое равновесие.
Такая картина может быть экспериментально подтверждена с помощью радиоактивных индикаторов. Например, это было сделано с использованием висмута, содержащего радиоактивный изотоп.
Условились считать заряд электрода по заряду металла. Если металлическая пластинка заряжена отрицательно, то электрод считается отрицательным. Однако в электрохимической системе (гальваническом элементе), состоящей из двух электродов, независимо от знака заряда каждого электрода знак «плюс» электрода определяется относительной заряженностью электродов, составляющих элемент.
Переход ионов металла в раствор (анодный процесс):
М Мz++Ze-.
Переход ионов в металл (катодный процесс):
Мz++Ze-М.
Так как оба процесса (прямой и обратный) связаны с переносом электрического заряда, то их скорости эквивалентны определенной величине тока I. Для расчетов обычно величину тока относят к единице поверхности электродаS. Это отношение называют плотностью тока:
i= 1/S. (10.12)
В момент равновесия скорости переноса одинаковы. Тогда при условии, что Sk=Sa(одинаковы) и величина анодной и катодной плотностей тока составляет
ia+ ik= io,
где io– ток обмена, который характеризует кинетику обмена в момент равновесия, максимальная работа перехода ионов из металла в раствор в момент равновесия прир=constравна:
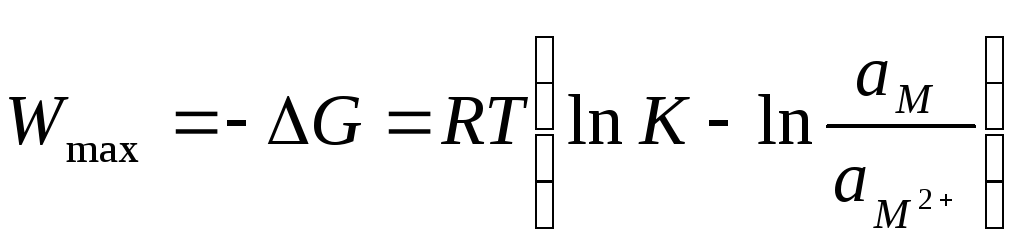 , (10.13)
, (10.13)
где ам2+– активность ионов металла в растворе,ам– активность ионов металла в металле. Последняя равна 1. Электрическая работа при этом равна
Wmax= –G=ZF, (10.14)
где – величина скачка потенциала на границе металл-электролит. Сопоставив (10.13) и (10.14), получим:
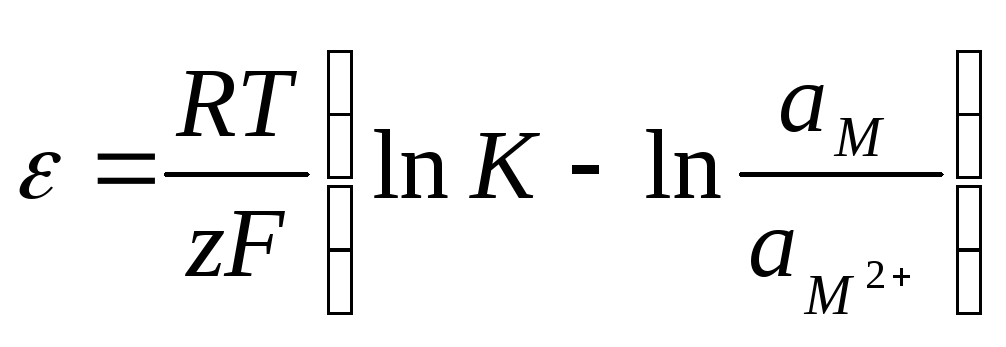 . (10.15)
. (10.15)
Величину скачка потенциала, как ЭДС, выражают в вольтах. Помня, что ам= 1, и перейдя к десятичным логарифмам, получим:
![]() . (10.16)
. (10.16)
При постоянной температуре первый член в правой части содержит только постоянные величины и, следовательно, является постоянной величиной. Обозначим ее через о. Тогда
![]() . (10.17)
. (10.17)
Определим физический смысл величины о.. Если активность потенциал-определяющих ионов равна единице, т.е.амZ+ = 1, в этом случаео =, т.е.о– это электродный потенциал, который возникает при погружении металла в раствор, в котором активность ионов металла равна 1 моль/л. Эта величина получила название стандартного электродного потенциала. Уравнение (10.17) было впервые выведено в 1890 году В. Нернстом и получило название уравнения Нернста.
Так как не существует ни теоретических, ни экспериментальных методов определения величины о, то его значения становятся определенными только при выборе условного нуля отсчета. В качестве такового выбран потенциал стандартного водородного электрода. Потенциалы всех остальных электродов сравниваются с потенциалом стандартного водородного электрода.
Величина ЭДС, измеренная по отношению (в гальваническом элементе) к стандартному водородному электроду, и есть величина электродного потенциала по водородной шкале.
