
- •Лекция 1 Первый закон термодинамики. Термохимия
- •1.1 Основные понятия химической термодинамики
- •1.2. Первый закон термодинамики
- •Математическое выражение первого закона термодинамики для различных типов систем:
- •1.3. Термохимия
- •Лекция 2 Второй закон термодинамики. Биоэнергетика. План
- •2.1. Второй закон термодинамики. Энтропия
- •Теорема Карно:
- •Формулировки второго закона:
- •2.2. Свободная энергия Гиббса
- •Способы расчета dg
- •2.3. Биоэнергетика
- •Лекция 3 химическое равновесие План
- •3.1. Кинетическое и термодинамическое описание химического равновесия
- •3.2. Смещение химического равновесия (принцип Ле Шателье)
- •Частные случаи принципа Ле Шателье
- •3.3. Равновесие в биологических средах
- •Гидролиз соли, образованной слабым основанием и сильной кислотой
- •Гидролиз соли, образованной слабой кислотой и сильным основанием
- •Гидролиз соли, образованной слабым основанием и слабой кислотой
- •Лекция 4 Физико-химические свойства растворов План
- •4.1. Растворы и их классификация
- •4.2. Термодинамика растворения
- •4.3. Растворимость газов, жидкостей и твердых веществ в воде
- •Лекция 5 Коллигативные свойства растворов План
- •5.1. Первый закон Рауля
- •5.2. Эбулиоскопический закон Рауля
- •5.3. Криоскопический закон Рауля
- •5.4. Осмос. Осмотическое давление
- •Лекция 6 Растворы электролитов План
- •6.1. Теория электролитической диссоциации с. Аррениуса
- •6.2. Теории слабых и сильных электролитов
- •6.3. Электропроводность растворов электролитов
- •6.4. Роль электролитов в жизнедеятельности организма
- •Лекция 7 Кислотно-основное равновесие в растворах План
- •7.1. Кислотность водных растворов и биологических жидкостей
- •7.2. Буферные растворы
- •7.3. Буферные системы крови
- •Лекция 8 Электрохимия План
- •8.1. Термодинамика окислительно-восстановительных реакций
- •Типы окислительно-восстановительных реакций
- •8.2. Устройство и принцип действия гальванических элементов
- •8.3. Потенциометрические методы анализа
- •Лекция 9 Химическая кинетика
- •9.1. Понятие о скорости и механизме химических реакций
- •9.2. Кинетические уравнения простых и сложных реакций
- •26,6 Года
- •9.3. Влияние температуры на скорость химических реакций
- •Лекция 10 Кинетика ферментативных реакций План
- •10.1. Катализ и катализаторы.
- •10.2. Кинетика ферментативных реакций.
- •Лекция 11 Строение атома
- •11.1. Строение ядра. Изотопы
- •11.2. Квантово-механическая модель электронной оболочки атома
- •11.3. Физико-химические характеристики атомов
- •Лекция 12 Химическая связь
- •12.1. Химическая связь и ее типы
- •12.2. Ковалентная связь
- •12.2.1 Основные положения метода вс
- •Способы перекрывания ао
- •12.2.1 Основные положения метода мо.
- •Энергетическая диаграмма молекулы h2
- •Энергетическая диаграмма аниона h2-
- •Энергетическая диаграмма молекулы n2
- •12.3. Водородная связь
- •Водородных соединений от их молярной массы Примеры соединений с межмолекулярной водородной связью
- •1) Вода
- •Стабилизирующие (а) вторичную структуру белков,
- •Классификация лигандов по дентантности
- •Классификация комплексных соединений
- •1) По природе лигандов
- •2) По скорости образования комплексов:
- •Номенклатура комплексных соединений
- •13.2. Строение кс
- •Спектрохимический ряд лигандов
- •Увеличение энергии расщепления ∆
- •13.4. Биологическая роль кс
- •Лекция 14 Химия биогенных элементов план
- •14.1. Основы биогеохимии
- •6 Неметаллов-органогенов: c, o, h, n, p, s;
- •10 Биометаллов (металлов жизни): Na, k, Mg, Ca (s-элементы) и Fe, Co, Cu, Zn, Mn, Mo (d-элементы).
- •14.2. Химия s-элементов
- •14.3. Химия d-элементов
- •Радиусов d-элементов от их порядкового номера в периоде
- •14.4. Химия p-элементов
- •Лекция 15 Адсорбция на твердых адсорбентах План
- •15.1. Классификация твердых адсорбентов
- •Классификация твердых адсорбентов
- •15.2. Адсорбция на твердых адсорбентах
- •15.3 Адсорбционная терапия
- •15.4. Хроматография
- •Классификация хроматографических методов по доминирующему механизму
- •Лекция 16 Коллоидная химия План
- •Классификация дисперсных систем
- •Электролита AgNo3
- •Электролита кi
- •16.4. Физические свойства золей
- •16.5. Устойчивость коллоидных растворов. Коагуляция
- •Лекция 17 Растворы вмс план
- •Реакции полимеризации
- •Реакции поликонденсации
- •Классификация вмс
- •17.2. Набухание и растворение вмс
- •17.3. Полиэлектролиты
- •Полиамфолита
- •И других полиамфолитов
- •17.4. Коллоидная защита
- •Литература
- •Содержание
11.2. Квантово-механическая модель электронной оболочки атома
Протекание химических реакций сопровождается изменениями в электронной оболочке атома. Главным постулатом квантовой механики является постулат о невозможности точного определения местоположения электрона в атоме (принцип неопределенности Гейзенберга). Однако квантово-механический метод с большой точностью позволяет рассчитать вероятность пребывания электрона в околоядерном пространстве.
Атомная орбиталь (АО) — это область околоядерного пространства, в которой вероятность обнаружения электрона составляет не мене 90%. Атомные орбитали отличаются по форме, энергии и удаленности от ядра. Математическим описанием орбитали является волновая функция (ψ). Физический смысл волновой функции заключается в том, что произведение ψ2dV равно вероятности нахождения электрона в элементарном объеме dV. Радиальное распределение вероятности нахождения электрона в атоме имеет волновой характер (рис. 33).


(а) (б)
Рисунок 33. — Радиальное распределение электронной плотности (а) 1s и (б) 2s-электрона
Волновой характер радиального распределения вероятности нахождения электрона, а также наличие у него массы покоя отличной от нуля (относительная атомная масса электрона составляет 1/2000 от массы протона) дает основание считать электрон одновременно и частицей, и волной. Энергетическое состояние электрона в атоме описывается при помощи набора из четырех квантовых чисел.
Квантовые числа
1) Главное квантовое число (n) определят общий запас энергии орбитали и ее удаленность от ядра. Оно принимает целочисленные значения от нуля до бесконечности (n = 1,2,3,4...¥). Орбитали с одинаковым значением главного квантового числа образуют энергетический уровень или электронный слой. С увеличением n возрастает энергия орбиталей и их удаленность от ядра:

2) Орбитальное (побочное) квантовое число (ℓ) характеризует форму орбитали, а так же число подуровней на энергетическом уровне. Оно принимает целочисленные значения от нуля до (n - 1) (ℓ = 0, 1, 2, 3....(n – 1)). Орбитали с одинаковым значением n, но разными значениями ℓ образуют подуровни данного энергетического уровня:

Если n = 1, то ℓ = 0. Данное орбитальное число соответствует s-подуровню, на котором располагается s-орбиталь, имеющая сферическую симметрию:

Рисунок 34. — s-Орбиталь
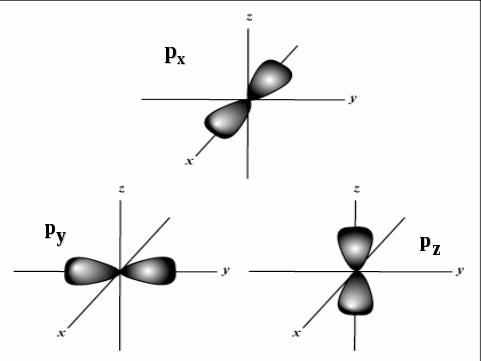
Если n = 2, то ℓ = 0 и 1. Орбитальное квантовое число равное единице (ℓ = 1) соответствует p - подуровню, на котором располагаются p-орбитали, имеющие форму объемной восьмерки:

Рисунок 35. — p-Орбиталь
Если n = 3, то ℓ = 0, 1, 2. Орбитальное квантовое число равное двум (ℓ = 2) соответствует d-подуровню, на котором располагаются d-орбитали:


Рисунок 36. — d-Орбитали
Если n = 4, то ℓ = 0, 1, 2, 3. Орбитальное квантовое число равное трем (ℓ=3) соответствует f-подуровню, на котором располагаются f-орбитали.
3) Магнитное квантовое число (mℓ) характеризует ориентацию орбитали в пространстве, а так же число орбиталей на подуровне. Оно принимает целочисленные значения от минус ℓ до плюс ℓ (mℓ = –ℓ...через 0...+ ℓ).
Для s-подуровня (ℓ = 0) магнитное квантовое число ms равно 0, следовательно на s-подуровне находится только одна s-орбиталь:

Д![]() ля
р-подуровня (ℓ = 1) магнитное число
принимает три значения:
mp
= –1, 0, +1, следовательно, на р-подуровне
находятся три орбитали, отличающиеся
друг от друга ориентацтей в пространстве:
ля
р-подуровня (ℓ = 1) магнитное число
принимает три значения:
mp
= –1, 0, +1, следовательно, на р-подуровне
находятся три орбитали, отличающиеся
друг от друга ориентацтей в пространстве:
Д![]() ляd-подуровня
(ℓ = 2) магнитное
число
принимает пять значений:
md
= -2, -1, 0, 1, 2, следовательно, на d-подуровне
находятся пять орбиталей:
ляd-подуровня
(ℓ = 2) магнитное
число
принимает пять значений:
md
= -2, -1, 0, 1, 2, следовательно, на d-подуровне
находятся пять орбиталей:
Для f-подуровня (ℓ = 3) магнитное число принимает семь значений: mf=-3,-2,-1, 0,1, 2, 3, следовательно, на f-подуровне находятся семь орбиталей:
![]()
Спиновое квантовое число (s) принимает только два значения:
s= ± 1/2. Оно характеризует вращение электрона вокруг собственной оси (по или против часовой стрелки):

Распределение электронов в многоэлектронном атоме
1. Принцип минимальной энергии: электрон занимает орбиталь с наименьшим запасом энергии.
2. Принцип Паули: в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Как следствие, на одной орбитали располагается не более двух электронов с антипараллельными спинами (рис. 37).

Рисунок 37. — Разрешенные варианты заполнения орбиталей электронами
3. Правило Хунда: электроны на подуровне располагаются так, чтобы их суммарный спин был максимальным (рис. 38).

Рисунок 38. — Разрешенные варианты заполнения электронами p-подуровня. Заполнение, соответствующее максимальной сумме спиновых чисел, считается энергетически наиболее выгодным.
4. Правила Клечковского: атомные орбитали заполняются электронами в порядке последовательного увеличения суммы (n+ℓ) (1-е правило). При одинаковых значениях этой суммы — в порядке последовательного увеличения главного квантового числа (2-е правило).
