
- •Предмет колоїдної хімії
- •Класифікація колоїдних систем
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища.
- •Контрольні питання:
- •Поверхневі явища та їх класифікація
- •Класифікація поверхневих явищ
- •Поверхневий натяг
- •Поверхневий натяг деяких речовин на межі з повітрям при 298к.
- •Методи визначення поверхневого натягу
- •Метод капілярного підняття (метод Жюрена).
- •Метод максимального тиску в бульбашці (метод Ребіндера)
- •Сталометричний метод (метод Траубе)
- •Внутрішня (повна) питома поверхнева енергія. Залежність енергетичних параметрів поверхні від температури
- •Принципи формування поверхневого шару
- •Поверхневий натяг органічних речовин на межі з повітрям при 298к.
- •Адгезія, когезія
- •Змочування і розтікання
- •Розтікання рідин. Ефект Марангоні
- •Контрольні питання:
- •Дисперсність і властивості тіл
- •Характеристика величини і форми поверхні
- •Зміна питомої поверхні при подрібненні речовини.
- •Вплив дисперсності на внутрішній тиск
- •Капілярні явища
- •Дисперсність і реакційна здатність речовин
- •Тиск насиченої пари над викривленою поверхнею
- •Вплив дисперсності на температуру фазового переходу
- •Залежність температури топлення калію і срібла від дисперсності.
- •Вплив дисперсності на розчинність твердих тіл
- •Вплив дисперсності на рівновагу хімічних реакцій
- •Контрольні питання:
- •Адсорбційні рівноваги.
- •Основні поняття та визначення.
- •Природа адсорбційних сил
- •Фундаментальне рівняння адсорбції Гіббса
- •Теплота адсорбції.
- •Швидкість фізичної адсорбції
- •Адсорбція газів на однорідній твердій поверхні.
- •Ізотерма адсорбції (закон) Генрі
- •Теорія адсорбції Ленгмюра
- •Теорія полімолекулярної адсорбції бет
- •Адсорбція газів на пористих тілах
- •Класифікація пористих тіл
- •Теорія капілярної конденсації
- •Теорія об’ємного заповнення мікропор
- •Адсорбція на межі тверде тіло – рідкий розчин.
- •Молекулярна адсорбція
- •Іонна адсорбція
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання.
- •Електричні явища на поверхні
- •Поняття про електрокінетичні явища
- •Механізм утворення подвійного електричного шару
- •Термодинамічні співвідношення між поверхневим натягом і електричним потенціалом
- •Теорії будови подвійного електричного шару.
- •Теорія Гельмгольца Перрена.
- •Теорія Гуї - Чепмена
- •Теорія Штерна.
- •Вплив електролітів на подвійний електричний шар.
- •Вплив індиферентних електролітів на подвійний електричний шар.
- •Вплив неіндиферентних (родинних) електролітів
- •Експериментальне визначення електрокінетичного потенціалу
- •Контрольні питання.
- •Методи одержання та очистки колоїдних систем
- •Диспергаційні методи
- •Конденсаційні методи
- •Термодинаміка утворення нової фази при конденсації.
- •Кінетика утворення нової фази
- •Будова міцел
- •Методи очистки колоїдних розчинів
- •Контрольні питання.
- •Агрегативна стійкість дисперсних систем.
- •Фактори агрегативної стійкості ліофобних дисперсних систем.
- •Ізотермічна перегонка в дисперсних системах.
- •Коагуляція.
- •Теорія стійкості дисперсних систем Дєрягіна, Ландау Фервея і Овербека
- •Кінетика коагуляції
- •Контрольні питання
- •Властивості дисперсних систем
- •Молекулярно – кінетичні властивості дисперсних систем
- •Броунівський рух
- •Дифузія.
- •Седиментація та седиментаційна стійкість.
- •Седиментаційний аналіз дисперсності.
- •Оптичні властивості дисперсних систем.
- •Розсіювання світла.
- •Абсорбція світла.
- •Оптичні методи дослідження дисперсних систем.
- •Структурно-механічні властивості дисперсних систем.
- •Реологічних моделі тіл.
- •Розчини поверхнево – активних речовин.
- •Класифікація пар.
- •Міцели пар.
- •Розчини високомолекулярних сполук
- •Утворення і властивості вмс
- •Взаємодія вмс з розчинниками.
- •Молекулярна маса вмс
- •ГрубоДисперсні системи.
- •Суспензії
- •Емульсії.
- •Класифікація та властивості емульсій.
- •Одержання та руйнування емульсій.
- •Основні характеристики та властивості пін.
- •Одержання та руйнування пін.
- •Аерозолі
- •Класифікація та властивості аерозолів
- •Методи одержання та практичне значення аерозолів
- •Порошки
- •Список літератури
Вплив електролітів на подвійний електричний шар.
Вплив індиферентних електролітів на подвійний електричний шар.
Під індиферентними розуміють електроліти, що не містять іонів, які здатні добудовувати кристалічну ґратку поверхні. По мірі збільшення концентрації електроліту товщина подвійного електричного шару буде зменшуватися. В результаті – потенціал зменшується, поки не стане рівним нулю, що відповідає ізоелектричному стану системи. При додаванні до системи індиферентних електролітів розрізняють два випадки:
У першому випадку в систему вводиться електроліт один з іонів якого співпадає з протиіонами. Наприклад тверді частинки AgIзнаходяться в розчиніAgNO3, на твердій поверхні адсорбовані іониAg+шар протиіонів складаютьNO3-. При додаванні до цієї системиKNO3 в системі збільшиться концентрація іонівNO3-в наслідок чого товщина дифузійного шару зменшиться.
В другому випадку в систему додається електроліт, що не містить іонів, присутніх в розчині. В цьому випадку можливий обмін протиіонів ПЕШ на еквівалентну кількість іонів того самого знаку. Цей обмін описується правилом іонного обміну Нікольского:
g1/g2 = k(с1/с2), де ( 5.0)
g1, g2 - кількість 1 і 2 іонів в подвійному електричному шарі;
с1, с2 - концентрація 1і 2 іонів в розчині.
![]() ,
де (
5.0)
,
де (
5.0)
- адсорбційні потенціали 1 і 2 іонів.
Якщо іони мають різну валентність, то рівновага при адсорбції буде зміщена в бік іона, що має більшу валентність.
Додавання електролітів, що містять багатовалентні неродинні іони може навіть змінювати знак заряду на межі ковзання. Це явище називається перезарядкою. При цьому потенціал поверхні твердої частинки залишається незмінним.
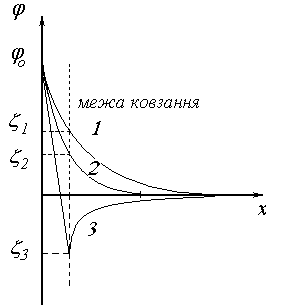
Рис. 44. Зміна потенціалу ПЕШ при перезарядці поверхні ковзання
Схема перезарядки поверхні наведена на рис.44.
Вплив неіндиферентних (родинних) електролітів
При додаванні до системи електролітів, що містять родинні іони (іони, що здатні добудовувати кристалічну ґратку) також можливі два варіанти:
В першому випадку електроліт, що вводиться в розчин містить потенціалвизначальний іон. При малих концентраціях іонів на твердій поверхні можлива додаткова адсорбція, в результаті якої потенціал поверхні і - потенціал зростають. Подальше збільшення концентрації не впливає на значення величини потенціалу поверхні і зменшує- потенціал, тобто електроліт починає поводити себе як індиферентний.
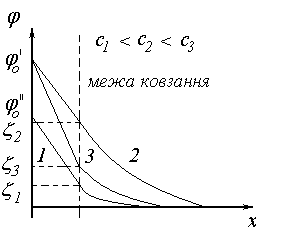
Рис. 45. Схема впливу родинного електроліту на ПЕШ.
Наприклад тверді частинки AgIзнаходяться в розчиніAgNO3, на твердій поверхні адсорбовані іониAg+шар протиіонів складаютьNO3- (рис.45, лінія 1). При збільшенні в розчині концентраціїAgNO3іониAg+спочатку адсорбуються на поверхні збільшуючи її потенціал (лінія 2), а коли всі вільні місця на поверхні вже буде зайнято електроліт поводить себе як індиферентний, стискаючи дифузійний шар (лінія 3).
В другому випадку електроліт, що додається містить родинний іон за знаком протилежний до знаку потенціалвизначального іону. При цьому відбувається хімічне зв’язування потенціал визначальних іонів родинними іонами, що вводяться в розчин, з утворенням твердої фази. Заряд поверхні зменшується і при досягненні достатньої кількості електроліту відбувається зміна потенціал визначальних іонів, що приводить до перезарядки поверхні. При цьому змінюється знак заряду поверхні і -потенціалу.
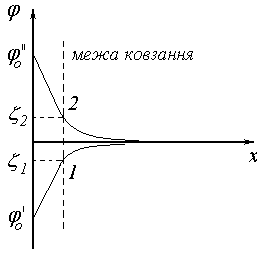
Рис. 46. Схема перезарядки поверхні твердої частинки.
Наприклад тверді частинки AgIзнаходяться в розчиніKI, на твердій поверхні адсорбовані іониI-шар протиіонів складаютьK+(рис.46, лінія 1). При додаванні до вихідної системи надлишкуAgNO3 потенціалвизначальними стануть іониAg+, а протиіонамиNO3-.При цьому поміняється не тільки знак– потенціалу, але і знак заряду поверхні (лінія 2).
