
- •Глава 1. Основні поняття та закони хімії
- •1.1. Основні поняття хімії
- •1.2. Фундаментальні та стехіометричні закони хімії
- •1.2.1. Закон збереження маси речовини
- •1.2.2. Закон сталості складу речовин
- •1.2.3. Закон кратних відношень
- •1.2.4. Закон еквівалентів.
- •1.3. Закони газового стану
- •1.3.1. Закон об’ємних відношень гей-люсака
- •1.3.2. Закон авогадро
- •1.3.3. Закон бойля – маріотта
- •Контрольні завдання
- •Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
- •В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
- •Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
- •Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
- •Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
- •Зі співвідношення (1.8) знаходимо еквівалентну масу h3ро4:
- •Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг к), а хлорид цього металу містить 61,2% металу.
- •Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: с – 82,76%, н – 17,24%.
- •Глава 2. Класи неорганічних сполук
- •2.1. Оксиди.
- •2.1.1. Способи одержання оксидів
- •2.1.2. Класифікація та хімічні властивості оксидів
- •2.2. Гідроксиди металів
- •2.2.1. Способи одержання гідроксидів
- •2.2.2. Хімічні властивості гідроксидів металів
- •2.3. Кислоти
- •2.3.1. Способи одержання кислот
- •2.3.2. Хімічні властивості кислот
- •2.4.1.Основні способи одержання солей
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •3.2. Корпускулярно-хвильова природа електрона
- •3.3. Принцип невизначеності
- •3.4. Періодичний закон
- •3.5. Періодична система елементів
- •3.6. Електронні хмари
- •3.7. Квантові числа
- •3.8. Принцип паулі
- •3.9. Послідовність заповнення електронами енерґетичних рівнів у багатоелектронних атомах
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •Приклад 8. Які найвищий та найнижчий ступені окислення у фосфору, сульфуру та хлору? Скласти формули сполук даних елементів, що відповідають цим ступеням окислення.
- •Приклад 12. Як залежать кислотно-основні властивості оксидів і гідроксидів від ступеня окиснення атомів елементів, що їх утворюють?
- •Приклад 13. Відомо, що кремній є неметалом з напівпровідниковими властивостями. Які властивості будуть виявляти алюміній і фосфор?
- •Приклад 15. Як змінюються властивості вищих оксидів елементів третього періоду?
- •4.1.1. Характерні властивості ковалентного зв’язку
- •4.1.1.1. Насиченість ковалентного зв’язку
- •Мал. 4.3. Різновиди σ-зв’язків.
- •Мал. 4.3. Різновиди π-зв’язків.
- •4.1.1.3. Полярність і поляризованість ковалентного зв’язку.
- •4.3. Водневий зв’язок
- •4.5. Міжчастинкові взаємодії
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач Приклад 1. Довжина диполя молекули дорівнює 2,2 10-11 м. Обчисліть дипольний момент молекули.
- •Приклад 2. Обчислити довжину зв’язку в молекулі hBr, якщо між’я-дерні відстані у молекулах h2 та Br2 відповідно дорівнюють 7,4 · 10-11 м та 2,28 10-10 м.
- •Приклад 3. Яка гібридизація електронних хмар має місце в атомі карбону при утворенні молекули cf4? Якою є просторова конфігурація цієї молекули?
- •Приклад 4. Якими є валентні можливості атома фосфору в основному та збудженому станах?
- •Приклад 5. Визначте, що є донором електронної пари при утворенні йона bh4-.
- •Глава 5. Основи хімічної термодинаміки
- •5.2. Перший закон термодинаміки
- •5.3. Закони термохімії
- •5.4. Поняття про ентропію
- •5.5. Другий закон термодинаміки
- •5.6.Третій закон термодинаміки
- •5.7. Вільна енергія Ґіббса
- •Приклад 1. Складіть термохімічне рівняння реакції горіння 1 моль ацетилену, якщо при цьому виділяється 1255,61 кДж теплоти.
- •Приклад 3. Не здійснюючи обчислень, поясніть, як змінюється ентропія системи (s): а) при переході води в пару; б) у реакції:
- •Приклад 4. Обчисліть зміну енерґії Ґіббса у хімічній реакції
- •І зробіть висновки про можливість мимовільного перебігу даної реакції за стандартних умов.
- •Стандартні зміни енерґій Ґіббса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •6.1. Поняття про швидкість хімічної реакції
- •6.2. Основний закон хімічної кінетики – закон діючих мас.
- •Межі застосування закону діючих мас.
- •6.3. Молекулярність реакції.
- •6.4. Порядок реакції.
- •6.5. Особливості кінетики гетероґенних реакцій.
- •6.6. Механізм хімічних реакцій.
- •6.7. Вплив температури на швидкість реакції. Правило Вант-Гоффа.
- •6.8. Рівняння Арреніуса. Енерґія активації
- •Вихідні Активов. Продукти
- •Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
- •Глава 7. Хімічна рівновага.
- •7.1. Константа хімічної рівноваги
- •7.2. Зсув хімічної рівноваги. Принцип Ле-Шательє
- •7.3. Рівновага у гетероґенних системах
- •Константа рівноваги.
- •Глава 8. Поняття про каталіз.
- •8.1. Автокаталіз
- •8.2.Промотори та каталітичні отрути
- •8.3. Селективність каталізаторів
- •8.4. Механізми гомоґенного та гетероґенного каталізу
- •Підставляючи дані нашої задачі, одержуємо:
- •Глава 9. Розчини
- •9.1. Процес розчинення. Типи розчинів
- •9.2. Способи виразу концентрації речовин
- •9.3. Хімічна (гідратна) теорія розчинів д.І. Менделєєва
- •9.4. Теплові ефекти розчинення
- •9.5. Розчинність
- •Глава 10. Властивості розчинів
- •10.1. Тиск пари розчинника над розчином
- •10.2. Температури замерзання та кипіння розчинів
- •10.3. Осмотичний тиск
- •Глава 11. Електролітична дисоціація.
- •11.1. Основні положення теорії електролітичної дисоціації
- •11.2. Ступінь дисоціації
- •11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
- •11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
- •11.5. Розчини сильних електролітів
- •11.6. Електролітична дисоціація води. Йонний добуток води. Водневий показник
- •11.7. Поняття про індикатори
- •11.8. Іонні реакції
- •11.8. Гідроліз солей
- •Типові випадки гідролізу.
- •11.8.1. Ступінь і константа гідролізу
- •Глава 12. Комплексні сполуки
- •12.1. Основні положення координаційної теорії а.Вернера
- •12.2. Класифікація комплексних сполук
- •12.3. Номенклатура комплексних сполук
- •12.3.1. Назви катіонних комплексних сполук
- •12.3.2. Назви аніонних комплексних сполук
- •12.3.3. Назви нейтральних комплексних сполук
- •12.4. Ізомерія комплексних сполук
- •12.5. Дисоціація комплексних сполук
- •Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішньоорбітальним. Іноді у комплексах проявляється йонно-дипольний зв’язок, наприклад в аквакомплексах.
- •Глава 13. Електрохімічні процеси
- •13.1. Хімічні процеси на електродах
- •13.2. Електродний потенціал
- •13.3. Електрохімічний ряд напруг металів
- •13.4. Гальванічний елемент
- •13.5. Окисні й відновні потенціали
- •13.6. Рівняння Нернста
- •13.7. Акумулятори
- •13.8. Паливні елементи
- •13.9. Електроліз
- •13.9.1. Закони Фарадея
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •13.10. Корозія металів
- •0,01 Моль/л 0,1 моль/л
- •Глава 14. Окисно-відновні реакції складання рівнянь окисно-відновних реакцій
- •Контрольні завдання
- •Додатки
- •Додаток 6 – Перехідні коефіцієнти
- •Предметний покажчик
- •Відновлення 18-19, 77, 81, 124, 126, 128, 135-139
- •Водень 14, 17, 37, 75, 125, 130-132, 139
- •Ізомерія 119
- •Лантаноїди 25
- •Натрій 20-21, 69, 89
- •Термодинамічні 8, 54
- •Атомів 33, 50
- •Список рекомендованої літератури
- •Глава 1. Основні поняття та закони хімії ........................ 5
Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
V = Vm · ν = 22,4 · 0,025 = 0,56 л.
В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
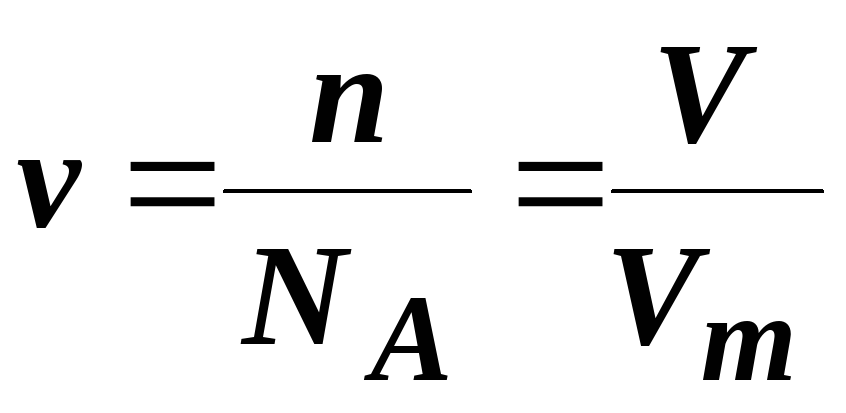 ,
звідки
,
звідки
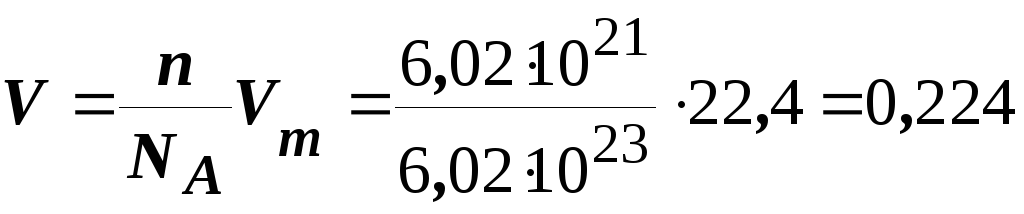 л.
л.
Приклад 2. Густина газу за повітрям дорівнює 1,17. Визначити молекулярну масу і його густину за воднем.
Розв’язання. Із закону Авогадро випливає, що відносна густина (D) одного газу за іншим дорівнює відношенню молярних мас цих газів, тобто D = =М1/М2, отже Dпов.(газу) = Мгазу/Мпов. = 1,17. Середня молярна маса повітря дорівнює 29,0 г/моль. Тоді Мгазу = 1,17 29,0 = 33,9 г/моль, що відповідає відносній молекулярній масі, рівній 33,9 а.о.м. Для визначення густини газу за воднем необхідно відносну молекулярну масу газу поділити на відносну молекулярну масу водню, що дорівнює 2 а.о.м. DН2(газу) = Мгазу : 2 = 33,9 : 2 = 16,95.
Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
Розв’язання.
Для приведення об’єму газу до нормальних
умов користуються загальною формулою,
що поєднує закони Бойля – Маріотта та
Гей-Люсака: (pV)/T
= (p0V0)/T0,
звідки V0
= (pVT0)/(p0T),
де T0
=
273 К; p0
=
101325 Па; Т
= 273 + 50 = 323 К.

Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
Розв’язання. З умови задачі випливає, що в оксиді металу на 5 г металу припадає 9,44 – 5 = 4,44 г кисню. Відповідно до закону еквівалентів, маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
m1/m2 = E1/E2 (1.1)
Для умови нашої задачі цей закон виглядає наступним чином:
m(Me)/m(O2) = E(Me)/E(O2) (1.2)
Еквівалентну масу кисню визначають зі співвідношення Е = А/w, де А – маса моля атомів елемента, а w – валентність елемента, звідси Е(O2) = 16/2 = 8 г/моль. Підставивши знайдені значення в (1.2), одержимо 5/4,44 = Е(Ме)/8. Звідки Е(Ме) = (5 8) : 4,44 = 9,01 г/моль.
Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
Розв’язання. У даній задачі одна з реагуючих речовин знаходиться в газоподібному стані, а інша – у твердому. У цьому випадку закон еквівалентів записують у такий спосіб: V/Veq = m/E, де Veq – еквівалентний об’єм газоподібної речовини. Для умови нашої задачі закон виражається у такий спосіб:
V(Н2)/Veq(Н2) = m(Ме)/E(Ме) (1.3)
Еквівалентним об’ємом називають об’єм газоподібної речовини, що займає за даних умов один еквівалент цієї речовини. Молярний об’єм будь-якого газу за нормальних умов дорівнює 22,4 л. Звідси еквівалентний об’єм водню (молекула якого двоатомна) Veq(Н2) = 22,4 : 2 = 11,2 л. Підставляючи дані задачі в (1.3) одержимо 1,4 : 11,2 = m(Ме) : 28, звідки m(Ме)=(1,4 · 28) : 11,2 = 3,5 г.
Приклад 6. Обчислити еквівалентні маси H2SО4 і Аl(ОH)3 у реакціях, виражених рівняннями: Н2SО4 + КОН = КHSО4 + H2О (1.4)
H2SО4 + 2КОН = К2SО4 + 2H2О (1.5)
Аl(ОH)3 + НСl = Аl(ОH)2Сl + H2О (1.6)
Аl(ОH)3 + 3НNO3 = Аl(NО3)3 + 3H2О (1.7)
Розв’язання. Еквівалентна маса складної речовини, як і еквівалентна маса елемента, може мати різні значення і залежить від того, у яку реакцію вступає ця речовина. Еквівалентна маса кислоти дорівнює молярній масі, розділеній на число катіонів водню, заміщених у даній реакції на інші катіони, тобто на основність кислоти: Е(к-ти) = М(к-ти)/n, де n – основність кислоти в даній реакції. Отже, еквівалентна маса H2SО4 у реакції (1.4) дорівнює М(H2SО4)/1 = 98 г/моль, а в реакції (1.5) М(H2SО4)/2 = 49 г/моль. Еквівалентна маса основи дорівнює молярній масі, розділеній на число гідроксид-аніонів, заміщених у даній реакції на інші аніони, тобто, на кислотність основи. Отже, еквівалентна маса Аl(ОH)3 у реакції (1.6) дорівнює М(Аl(ОH)3)/1 = 78 г/моль, а в реакції (1.7) М(Аl(ОH)3)/3 = 26 г/моль.
Приклад 7. На нейтралізацію 4,9 г ортофосфорної кислоти витрачено 4 г гідроксиду натрію. Обчислити еквівалентну масу й основність кислоти в даній реакції. Написати рівняння цієї реакції.
