
- •Глава 1. Основні поняття та закони хімії
- •1.1. Основні поняття хімії
- •1.2. Фундаментальні та стехіометричні закони хімії
- •1.2.1. Закон збереження маси речовини
- •1.2.2. Закон сталості складу речовин
- •1.2.3. Закон кратних відношень
- •1.2.4. Закон еквівалентів.
- •1.3. Закони газового стану
- •1.3.1. Закон об’ємних відношень гей-люсака
- •1.3.2. Закон авогадро
- •1.3.3. Закон бойля – маріотта
- •Контрольні завдання
- •Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
- •В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
- •Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
- •Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
- •Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
- •Зі співвідношення (1.8) знаходимо еквівалентну масу h3ро4:
- •Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг к), а хлорид цього металу містить 61,2% металу.
- •Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: с – 82,76%, н – 17,24%.
- •Глава 2. Класи неорганічних сполук
- •2.1. Оксиди.
- •2.1.1. Способи одержання оксидів
- •2.1.2. Класифікація та хімічні властивості оксидів
- •2.2. Гідроксиди металів
- •2.2.1. Способи одержання гідроксидів
- •2.2.2. Хімічні властивості гідроксидів металів
- •2.3. Кислоти
- •2.3.1. Способи одержання кислот
- •2.3.2. Хімічні властивості кислот
- •2.4.1.Основні способи одержання солей
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •3.2. Корпускулярно-хвильова природа електрона
- •3.3. Принцип невизначеності
- •3.4. Періодичний закон
- •3.5. Періодична система елементів
- •3.6. Електронні хмари
- •3.7. Квантові числа
- •3.8. Принцип паулі
- •3.9. Послідовність заповнення електронами енерґетичних рівнів у багатоелектронних атомах
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •Приклад 8. Які найвищий та найнижчий ступені окислення у фосфору, сульфуру та хлору? Скласти формули сполук даних елементів, що відповідають цим ступеням окислення.
- •Приклад 12. Як залежать кислотно-основні властивості оксидів і гідроксидів від ступеня окиснення атомів елементів, що їх утворюють?
- •Приклад 13. Відомо, що кремній є неметалом з напівпровідниковими властивостями. Які властивості будуть виявляти алюміній і фосфор?
- •Приклад 15. Як змінюються властивості вищих оксидів елементів третього періоду?
- •4.1.1. Характерні властивості ковалентного зв’язку
- •4.1.1.1. Насиченість ковалентного зв’язку
- •Мал. 4.3. Різновиди σ-зв’язків.
- •Мал. 4.3. Різновиди π-зв’язків.
- •4.1.1.3. Полярність і поляризованість ковалентного зв’язку.
- •4.3. Водневий зв’язок
- •4.5. Міжчастинкові взаємодії
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач Приклад 1. Довжина диполя молекули дорівнює 2,2 10-11 м. Обчисліть дипольний момент молекули.
- •Приклад 2. Обчислити довжину зв’язку в молекулі hBr, якщо між’я-дерні відстані у молекулах h2 та Br2 відповідно дорівнюють 7,4 · 10-11 м та 2,28 10-10 м.
- •Приклад 3. Яка гібридизація електронних хмар має місце в атомі карбону при утворенні молекули cf4? Якою є просторова конфігурація цієї молекули?
- •Приклад 4. Якими є валентні можливості атома фосфору в основному та збудженому станах?
- •Приклад 5. Визначте, що є донором електронної пари при утворенні йона bh4-.
- •Глава 5. Основи хімічної термодинаміки
- •5.2. Перший закон термодинаміки
- •5.3. Закони термохімії
- •5.4. Поняття про ентропію
- •5.5. Другий закон термодинаміки
- •5.6.Третій закон термодинаміки
- •5.7. Вільна енергія Ґіббса
- •Приклад 1. Складіть термохімічне рівняння реакції горіння 1 моль ацетилену, якщо при цьому виділяється 1255,61 кДж теплоти.
- •Приклад 3. Не здійснюючи обчислень, поясніть, як змінюється ентропія системи (s): а) при переході води в пару; б) у реакції:
- •Приклад 4. Обчисліть зміну енерґії Ґіббса у хімічній реакції
- •І зробіть висновки про можливість мимовільного перебігу даної реакції за стандартних умов.
- •Стандартні зміни енерґій Ґіббса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •6.1. Поняття про швидкість хімічної реакції
- •6.2. Основний закон хімічної кінетики – закон діючих мас.
- •Межі застосування закону діючих мас.
- •6.3. Молекулярність реакції.
- •6.4. Порядок реакції.
- •6.5. Особливості кінетики гетероґенних реакцій.
- •6.6. Механізм хімічних реакцій.
- •6.7. Вплив температури на швидкість реакції. Правило Вант-Гоффа.
- •6.8. Рівняння Арреніуса. Енерґія активації
- •Вихідні Активов. Продукти
- •Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
- •Глава 7. Хімічна рівновага.
- •7.1. Константа хімічної рівноваги
- •7.2. Зсув хімічної рівноваги. Принцип Ле-Шательє
- •7.3. Рівновага у гетероґенних системах
- •Константа рівноваги.
- •Глава 8. Поняття про каталіз.
- •8.1. Автокаталіз
- •8.2.Промотори та каталітичні отрути
- •8.3. Селективність каталізаторів
- •8.4. Механізми гомоґенного та гетероґенного каталізу
- •Підставляючи дані нашої задачі, одержуємо:
- •Глава 9. Розчини
- •9.1. Процес розчинення. Типи розчинів
- •9.2. Способи виразу концентрації речовин
- •9.3. Хімічна (гідратна) теорія розчинів д.І. Менделєєва
- •9.4. Теплові ефекти розчинення
- •9.5. Розчинність
- •Глава 10. Властивості розчинів
- •10.1. Тиск пари розчинника над розчином
- •10.2. Температури замерзання та кипіння розчинів
- •10.3. Осмотичний тиск
- •Глава 11. Електролітична дисоціація.
- •11.1. Основні положення теорії електролітичної дисоціації
- •11.2. Ступінь дисоціації
- •11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
- •11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
- •11.5. Розчини сильних електролітів
- •11.6. Електролітична дисоціація води. Йонний добуток води. Водневий показник
- •11.7. Поняття про індикатори
- •11.8. Іонні реакції
- •11.8. Гідроліз солей
- •Типові випадки гідролізу.
- •11.8.1. Ступінь і константа гідролізу
- •Глава 12. Комплексні сполуки
- •12.1. Основні положення координаційної теорії а.Вернера
- •12.2. Класифікація комплексних сполук
- •12.3. Номенклатура комплексних сполук
- •12.3.1. Назви катіонних комплексних сполук
- •12.3.2. Назви аніонних комплексних сполук
- •12.3.3. Назви нейтральних комплексних сполук
- •12.4. Ізомерія комплексних сполук
- •12.5. Дисоціація комплексних сполук
- •Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішньоорбітальним. Іноді у комплексах проявляється йонно-дипольний зв’язок, наприклад в аквакомплексах.
- •Глава 13. Електрохімічні процеси
- •13.1. Хімічні процеси на електродах
- •13.2. Електродний потенціал
- •13.3. Електрохімічний ряд напруг металів
- •13.4. Гальванічний елемент
- •13.5. Окисні й відновні потенціали
- •13.6. Рівняння Нернста
- •13.7. Акумулятори
- •13.8. Паливні елементи
- •13.9. Електроліз
- •13.9.1. Закони Фарадея
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •13.10. Корозія металів
- •0,01 Моль/л 0,1 моль/л
- •Глава 14. Окисно-відновні реакції складання рівнянь окисно-відновних реакцій
- •Контрольні завдання
- •Додатки
- •Додаток 6 – Перехідні коефіцієнти
- •Предметний покажчик
- •Відновлення 18-19, 77, 81, 124, 126, 128, 135-139
- •Водень 14, 17, 37, 75, 125, 130-132, 139
- •Ізомерія 119
- •Лантаноїди 25
- •Натрій 20-21, 69, 89
- •Термодинамічні 8, 54
- •Атомів 33, 50
- •Список рекомендованої літератури
- •Глава 1. Основні поняття та закони хімії ........................ 5
6.5. Особливості кінетики гетероґенних реакцій.
Гетероґенні реакції йдуть на поверхні поділу фаз, яка й слугує реакційним простором (поверхнею). Тому першою особливістю кінетики цих реакцій є вплив площі реакційної поверхні на швидкість реакції. Якщо сумарна площа поверхні дорівнює S, то загальна швидкість гетероґенної реакції першого порядку описується рівнянням:
v = kСS, (6.5.)
де C – концентрація реаґента (газоподібного чи рідкого).
Одиниці вимірювання швидкості та константи швидкості гетероґенної реакції відрізняються від одиниць вимірювання відповідних величин гомоґенної реакції. Одиниця вимірювання швидкості гетероґенної реакції – [моль · с-1], константи швидкості реакції першого порядку – [моль · с-1]. Якщо у реакції безпосередньо бере участь тверда речовина (або інша рідка фаза), то у кінетичне рівняння не входить його концентрація оскільки вона є сталою. Роль твердого тіла у кінетиці відображують шляхом введення у кінетичне рівняння площі поверхні цього тіла, на якій іде реакція. Наприклад, кінетика гетероґенної реакції:
СаО(к) + СО2(г) → СаСО3(к) описується рівнянням v = k С(СО2)S.
Іноді важливо знати питому швидкість реакції віднесену до одиниці площі реакційної поверхні, яка для реакції першого порядку описується рівнянням: v = v/S = kС. В одиницю вимірювання питомої швидкості реакції входять одиниця вимірювання площі, наприклад [моль · м-2 · с-1].
Швидкість деяких гетероґенних реакцій не залежить від концентрації реаґентів у розчині, але в ході реакції зменшується їх концентрація у зоні реакції СS у порівнянні з їх концентрацією в об’ємі CV з-за витрати реаґентів. Тому у рівняння швидкості реакції входить концентрація реаґента реакції СS :
v = k СS S або vS = kCS .
Тому швидкість гетероґенної хімічної реакції залежить від швидкості підведення реаґентів у зону хімічної реакції, що є другою особливістю цих реакцій.
6.6. Механізм хімічних реакцій.
Знання кінетичних рівнянь та їхніх констант дуже корисне для розуміння механізму хімічних реакцій, тобто послідовностей перебігу найпростіших (елементарних) стадій утворення короткоживучих проміжних частинок (інтермедіатів) реакції. Визначення механізмів хімічних реакцій є найважливішим фундаментальним завданням хімії.
Усі реакції можна поділити на прості та складні. Прості реакції перебігають в одну стадію та називаються одностадійними. Складні реакції йдуть або послідовно (багатостадійні реакції), або паралельно, або послідовно паралельно. У свою чергу, у кожній стадії реакції може брати участь одна молекула, дві молекули чи три молекули.
Одностадійні реакції. Відносно невелике число реакцій перебігає в одну стадію. До одно стадійних реакцій відносяться, наприклад,
- реакції дисоціації: Н2 → 2Н; Cl2 → 2Cl; 2HI → H2 + I2;
взаємодія йоду та водню: H2 + I2 → 2НІ;
взаємодія нітроґен монооксиду з воднем та озоном:
2NO + H2 → N2O + H2O; NO + O3 → NO2 + O2.
Одностадійні реакції, як і складні, перебігають через утворення активованого комплексу.
Складні реакції. До складних відносяться реакції, що перебігають послідовно (через кілька стадій) або паралельно. Більшість реакцій є багатостадійними.
Послідовні реакції – пов’язана система реакцій, у яких продукт попередніх стадій витрачається у наступних. Наприклад реакція:
2N2O5 → 4NO2 + O2
перебігає через наступні стадії:
N2O5 ↔ NO2 + NO3 (швидка реакція);
NO2 + NO3 → NO2 + NO + O2 (повільна реакція);
NO + NO3 → 2NO2 (швидка реакція).
Швидкість лімітуючої реакції (друга стадія) визначає швидкість усієї складної реакції, що розглядається. Швидкість даної реакції дорівнює:
v = k С(N2O5).
Паралельні реакції – пов’язана система реакцій, що мають одні й ті ж вихідні реаґенти, але відмінні продукти реакції. Наприклад реакція розкладу KClO3 може йти двома паралельними шляхами:
4KClO3
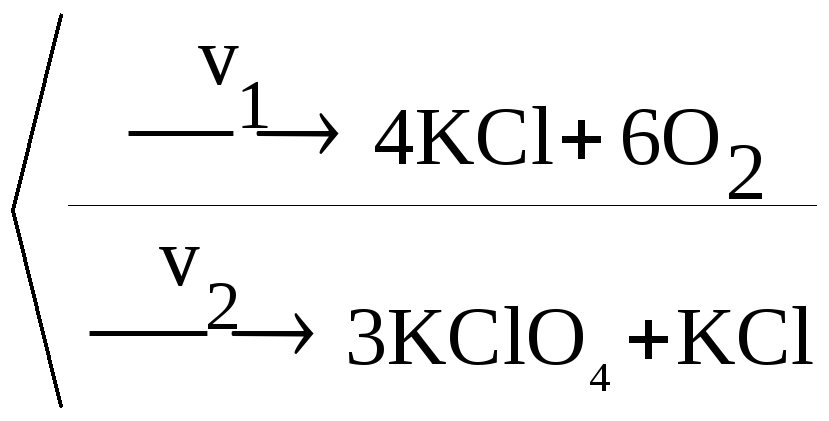 .
.
Кожна з реакцій мономолекулярна (в одиничному акті розкладу бере участь одна формульна одиниця KClO3). Таким чином v1 = k1С(KClO3),
v2 = k2С(KClO3). Сумарна ж швидкість процесу v становитиме:
v = v1 + v2 = (k1 + k2)С(KClO3).
Спряжені реакції. Якщо з одним і тим же реаґентом одночасно взаємодіє дві чи більше речовин, то такі реакції називаються спряженими, наприклад: А + В → АВ; A + D → AD.
У деяких випадках спряження реакцій може викликати їх прискорення. Прискорення може бути спричинене утворенням інтермедіатів у перебігу однієї з реакцій, які прискорюють іншу реакцію. Наприклад:
6FeO + 2H2CrO4 → 3Fe2O3 + Cr2O3 + 2H2O;
6HI + 2H2CrO4 → 3I2 + Cr2O3 + 5H2O.
НІ безпосередньо не взаємодіє з H2CrO4.
Спряження реакцій може впливати на термодинаміку процесів. Наприклад, якщо для реакцій: А + В → АВ; ∆G1 > 0; A + D → AD; ∆G2 < 0;
|∆G2| буде більше |∆G1|, то у цих умовах стає можливим перебіг першої реакції, оскільки енерґія Ґіббса сумарної реакції буде менше нуля:
2А + В + D → АВ + AD; ∆GΣ < 0.
Багато біохімічних реакцій, особливо у живих орґанізмах перебігають за механізмом спряжених хімічних реакцій.
Ланцюгові реакції – пов’язана система складних реакцій, що перебігають послідовно, паралельно та спряжено з участю вільних радикалів. Швидкість їх залежить від природи та об’єму посудини, для деяких із них характерний поріг тиску, нижче якого реакція не відбувається. За певних умов реакція прискорюється лавиноподібно. Вперше ідею про можливість ланцюгового механізму висловив російський вчений М.О.Шилов у 1905 році. Великий внесок у розробку теорії ланцюгових реакцій внесли М.М.Семенов (Росія) та С.Гіншельвуд (Велика Британія).
Ланцюгові реакції починаються зі стадії ініціювання, тобто утворення активних частинок – вільних радикалів. Вільні радикали являють собою уламки молекул, що мають неспарені електрони. Деякі вільні радикали є стабільними речовинами за звичайних умов, наприклад ·ClO2, Ph3C·, тощо (вільним бірадикалом є навіть молекула кисню), інші – при підвищених температурах, наприклад, атоми галоґенів, лужних металів, треті – не існують у вигляді вільних частинок, наприклад, ·ОН ·СН3. Вільні радикали прийнято позначати крапкою поставленою поруч із хімічним символом, наприклад Cl·, O·, HO·, HS·.
Стадії, через які проходять ланцюгові реакції є наступними: зародження (ініціювання) ланцюга, ріст (розвиток) ланцюга, обрив ланцюга. Внаслідок утворення активних частинок – вільних радикалів, ланцюгові реакції перебігають швидше реакцій, що йдуть за звичайними механізмами. Утворення вільних радикалів (ініціювання) відбувається у підсумку впливу на систему світла, більш жорсткого електромагнітного випромінювання, тепла, тощо. Наприклад ланцюгова реакція взаємодії хлору та водню може починатися внаслідок дії світла на молекули хлору:
Cl2 –hν→ 2Cl· – зародження ланцюга;
Cl· + H2 → HCl + H·; H· + Cl2 → HCl + Cl· – зростання ланцюга;
H· + Cl· → HCl; Cl· + Cl· → Cl2; H· + H· → H2; – обрив ланцюга
Якщо у перебігу ланцюгової реакції замість одного народжується два чи більше радикалів, то число радикалів росте швидше внаслідок розгалуження ланцюга і, коли реакція набуває найбільшого прискорення, відбувається вибух.
До ланцюгових реакцій належить і горіння палива, тобто реакція з киснем, що перебігає з виділенням теплоти та світловим випромінюванням. У двигунах внутрішнього згоряння ланцюговий характер реакції горіння може викликати мікровибухи (детонацію), для їхнього попередження до пального додають антидетонатори, на яких відбувається обрив ланцюгів.
За певних умов горіння водню та інших видів палива також може призвести до вибуху. За ланцюговим механізмом перебігають багато реакцій полімеризації, реакцій окиснення, галоґенування, високотемпературного розкладу вуглеводнів, тощо.
