
- •Міністерство освіти і науки україни
- •Херсон 2010
- •Рецензент: д.Т.Н., професор, зав. Кафедрою охВіПбм Херсонського національного технічного університету Луняка к.В.
- •Запам’ятайте!
- •Рекомендована література
- •Завдання для самоконтролю до теми "Класи неорганічних сполук"
- •Завдання для самоконтролю до теми "Основні закони хімії"
- •Завдання для самоконтролю до теми "Будова атома. Хімічний зв’язок "
- •Модуль 2. Закономірності перебігу хімічних процесів
- •Визначення теплового ефекту реакції
- •Хід роботи
- •Завдання для самоконтролю до теми "Хімічна термодинаміка"
- •Лабораторна робота № 2
- •Завдання для самоконтролю до теми "Швидкість хімічних реакцій. Хімічна рівновага"
- •Модуль 3. Розчини
- •Лабораторна робота № 3
- •Завдання для самоконтролю до теми "Розчини"
- •Модуль 4. Окисно-відновні реакції та електрохімічні процеси
- •Лабораторна робота № 4 Окисно-відновні реакції
- •Завдання для самоконтролю до теми "Окисно-відновні реакції"
- •Лабораторна робота № 5 Гальванічні елементи
- •Завдання для самоконтролю до теми "Гальванічні елементи"
- •Лабораторна робота № 6 Електроліз розчинів. Акумулятори
- •Завдання для самоконтролю до теми "Електроліз розчинів"
- •Лабораторна робота № 7 Корозія металів. Методи захисту від корозії
- •Завдання для самоконтролю до теми " Корозія металів. Методи захисту від корозії"
- •Модуль 5. Конструкційні матеріали
- •Завдання для самоконтролю до теми "Конструкційні метали"
- •Додатки
- •Термодинамічні константи хімічних речовин
- •Розчинність кислот, основ і солей у воді
- •Значення ебуліоскопічних та кріоскопічних констант деяких розчинників
- •Стандартні електродні потенціали металів у водних розчинах
- •Стандартні окисно-відновні потенціали деяких окисно-відновних систем у водних розчинах
Лабораторна робота № 3
Досліди до теми: Електролітична дисоціація
Мета: класифікувати електроліти за значенням електричної провідності та дослідити вплив однойменних йонів на стан рівноваги дисоціації слабких електролітів.
Дослід 1. Визначення електричної провідності розчинів деяких речовин
а) Досліджуваний розчин налийте в склянку до нижньої мітки, і опустіть у розчин електроди. Вставте вилку штепселя в розетку (U = 36 B) і відзначте показання амперметра. Розчини, що рекомендуються для дослідження: HCl, H2SO4, CH3COOH, NaOH, NH4OH, NaCl, KNO3, глюкоза, цукор, гліцерин, спирт. Після кожного вимірювання розчин перелийте в ту ж пляшку, а електроди вимийте, помістивши їх спочатку в склянку з водопровідною, а потім у склянку з дистильованою водою. Отримані дані згрупуйте за силою електролітів (заповніть таблицю 3.2 із зазначенням сили струму). (Сильними вважати електроліти, у яких I = 0,5 А, слабкими – 0,05 А). Для всіх електролітів запишіть рівняння електролітичної дисоціації.
Таблиця 3.1
|
Сильні електроліти |
Слабкі електроліти |
Неелектроліти |
|
|
|
|
б) Злийте розчини оцтової кислоти й амоніаку, випробуйте електричну провідність отриманого розчину. Відзначте спостереження, складіть молекулярне та скорочено-йонне рівняння реакції та рівняння електролітичної дисоціації.
______________________________________________________________________
______________________________________________________________________
Дослід 2. Зсув рівноваги дисоціації слабких електролітів
Налийте в пробірку розчин амоніаку, додайте 1-2 краплі фенолфталеїну, перемішайте вміст пробірки і розділіть його на дві частини. В одну із пробірок додайте кристалічний амоній хлорид. Порівняйте забарвлення розчину в обох пробірках. Зробіть висновки, використовуючи принцип Ле-Шательє.
____________________________________________________________________________________________________________________________________________
Досліди до тем: Йонні реакції в розчинах електролітів. Добуток розчинності малорозчинних речовин
Дослід 3. Йонні реакції
а) З утворенням слабкого електроліту
Покладіть у пробірку декілька кристалів амоній хлориду і додайте розчин натрій гідроксиду. Визначте газ, що виділяється, за запахом, трохи підігрівши пробірку. Складіть молекулярне та йонні рівняння реакції.
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
б) З утворенням осаду
Налийте в три пробірки по 2-3 краплі розчину барій хлориду і додайте: у першу – розчин натрій сульфату, у другу – сульфатну кислоту, у третю – розчин алюміній сульфату. Що спостерігаєте? Складіть молекулярні та йонні рівняння реакції.
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
Дослід 4. Утворення осадів і добуток розчинності
У дві пробірки налийте по 3-4 краплі розчину з молярною концентрацією плюмбум (ІІ) нітрату 0,005 моль/л. В одну додайте такий же об’єм 0,05 моль/л розчину калій хлориду, а в іншу – такий же об’єм розчину 0,05 моль/л розчину калій йодиду. В якій із пробірок випав осад? Поясніть, використовуючи значення добутку розчинності (додаток 5). Складіть рівняння реакцій.
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
Досліди до тем: Йонний добуток води. Водневий показник як кількісна характеристика кислотності-основності розчинів. Гідроліз солей
Дослід 5. Забарвлення індикаторів у різних середовищах
Налийте по 3 пробірки дистильованої води, розчинів хлоридної кислоти та натрій гідроксиду. Згрупуйте пробірки по 3 так, щоб у групі були лужний, кислий і нейтральний розчини. У першу групу пробірок додайте фенолфталеїн, у другу – лакмус, у третю – метилоранж. Результати досліду запишіть у таблицю 3.2.
Таблиця 3.2
|
Назва індикатора |
Забарвлення індикатора в середовищі | ||
|
кисле рН < 7 [H+] > [OH–] |
нейтральне рН = 7 [H+] = [OH–] |
лужне рН > 7 [OH–] > [H+] | |
|
Лакмус |
|
|
|
|
Фенолфталеїн |
|
|
|
|
Метилоранж |
|
|
|
Дослід 6. Гідроліз солей
а) Залежність характеру середовища розчинів від природи солей. У п’ять пробірок налийте по 1 мл дистильованої води і додайте лакмус. Внесіть у першу пробірку натрій карбонат, у другу – алюміній сульфат, у третю – натрій сульфат, у четверту – натрій ортофосфат. П’ята пробірка служить для порівняння отриманих кольорів. Які з випробуваних солей піддалися гідролізу? Складіть рівняння реакцій гідролізу.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) Взаємне посилення гідролізу солі слабкої основи сіллю слабкої кислоти. Налийте в пробірку 5-6 крапель розчину алюміній сульфату і додайте такий же об’єм розчину натрій карбонату. Порівняйте спостереження з дослідом 2а. Відзначте виділення бульбашок газу (якого?) і утворення осаду (якого?) та характер середовища. Напишіть молекулярне і йонно-молекулярні рівняння гідролізу солі.
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
Досліди до теми: Твердість води та способи її усунення
Дослід 7. Визначення твердості води. Спосіб заснований на реакції між хлоридною кислотою і гідрогенкарбонатами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2.
При титруванні кислотою доданий у воду індикатор метиловий оранжевий змінить забарвлення, якщо в розчині з’явиться надлишок кислоти.
Відміряйте циліндром у дві колби по 100 мл водопровідної води і додайте в кожну по 2-3 краплі метилового оранжевого. Одна колба – контрольна. В іншу приливайте із бюретки розчин із молярною концентрацією хлоридної кислоти 0,1 моль/л поки, від однієї краплі кислоти забарвлення із жовтого зміниться в оранжеве. Титрування повторюють 2-3 рази, обчислюють середній показник.
Розрахунок
тимчасовою твердості води (![]() )
здійснюють за формулою:
)
здійснюють за формулою:
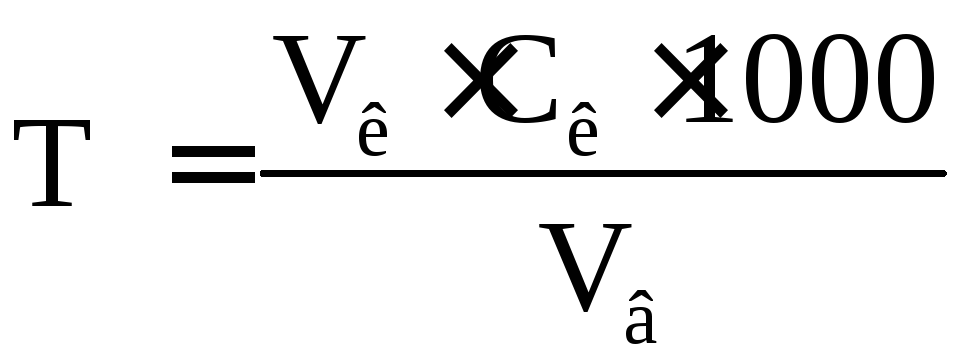 мг-екв/л,
де
мг-екв/л,
де
![]() – об’єм
розчину кислоти, який витрачений на
титрування, мл;
– об’єм
розчину кислоти, який витрачений на
титрування, мл;
![]() –молярна
концентрація еквівалентів розчину
хлоридної кислоти, моль/л;
–молярна
концентрація еквівалентів розчину
хлоридної кислоти, моль/л;![]() – об’єм
води, мл.
– об’єм
води, мл.
____________________________________________________________________________________________________________________________________________
