
- •Міністерство освіти і науки україни
- •Херсон 2010
- •Рецензент: д.Т.Н., професор, зав. Кафедрою охВіПбм Херсонського національного технічного університету Луняка к.В.
- •Запам’ятайте!
- •Рекомендована література
- •Завдання для самоконтролю до теми "Класи неорганічних сполук"
- •Завдання для самоконтролю до теми "Основні закони хімії"
- •Завдання для самоконтролю до теми "Будова атома. Хімічний зв’язок "
- •Модуль 2. Закономірності перебігу хімічних процесів
- •Визначення теплового ефекту реакції
- •Хід роботи
- •Завдання для самоконтролю до теми "Хімічна термодинаміка"
- •Лабораторна робота № 2
- •Завдання для самоконтролю до теми "Швидкість хімічних реакцій. Хімічна рівновага"
- •Модуль 3. Розчини
- •Лабораторна робота № 3
- •Завдання для самоконтролю до теми "Розчини"
- •Модуль 4. Окисно-відновні реакції та електрохімічні процеси
- •Лабораторна робота № 4 Окисно-відновні реакції
- •Завдання для самоконтролю до теми "Окисно-відновні реакції"
- •Лабораторна робота № 5 Гальванічні елементи
- •Завдання для самоконтролю до теми "Гальванічні елементи"
- •Лабораторна робота № 6 Електроліз розчинів. Акумулятори
- •Завдання для самоконтролю до теми "Електроліз розчинів"
- •Лабораторна робота № 7 Корозія металів. Методи захисту від корозії
- •Завдання для самоконтролю до теми " Корозія металів. Методи захисту від корозії"
- •Модуль 5. Конструкційні матеріали
- •Завдання для самоконтролю до теми "Конструкційні метали"
- •Додатки
- •Термодинамічні константи хімічних речовин
- •Розчинність кислот, основ і солей у воді
- •Значення ебуліоскопічних та кріоскопічних констант деяких розчинників
- •Стандартні електродні потенціали металів у водних розчинах
- •Стандартні окисно-відновні потенціали деяких окисно-відновних систем у водних розчинах
Лабораторна робота № 6 Електроліз розчинів. Акумулятори
Мета роботи: описати явища, що відбуваються в катодному та анодному просторі електролізеру. Скласти схеми електролізу розчинів різного складу.
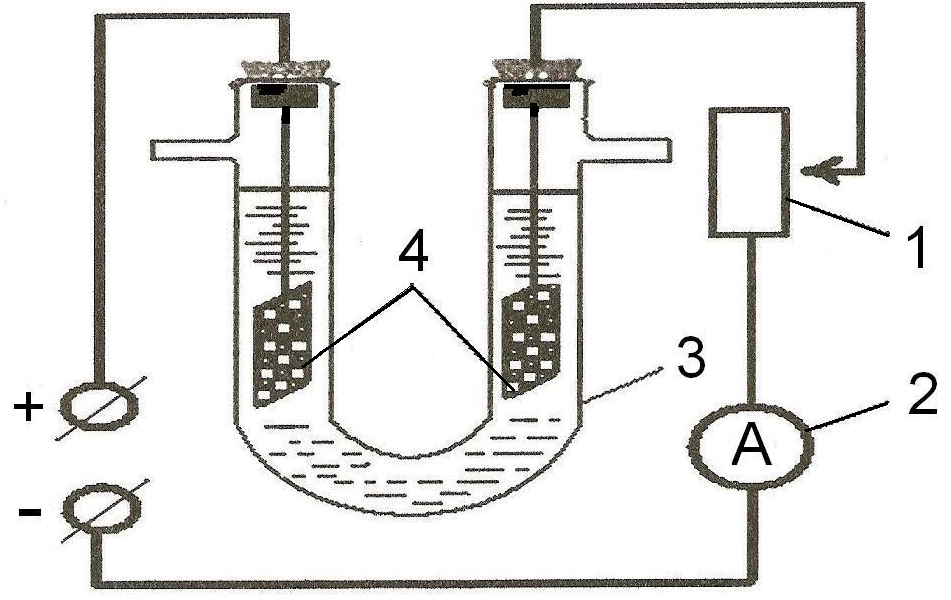
Дослід 1. В електролізер (рис. 1) налийте розчин купрум (ІІ) хлориду, опустіть в обидва коліна графітові електроди, і увімкніть прилад у мережу (U = 36 В). Опишіть явища, що відбуваються в катодному та анодному просторі електролізеру. Складіть схему електролізу.
Рис. 1. Схема установки для електролізу водних розчинів електролітів: 1 – реостат, 2 – амперметр, 3 – електролізер, 4 – електроди
________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 2. В електролізер (рис. 1) налийте розчин калій йодиду, опустіть в обидва коліна графітові електроди, і увімкніть прилад у мережу (U = 36 В). У катодний простір додайте 1-2 краплі розчину фенолфталеїну. Опишіть явища, що відбуваються в катодному та анодному просторі електролізеру. Складіть схему електролізу.
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
Дослід 3. У електролізер (рис. 1) налийте розчин натрій сульфату, опустіть в обидва коліна графітові електроди і увімкніть прилад у мережу (U = 36 В). В обидва коліна трубки налийте розчин лакмусу. Для приготування контрольного розчину налийте в пробірку дистильовану воду і додайте лакмус. Опишіть явища, що відбуваються в катодному та анодному просторі електролізеру. Складіть схему електролізу.
____________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________
Дослід 4. У електролізер (рис. 1) налийте розчин цинк сульфату, занурте графітові електроди в розчин і увімкніть прилад у мережу (U = 36 В). В обидва коліна трубки додайте кілька краплин розчину лакмусу. Опишіть явища, що відбуваються в катодному та анодному просторі електролізеру. Складіть схему електролізу.
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
Дослід 5. Робота свинцевого акумулятора
Зберіть акумулятор за схемою Рb | Н2SO4 | PbO2 і заповніть 2/3 його об’єму розчином з молярною концентрацією сульфатної кислоти 3,5 моль/л. Запишіть рівняння реакції між свинцем і сульфатною кислотою. Можна застосовувати більш розведену кислоту. Перевірте, чи працює акумулятор у цьому випадку. Для цього потрібно приєднати дроти до електричної лампочки. Зарядіть акумулятор, приєднавши його на 4-5 хв. до джерела постійного струму напругою 4,5-5 В. Від’єднайте акумулятор від джерела струму і знову приєднайте дріт до лампочки. Запишіть рівняння реакцій, що протікають на електродах при зарядці і розрядці акумулятора.
____________________________________________________________________________________________________________________________________________
Дослід 6. Анодне окиснення (електричне рафінування міді)
У приладі для електролізу замініть графітовий анод на мідний. Графітовий електрод використайте як катод. До електролізера налийте розчин з молярною концентрацією сульфатної кислоти 1 моль/л та занурте у нього обидва електроди. Приєднайте їх до джерела струму. Через деякий час спостерігайте явища, які відбуваються на електродах та в розчині біля них. Напишіть рівняння електрохімічних реакцій. Поясніть, який газ виділяється на початку досліду на катоді й чому пізніше його виділення припиняється.
____________________________________________________________________________________________________________________________________________
Дослід 7. Електролітичне нікелювання міді
Зберіть прилад для електролітичного нікелювання міді, де катодом буде мідна пластинка, а анодом – нікелева (рис.2). Як електролітичну ванну 1 використайте хімічну склянку ємністю 250 мл. Катод зачистіть тонким наждачним папером, знежирте його вапняною водою, промийте декілька разів дистильованою водою та висушіть фільтрувальним папером. Електроди закріпіть паралельно один до одного на відстані 3 см і опустіть у електролізер.
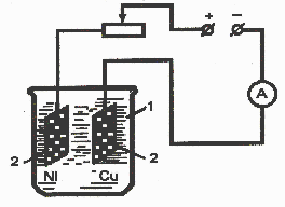
Рис. 2. Схема установки для електролітичного нікелювання міді:
1 – електролітична ванна; 2 – електроди
До електролізера налийте розчин електроліту такого складу: 50 г NiSO4 · 7H2O, 40 г Na2SO4 · 10H2O, 5 г H3BO3 та 250 мл води. Борну кислоту додають для підкислювання розчину.
Приєднайте електроди до джерела струму та за допомогою реостата встановіть густину струму 0,005-0,01 А/см2. Час електролізу – 15-20 хв. Після цього відімкніть прилад від джерела живлення, вийміть мідний катод з електролітичної вани, промийте його водою та висушіть фільтрувальним папером. Запишіть рівняння реакцій, що відбуваються на електродах.
___________________________________________________________________________________________________________________________________________
______________________________________________________________________
