
- •1. Матеріалознавство. Дайте визначення. Пояснити взаємозв’язок між будовою, кристалічною структурою матеріалу і його властивостями. Наведіть приклади.
- •2. Матеріалознавство. Структура та будова матеріалів. Макроструктура, мікроструктура. Тонка структура, пориста структура. Дати визначення.
- •3. Методи дослідження макроструктури. Наведіть приклади органолептичної оцінки якості та властивостей товарів.
- •4. Формування тонкої структури матеріалів. Методи дослідження. Пори. Розміри і форма пор. Наведіть приклади взаємозв’язку між пористістю матеріалу і його властивостями.
- •Загальна інформація
- •Різновиди Густина відносна
- •Густина дійсна
- •9. Принципи побудови композиційних матеріалів будівельного призначення. Основні елементи композиційних композиційного матеріалу. Дайте їх визначення.
- •11. Приклади композиційної побудови матеріалів будівельного призначенняна основі бітумних і дьогтьових в'яжучих.
- •12. Загальна класифікація композиційних матеріалів будівельного призначення.
- •13. Сучасні уявлення про формування структури та її роль в отриманні будівельних композиційних матеріалів із заданими властивостями. Структура, мікроструктура, мезо- та макроструктура.
- •14. Композиційні матеріали спеціального призначення в будівництві отриманні шляхом варіювання складом та структурою. Конструкційні, гідорізоляційні, покрівельні та герметизуючі.
- •15. Композиційні матеріали спеціального призначення в будівництві отриманні шляхом варіювання складом та структурою. Теплоізоляційні, акустичні (звукоізоляційні, звукопоглинільні)
- •17. Фізико-хімічні методи оцінки складу структури та властивостей будівельних матеріалів.
- •20. Фізичні властивості будівельних матеріалів: вогнестійкість, негорючі матеріали, важкогорючі, горючі. Границя вогнестійкості. Вогнетривкість. Жаростійкість.
- •22. Механічні властивості будівельних матеріалів: твердість, міцність, пружність, пластичність, крихкість.
- •23. Хімічні властивості: розчинність, кислотостійкість, лугостійкість, токсичність, корозійна стійкість, біокорозія.
- •24. Технологічні властивості матеріалів: формувальність, подрібнюваність, розпилюваність, пробійність, полірувальність, технологічність.
- •25. Лакофарбові матеріали та покриття. Дайте характеристику компонентів лакофарбових матеріалів: плівкоутворювачі, розчинники, розріджувачі, пластифікатори, наповнювачі, пігменти.
- •26. Лакофарбові матеріали: лаки, емалі, фарби: масляні, водоемульсійні (латексні), грунтівки:ізолюючі, пасивідуючі, фосфатуючі, протекторні, шпаклівки.
- •27. Природний і синтетичний каучук. Хімічний склад. Формула. Сировина для виготовлення. Гума. Склад гуми. Класифікація гуми.
- •30. Сировина для виробництва будівельних матеріалів та виробів.
- •31. Горюча мінеральна сировина (паливо). Дати визначення. Охарактеризуйте склад палива. Приведіть поділ палива за агрегатним станом і походженням.
- •32. Вода. Застосування. Твердість води. Основні процеси водо підготовки: фізичні, хімічні, фізико-хімічні.
- •33. Промислові та побутові стічні води. Якими речовинами забрудненні стічні води. Охарактеризуйте способи очистки стічних вод.
- •34. Голоіні ознаки фізико-механічних та хімічних технологічних процесів хімічна технологія. Високотемпературні процеси в технології будівельних матеріалів.
- •36. Порошкова металургія. Які завдання виконує порошкова металургія? Основні етапи одержання виробів. Наведіть приклади.
- •37. Дайте характеристику властивостей порошкоподібних матеріалів: хімічні, фізичні, технологічні властивості. Назвіть завершальну стадію технології порошкової металургії.
- •Остаточна обробка виробів
- •Високий тиск
- •Роль каталізаторів виконують тверді, рідинні та газові речовини.
- •Залежно від агрегатного стану каталізатора та реагуючих речовин (сировини) каталізні процеси поділяють на:
- •Електрохімічні процеси Основні закономірності електрохімічних процесів Біохімічні процеси
- •Плазмові процеси
- •Фотохімічні процеси
- •Лазерні процеси
- •Ультразвукові процеси
- •39. Метали і сплави. Властивості металів. Чавун. Сталь. Кольорові метали і сплави на їх основі. Колір і твердість ювелірних виробів.
- •1.1 Сплави міді
- •2. Алюміній і його сплави
- •2.1 Деформуємі алюмінієві сплави
- •2.2 Ливарні алюмінієві сплави
- •3. Цинк і його сплави
- •4. Магній та його сплави
- •4.1 Сплави на основі магнію
- •40. Дисперсні системи. Суспензії. Структуроутворення в дисперсних системах. Реодогічні властивості. Наведіть приклади суспензій.
- •Властивості суспензії
- •41. Кам’яне вугілля. Хімічний склад, продукти переробки, їх застосування.
- •42. Нафта. Склад, технологія і продукти переробки. Загальна характеристика і сфери застосування.
- •43. Каталітичні хіміко-технологічні процеси. Дати визначення. Застосування каталітичних процесів у промисловості: виробництво сірчаної кислоти, аміаку у процесі нафтопереробки.
- •44. Термічні процеси у виробництві непродовольчих товарів. Високотемпературні процеси у виробництві будівельних матеріалів: стадії виробництва порт ланд цементу, стадії виробництва керамічних виробів.
- •45. Хіміко - технологічні процеси. Хімічна технологія. Класифікація. Наведіть приклади.
- •46. Поняття про корозію та агресивні середовища. Види корозії та корозійних руйнувань :за умовами взаємодії. Місцева корозія.
- •Види корозійного руйнування. Корозійне руйнування металів і сплавів починається з поверхні, тобто на межі металевий виріб – середовище, і поступово поширюється в глибину металу.
- •48.Покриття як засіб захисту від корозії:металеві,дифузійні,неметалеві.
- •49.Фракційна перегонка нафти: термічний крекінг мазуту,піроліз нафтових фракцій.
- •50. Вода у виробництві непродовольчих товарів. Класифікація води. Промислова водо підготовка. Способи пом’якшення води.
- •51. Використання вторинної сировини у промисловості . Наведіть приклади. Технологія і охорона навколишнього середовища.
- •3. Опыт применения отходов химико-технологических производств и переработки древесины
- •1. Естественно-научные проблемы защиты окружающей среды
- •1.1 Проблемы оздоровления среды обитания
- •1.2 Влияние вредных веществ на живой организм
- •2. Перспективные технологии и окружающая среда
- •52. Горюча мінеральна сировина(паливо). Класифікація . Кам*яне вугілля , газ,нафта . Хімічний склад палива. Порівняльна характеристика питомої теплоти згоряння.
- •53. Підготовка сировини до перероблення в різних технологічних процесах: подріблення, сортування, збагачення, агломерація, грудкування.
- •54.Сировинна база виробництва . Класифікація сировини. Дати визначення.
4. Формування тонкої структури матеріалів. Методи дослідження. Пори. Розміри і форма пор. Наведіть приклади взаємозв’язку між пористістю матеріалу і його властивостями.
Тонка (внутрішня) структура характеризується певним сполу-ченням між собою атомів чи іонів молекул, а також більш великих структурних елементів, що не вдається спостерігати за допомогою
оптичних мікроскопів. Останні дозволяють розрізняти частки з роз-міром лише не менш 300 нм, тобто того ж порядку, що і довжини хвиль видимої частини світлового спектра. Більш дрібні частки (ато-ми, молекули, пачки молекул, фібрили й ін.) виявляють методами рентгеноструктурного аналізу, електронної мікроскопії й електроно-графії, застосовуючи випромінювання з більш короткою довжиною хвилі. Довжина хвиль рентгенівських променів – від сотих часток до декількох ангстремів.
Методами дифракції рентгенівських променів і електронів уста-новлюють тип кристалічних решіток речовини. Рентгеноструктурний аналіз дає важливі зведення і при дослідженні тіл (матеріалів) з менш упорядкованою структурою (кристалічних і аморфних полімерів, рі-дин тощо). З його допомогою встановлюють ступінь кристалічності полімерів, характер орієнтації структурних елементів у волокні й ін.
Найважливішим методом вивчення тонкої структури речовин є електронна мікроскопія, заснована на застосуванні електронного мі-кроскопа, що особливо просвічує. Електронний мікроскоп дозволяє безпосередньо бачити й вивчати дрібні частки в інтервалі розмірів 10~4-10~8 див (агрегати атомів і молекул). Електроноскопічні й елек-тронографічні дослідження кристалічних решіток і їхніх дефектів мають фундаментальне значення для фізики твердого тіла, матері-алознавства й товарознавства. Електронний мікроскоп незамінний при вивченні змін структури металів і сплавів у результаті терміч-них, механічних і інших обробок. Важливе значення при дослідженні матеріалів має метод рентгенівського просвічування, особливо для виявлення дефектів.
Структура багатьох матеріалів пронизана порами, що є проміжка-ми між структурними елементами, що порушують однорідність мате-ріалу. Вони мають різноманітні розміри і форму (осередку, капіляри й ін.).
Розрізняють пори:
- наскрізні (капіляри), що проходять через усю товщу матеріалу;
- замкнуті (ізольовані), що не сполучаються з зовнішнім середови-щем і заповнені повітрям чи іншим газом;
- напівзамкнуті (не наскрізні), що ідуть у глиб матеріалу;
- поверхневі, чи відкриті (невеликі западини), які обумовлюють
нерівності поверхні матеріалу.
Характер пористості матеріалів обумовлює ряд їхніх властивос-тей. Так, основні властивості (гігієнічні) багатьох одягово-взуттєвих
матеріалів пов'язані з їх мікропористою структурою. У деяких випад-ках наявність пор є наслідком неправильного підбору сировинних матеріалів, порушення режиму технологи (наприклад, пористість по-рцелянового черепка), при цьому пори погіршують якість виробів.
5. Агрегатний стан речовини. Характеристика газоподібного, рідкого і твердого стану речовини. Структура твердих тіл: монокристалічні, полікристалічні, аморфні. Характеристика аморфного і кристалічного стану речовини з позиції термодинаміки. Перехід з одного агрегатного стану в інший. Плазма.
Речовина може існувати в чотирьох агрегатних станах: твердому, рідкому, газоподібному і у вигляді плазми. Змінюючи умови, перш за все температуру і тиск, можна здійснити перехід речовини із одного агрегатного стану в інший. Агрегатні стани відрізняються один від одного величиною і природою сил, що діють між частинками, а також характером руху цих частинок речовини.
Твердий агрегатний стан речовини характеризується впорядкованістю розташування складових частинок (молекул, іонів, атомів). Середня відстань між частинками наближається до їх розмірів, а сили притягання між ними урівноважуються силами відштовхування. Основним видом руху частинок речовини в твердому стані є їх теплові коливання відносно рівноважного положення. Завдяки цьому тверді тіла мають певний об’єм і форму, характеризуються значною пружністю, тобто здатні відновлювати свою форму після зняття зовнішньої деформуючої сили.
В рідкий стан речовина може перейти внаслідок топлення твердого тіла або конденсації газоподібних речовин. Рідкий стан речовини характеризується відносно великими силами взаємодії між частинками. Проте, в порівнянні з твердим станом, кінетична енергія молекул, іонів, атомів в рідині дещо більша, а рух частинок в рідині і їх взаємна орієнтація має свої особливості. Є певна впорядкованість частинок, розташованих безпосередньо одна біля одної (ближній порядок). Ці частинки здійснюють теплові коливання, а деякі з них, які мають надлишок кінетичної енергії, можуть здійснювати поступальний рух за межі свого угрупування, переходячи до іншого. Для такого переходу (активованого стрибка) необхідно подолати деякий потенціальний бар’єр. Знаходячись в рідкому стані, речовина характеризується значною густиною, легко змінює свою форму (набуває форму посуду, а в умовах невагомості - форму кулі), але мало змінює свій об’єм. Між твердим і рідким станом речовини є багато спільного, а тому їх об’єднують загальним терміном конденсований стан.
В газоподібний стан рідина може переходити внаслідок випаровування, а тверде тіло — внаслідок сублімації. При цьому фізико - хімічні характеристики системи здійснюють якісний стрибок. Молекули в газоподібному стані мають максимальну кінетичну енергію і мінімальну потенційну енергію взаємодії. Г оловним видом руху молекул є хаотичний, поступальний рух, при цьому вони зазнають величезної кількості зіткнень.
Знаходячись в газоподібному стані, молекули займають весь наданий їм об’єм.
Перебування речовини у виді плазми відкрито порівняно недавно. Цей стан реалізується, коли на газоподібну речовину, подіяти надвисокою температурою (десятки тисяч градусів), або сильним електричним розрядом або електромагнітним полем. При цьому спостерігається розклад молекул і атомів на іони, ядра і електрони, що рухаються з величезною швидкістю.
Змінюючи температуру і тиск, можна здійснити поступовий перехід речовин із одного агрегатного стану в інший. Перехід речовини із рідкого стану в газоподібний, називають випаровуванням; із твердого в газоподібний - сублімацією; із твердого в рідкий — топленням. Зворотні переходи відповідно називають: конденсація, десублімація і кристалізація (рис. 1.1.).
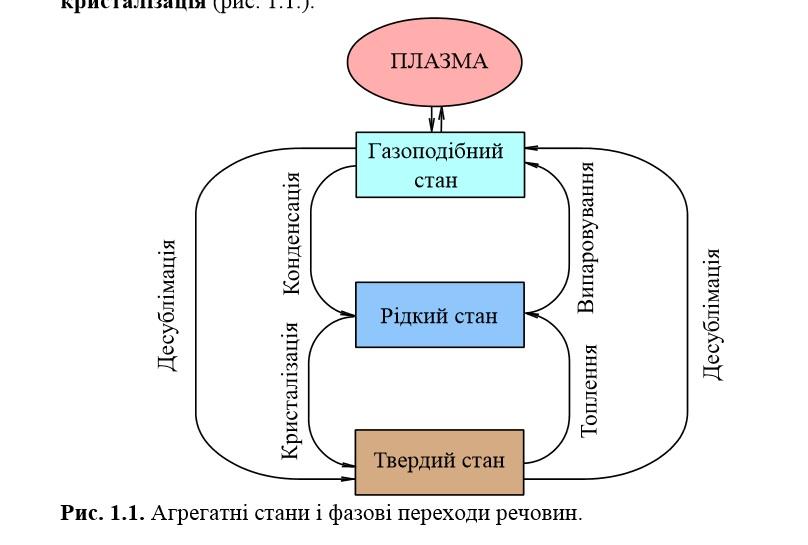 Рис.
1.1.
Рис.
1.1.
Агрегатні стани і фазові переходи речовин.
Слід зазначити, що не всі речовини можуть перебувати у трьох агрегатних станах. Наприклад, для карбонату кальцію можливий лише твердий агрегатний стан, при нагріванні СаСО3 розкладається на СаО і СО2. Для сахарози, полімерів, білків та багатьох інших речовин газоподібний стан взагалі неможливий: при нагріванні вони розкладаються. Деякі речовини за певних умов можуть знаходитись одночасно в двох і навіть трьох агрегатних станах. Так, вода при тиску 101,3 кПа і температурі 0,0075°С знаходиться в трьох станах: твердому (лід), рідкому і газоподібному.
Плазма
Якщо газ нагріти до температур більше 10 тисяч градусів, то енергія молекул настільки зростає, що вони частково розпадаються на іони і вільні електрони. Знаходячись в такому стані, газ починає світитись і проводити електричний струм. Світіння газу зумовлене збудженням атомів, в яких електрони, переходячи з вищих енергетичних рівнів на нижчі, випромінюють кванти енергії у вигляді світла. Електропровідність плазми пов’язана з появою вільних електронів і іонів. Іонізація газів може протікати і під дією сильного опромінення його ультрафіолетовим чи рентгенівським промінням, дією на газ потоком електронів і іонів, під дією сильного електромагнітного поля. Г аз для якого характерна електропровідність і світіння, є формою агрегатного стану речовини, що одержала назву плазми.
Розрізняють два види плазми ізотермічну і газорозрядну. Ізотермічна плазма одержується при високих температурах і може існувати як завгодно довго. З такого виду плазми складається Сонце, зірки, кульова блискавка. При сильному електричному розряді в газовому середовищі утворюється газорозрядна плазма, яка може існувати лише при наявності електричного поля.
Різновидністю плазми є іоносфера Землі, в якій іонізація газу відбувається під дією ультрафіолетового випромінювання Сонця. Для агрегатного стану плазми є характерним ряд особливостей. Плазма має високу електропровідність, яка збільшується з ростом температури. Через плазму можна пропускати струм в сотні тисяч ампер. При проходженні через плазму електричного струму утворюється сильне магнітне поле, яке стискує потік електронів і протонів в плазмовий шнур. Цим самим досягається теплова ізоляція плазми від стінок посуду. Тут роль стінки відіграє магнітне поле.
Пропускаючи через плазму струм значної величини, її можна нагріти до мільйона градусів і вище. В цих умовах і тиску в сотні мільярдів паскалів починають протікати термоядерні реакції з виділенням величезної енергії. Перед фізиками і хіміками стоїть завдання здійснити керований термоядерний синтез. У випадку успішного рішення цієї проблеми людство одержить майже невичерпне джерело енергії.
В останні десятиріччя плазма все ширше використовується в різних хімічних дослідженнях. Навіть виник новий розділ фізичної хімії - плазмохімія. Так, за допомогою плазми вдається проводити такі екзотичні реакції, як одержання хімічних сполук інертних газів. При утворенні в плазмі конденсованої фази з дуже швидким охолодженням продуктів реакції вдається добувати деякі матеріали незвичайного складу з цінними властивостями, наприклад карбіди і нітриди вольфраму і титану. Плазмохімічна обробка поверхні металів, полімерів і деяких інших сполук дозволяє одержувати матеріали з унікальними властивостями їх поверхні.
Тверді тіла діляться на дві великі групи — кристалічні й аморфні.
Кристалічні тіла. У кристалічних тілах атоми або молекули здійснюють теплові коливання біля положення рівноваги, які утворюють так звані кристалічні решітки. Існують різні види кристалічний решіток, але всі вони характеризуються чіткою періодичністю в npoсторі. Тому говорять, що в кристалічних тілах існує далекий порядок в розташуванні атомів.
Наприклад, у кристалі кухонної солі атоми Натрію й Хлору суворо чергуються, розташовуючись у вершинах куба.
Властивості кристала значною мірою визначаються видом кристалічної решітки. Пояснимо це на прикладі графіту й алмаза. Кристалічні решітка графіту має шарувату структуру, тобто в кожному шарі атоми Карбону розташовані у вершинах правильних шестикутників (що нагадують стільники). Усередині шару атоми взаємодіють сильно, але самі шари слабко пов'язані один з одним. Тому кристал графіту легко розшаровується: коли ми пишемо олівцем, на папері залишаються тонкі шари графіту. А ось в кристалі алмаза атоми Карбону розташовані у вершинах і на серединах граней куба.
При цьому всі атоми сильно пов'язані зі своїми найближчими сусідами. Саме цим жорстким зв'язком атомів і зумовлена унікальна твердість алмаза.
Усі метали в твердому стані є кристалами.
Найважливішою властивістю будь-якого кристалічного тіла є наявність певної температури плавлення, за якої воно перетворюється в рідину, не розм'якшуючись перед цим. Наприклад, лід за температури 0 °С тане, перетворюючись на воду.
Монокристали й полікристали. Тіла, що складаються з одиночного
кристала, називаються монокристалами (від грецького «моно» — один
Тіла, що складаються з великого числа зрощених монокристалів, називаються полікристалами (від грецького «полі» — багато).
Анізотропія й ізотропія. Характерною особливістю монокристалів
є те, що багато їхніх властивостей залежить від напряму. Наприклад кристал слюди легко розшаровується тільки в одному напрямі. Теплопровідність і електропровідність монокристалів у різних напрямах також може бути різною.
Залежність фізичних властивостей від напряму називається анізотропією.
Всі монокристали є анізотропними.
Полікристали, на відміну від монокристалів, ізотропні, тобто їх фізичні властивості не залежать від напряму. Це легко зрозуміти, якщо врахувати, що полікристал складається з великого числа маленький монокристалів, орієнтованих у довільних напрямах.
Аморфні тіла. В аморфних тілах атоми або молекули також коливаються біля положення рівноваги. Але ці положення не утворюють кристалічних решіток, хоча найближчі «сусіди» й зберігають деякий порядок у розташуванні (цей порядок називають близьким).
Прикладами аморфних тіл є смола та скло. На відміну від полікристалів, які можна розбити на маленькі монокристали, аморфні тіла розбиваються на частини довільної форми. Наприклад, розглядаючи під мікроскопом товчене скло, ми не помітимо шматочків, що мають геометрично правильну форму.
Аморфні тіла наділені текучістю, тобто із зростанням температури вони поступово розм'якшуються, перетворюючись на в'язку рідину. У цьому виявляється істотна відмінність їх від кристалічних тіл: аморфні тіла не мають певної температури плавлення.
Оскільки в розташуванні атомів або молекул аморфного тіла немає далекого порядку, фізичні властивості аморфного тіла не залежать від напряму, тобто аморфні тіла є ізотропними.
Рідкі кристали. В останні десятиріччя XX ст. учені відкрили, що існують речовини з «подвійною природою» — так звані рідкі кристали. У цих речовинах далекий порядок в розташуванні молекул спостерігається тільки н одному напрямі, а в двох інших — є тільки близький порядок. Інакше кажучи, в таких речовинах існує ніби «ниткоподібна структура», хоча ці речовини текучі подібно до звичайних рідин (чому вони й називаються «рідкими»). Сьогодні штучним шляхом отримані тисячі різних речовин, які є рідкими кристалами. Особливість рідких кристалів полягає в тому, що їх властивості сильно залежать від зовнішніх умов (температури, тиску, електричного й магнітного полів). Тому їх використовують у різних приладах і датчиках. Крім того, оскільки під впливом електричного поля деякі рідкі кристали змінюють колір, вони знайшли широке застосуванні при виготовленні різних дисплеїв — від годинників до комп’ютерів.
6. Основні властивості матеріалів: густина, пластичність, деформація. Види деформації: пружна, еластична, пластична. Теплопровідність, теплоємність, теплостійкість, термічне розширення, морозостійкість.
Густина́(пито́ма ма́са) —масатіла одиничногооб'єму,
є фізичною характеристикою будь-якоїречовини,
з якої складається тіло. Для випадку
однорідних тіл густина визначається
як відношеннямаситіла
![]() дооб'єму
дооб'єму
![]() ,
який воно займає. Таким чином, густина
,
який воно займає. Таким чином, густина
![]() для
цього випадку запишеться як:
для
цього випадку запишеться як:
![]() .
.
У
випадку неоднорідних речовин, густина
не є сталою в просторі тіла і визначається
для кожної його точки окремо. Визначається
за умови, що обрана частка речовини, що
охоплює задану точку, є якомога меншою.
При розгляді речовини в околі точки ми
отримуємо густину у цій точці як границю
маси
![]() віднесеної
до її об'єму
віднесеної
до її об'єму
![]() за
умови, коли розміри частки прямують до
нуля:
за
умови, коли розміри частки прямують до
нуля:
![]()
