
- •Работа № 1 Качественное определение ионов токсичных металлов в воде
- •Бесцветные ионы Цинк
- •Опыт 1. Определение цинка
- •Опыт 2. Определение кадмия
- •Опыт 3. Определение свинца
- •Опыт 4. Определение ртути иодидом калия
- •Опыт 5. Определение висмута (III) тиомочевиной
- •Окрашенные ионы Железо
- •Опыт 6. Определение железа (III)
- •Опыт 7. Определение хрома
- •Опыт 8. Определение меди
- •Опыт 9. Анализ воды на содержание ионов тяжелых металлов (контрольная задача)
- •Определение ионов тяжелых металлов
- •Работа № 2 Качественное определение ионов токсичных неметаллов в воде
- •Опыт 1. Определение сульфид-иона
- •Опыт 2. Обнаружение иона аммония
- •Опыт 3. Определение нитрит-иона no2‾
- •Опыт 4. Обнаружение нитрат-иона no3‾
- •Опыт 5. Определение аниона фтора
- •Опыт 6. Определение фосфора
- •Опыт 7. Определение мышьяка
- •Опыт 8. Анализ воды на содержание анионов неметаллов (контрольная задача)
- •Определение ионов неметаллов
- •Работа № 3 Жесткость воды
- •А. Определение карбонатной жесткости воды Оборудование и реактивы
- •Результаты титрования воды раствором hCl
- •Б. Определение общей жесткости воды Оборудование и реактивы
- •Результаты титрования воды раствором эдта
- •Работа № 4 Определение окисляемости воды методом перманганатометрии
- •Оборудование и реактивы
- •А. Определение окисляемости воды обратным титрованием
- •Б. Определение окисляемости воды прямым титрованием
- •Работа № 5 Фотометрическое определение примесей тяжелых металлов в пресной воде
- •А. Определение железа в виде роданидного комплекса
- •Результаты фотометрирования растворов
- •Оборудование и реактивы
- •Описание определения
- •Б. Определение меди в виде аммиачного комплекса а) Метод калибровочного графика Оборудование и реактивы
- •Описание определения
- •Б) Метод стандартных добавок
- •Описание определения
- •В. Определение висмута в виде тиокарбамидного комплекса
- •Оборудование и реактивы
- •Описание определения
- •Г. Определение титана и ванадия при их совместном присутствии
- •Оборудование и реактивы
- •Описание определения
- •Работа № 6 Спектрофотометрическое определение примесей нефти и нефтепродуктов в природной воде
- •Внешний вид пленки нефти на поверхности воды в зависимости от ее толщины и количества нефти
- •Оборудование и реактивы
- •Описание определения
- •Электрохимические методы анализа объектов окружающей среды
- •Работа № 7 Определение рН воды и почвы
- •Оборудование и реактивы
- •А. Определение рН воды с применением индикаторов
- •Изменение окраски индикаторов
- •Б. Определение рН воды на иономере методом прямой потенциометрии
- •Описание определения
- •В. Определение рН почвы
- •Нормы внесения молотого известняка (кг/10 м2) при различных значениях pH почвы
- •Оборудование и реактивы
- •Работа № 8 Ионоселективное определение примесей различных ионов в природной и питьевой воде а. Определение хлорид-ионов
- •Основные характеристики ионоселективных электродов
- •Оборудование и реактивы
- •Описание определения
- •Результаты ионометрического определения ионов в воде
- •Б. Определение фторид-ионов
- •Оборудование и реактивы
- •Описание определения
- •В. Определение примесей железа
- •Оборудование и реактивы
- •Описание определения
- •Результаты титрования
- •Г. Определение нитрат-ионов
- •Оборудование и реактивы
- •Описание определения
- •Работа № 9 Определение содержания токсичных ионов тяжелых металлов в питьевой воде методом инверсионной вольтамперометрии
- •Оборудование и реактивы
- •Описание определения
- •Работа № 10 Определение меди и цинка при их совместном присутствии на катионите ку-2
- •Раздельное вымывание примесей с катионита ку-2
- •Оборудование и реактивы
- •Описание определения
- •Работа № 11 Определение кадмия в растворах методом хроматографии на бумаге
- •Оборудование и реактивы
- •Описание определения
- •Результаты хроматографического определения ионов кадмия Работа № 12 Определение уровня радиационного загрязнения окружающей среды
- •Оборудование
- •Описание определения
- •Литература
- •Содержание
Результаты фотометрирования растворов
|
Параметры |
Эталоны |
Исследуемые растворы | |||||
|
1 |
2 |
3 |
4 |
1 |
2 |
3 | |
|
Концентрация С, мг |
|
|
|
|
|
|
|
|
Оптическая плотность |
|
|
|
|
|
|
|
Оборудование и реактивы
Фотоколориметр.
Стеклянные кюветы на 3,0 см, 2 шт.
Цилиндры: на 10 мл, 1 шт.; на 25 мл, 1 шт.
Мерные колбы на 50 мл, 8 шт.
Азотная кислота, разбавленная 1:1.
Роданид калия, 10%-ный раствор.
Стандартный раствор железа (III), содержащий 0,1 мг железа в 1 мл.
Навеску 0,8640 г NH4Fe(SO4)2∙12H2O растворяют в мерной колбе на 1000 мл в воде, подкисленной 25 мл HNO3 конц.
Описание определения
Для построения калибровочного графика в мерные колбы на 50 мл добавьте пипеткой последовательно 0,5; 1,0; 2,0; 3,0 мл стандартного раствора железа (III), затем в каждую колбу прилейте по 2 мл азотной кислоты (1:1), по 10 мл роданида калия, воды до метки и перемешайте.
И
Рис.1.
Калибровочный график
для определения
железа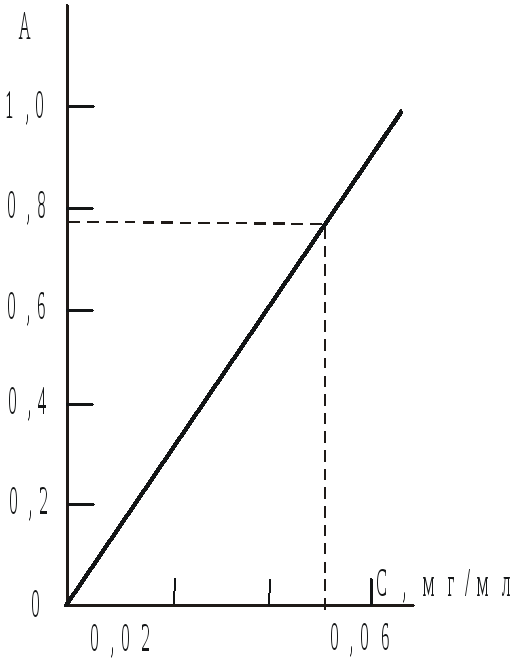
По полученным данным постройте калибровочный график А = f(C), на оси ординат нанесите значения оптической плотности, а на оси абсцисс - соответствующие им значения концентрации раствора в мг/мл (рис.1).
Зная оптическую плотность исследуемого раствора железа, по графику найдите его концентрацию.
Для определения железа в исследуемом растворе, налитом в колбу на 50 мл, добавьте для подкисления 2 мл азотной кислоты (1:1), 10 мл роданида калия, воды до метки и перемешайте. Наполните раствором кювету и измерьте оптическую плотность при тех же условиях, при которых был получен калибровочный график.
Зная оптическую плотность анализируемого раствора, найдите по графику концентрацию Fe3+ в мг/мл. Умножив ее на объем всего анализируемого раствора (50 мл), вычислите общее количество железа.
Б. Определение меди в виде аммиачного комплекса а) Метод калибровочного графика Оборудование и реактивы
Фотоколориметр.
Стеклянные кюветы на 2 см, 2 шт.
Цилиндр на 10 мл, 1 шт.
Пипетка на 10 мл, 1 шт.
Мерные колбы на 50 мл, 8 шт.
Аммиак разбавленный 1:3.
Серная кислота концентрированная (ρ = 1,84).
Стандартный раствор Cu2+, содержащий 1 мг/мл, готовят: 3,9270 г х.ч. CuSO4∙5H2O растворяют в мерной колбе на 1000 мл в небольшом количестве воды, приливают 5 мл концентрированной серной кислоты и воды до метки.
Определение содержания ионов меди в природных водах представляет практический интерес. Соли меди широко применяют в сельском хозяйстве как ядохимикаты. Кроме того, ион Сu2+ входит в состав медных микроудобрений. После дождей и таяния снега медь может попадать в природные источники питьевой воды. Избыток меди в организме разрушает витамины С и А, способствует образованию токсичных продуктов окисления липидов.
Фотометрическое определение меди основано на образовании иона Cu2+ с аммиаком комплекса [Cu(NH3)4]2+, окрашенного в интенсивно-синий цвет. Максимальное поглощение света окрашенным раствором λmax = 610 нм. Чувствительность метода составляет 0,01 мг меди в 25 мл конечного раствора при толщине фотометрического слоя 2 см.
Измерение оптической плотности эталонов и исследуемых растворов осуществляют по отношению к нулевому раствору сравнения.
Нулевой раствор приготавливают следующим образом: 10 мл разбавленного (1:3) аммиака NH4OH переносят в мерную колбу на 50 мл, добавляют 1 каплю концентрированной серной кислоты, разбавляют дистиллированной водой до метки и перемешивают.
Результаты фотометрических измерений заносят в форму, аналогичную форме табл.5 (см. с. 45).
