
- •Работа № 1 Качественное определение ионов токсичных металлов в воде
- •Бесцветные ионы Цинк
- •Опыт 1. Определение цинка
- •Опыт 2. Определение кадмия
- •Опыт 3. Определение свинца
- •Опыт 4. Определение ртути иодидом калия
- •Опыт 5. Определение висмута (III) тиомочевиной
- •Окрашенные ионы Железо
- •Опыт 6. Определение железа (III)
- •Опыт 7. Определение хрома
- •Опыт 8. Определение меди
- •Опыт 9. Анализ воды на содержание ионов тяжелых металлов (контрольная задача)
- •Определение ионов тяжелых металлов
- •Работа № 2 Качественное определение ионов токсичных неметаллов в воде
- •Опыт 1. Определение сульфид-иона
- •Опыт 2. Обнаружение иона аммония
- •Опыт 3. Определение нитрит-иона no2‾
- •Опыт 4. Обнаружение нитрат-иона no3‾
- •Опыт 5. Определение аниона фтора
- •Опыт 6. Определение фосфора
- •Опыт 7. Определение мышьяка
- •Опыт 8. Анализ воды на содержание анионов неметаллов (контрольная задача)
- •Определение ионов неметаллов
- •Работа № 3 Жесткость воды
- •А. Определение карбонатной жесткости воды Оборудование и реактивы
- •Результаты титрования воды раствором hCl
- •Б. Определение общей жесткости воды Оборудование и реактивы
- •Результаты титрования воды раствором эдта
- •Работа № 4 Определение окисляемости воды методом перманганатометрии
- •Оборудование и реактивы
- •А. Определение окисляемости воды обратным титрованием
- •Б. Определение окисляемости воды прямым титрованием
- •Работа № 5 Фотометрическое определение примесей тяжелых металлов в пресной воде
- •А. Определение железа в виде роданидного комплекса
- •Результаты фотометрирования растворов
- •Оборудование и реактивы
- •Описание определения
- •Б. Определение меди в виде аммиачного комплекса а) Метод калибровочного графика Оборудование и реактивы
- •Описание определения
- •Б) Метод стандартных добавок
- •Описание определения
- •В. Определение висмута в виде тиокарбамидного комплекса
- •Оборудование и реактивы
- •Описание определения
- •Г. Определение титана и ванадия при их совместном присутствии
- •Оборудование и реактивы
- •Описание определения
- •Работа № 6 Спектрофотометрическое определение примесей нефти и нефтепродуктов в природной воде
- •Внешний вид пленки нефти на поверхности воды в зависимости от ее толщины и количества нефти
- •Оборудование и реактивы
- •Описание определения
- •Электрохимические методы анализа объектов окружающей среды
- •Работа № 7 Определение рН воды и почвы
- •Оборудование и реактивы
- •А. Определение рН воды с применением индикаторов
- •Изменение окраски индикаторов
- •Б. Определение рН воды на иономере методом прямой потенциометрии
- •Описание определения
- •В. Определение рН почвы
- •Нормы внесения молотого известняка (кг/10 м2) при различных значениях pH почвы
- •Оборудование и реактивы
- •Работа № 8 Ионоселективное определение примесей различных ионов в природной и питьевой воде а. Определение хлорид-ионов
- •Основные характеристики ионоселективных электродов
- •Оборудование и реактивы
- •Описание определения
- •Результаты ионометрического определения ионов в воде
- •Б. Определение фторид-ионов
- •Оборудование и реактивы
- •Описание определения
- •В. Определение примесей железа
- •Оборудование и реактивы
- •Описание определения
- •Результаты титрования
- •Г. Определение нитрат-ионов
- •Оборудование и реактивы
- •Описание определения
- •Работа № 9 Определение содержания токсичных ионов тяжелых металлов в питьевой воде методом инверсионной вольтамперометрии
- •Оборудование и реактивы
- •Описание определения
- •Работа № 10 Определение меди и цинка при их совместном присутствии на катионите ку-2
- •Раздельное вымывание примесей с катионита ку-2
- •Оборудование и реактивы
- •Описание определения
- •Работа № 11 Определение кадмия в растворах методом хроматографии на бумаге
- •Оборудование и реактивы
- •Описание определения
- •Результаты хроматографического определения ионов кадмия Работа № 12 Определение уровня радиационного загрязнения окружающей среды
- •Оборудование
- •Описание определения
- •Литература
- •Содержание
Работа № 4 Определение окисляемости воды методом перманганатометрии
Окисляемость воды, или химическая потребность в кислороде (ХПК) характеризует общее содержание восстановителей в воде, в том числе и органических веществ. Она выражается в миллиграммах (мг) кислорода, необходимого для полного окисления всех восстановителей и органических веществ, присутствующих в одном литре воды. Чем меньше величина ХПК, тем выше качество воды.
Определение
химической потребности воды в кислороде
основано на окислении веществ,
присутствующих в пробе воды, 0,01 н
раствором перманганата калия в сернокислой
среде при кипячении. Как сильный
окислитель перманганат калия реагирует
со всеми присутствующими в воде
восстановителями. Избыток
![]() реагирует с вводимой в раствор щавелевой
кислотой:
реагирует с вводимой в раствор щавелевой
кислотой:
![]()
2
![]()
5 ![]() .
.
Не вступившая в реакцию щавелевая кислота оттитровывается раствором перманганата калия.
Эквивалентные
массы перманганата калия
![]() и щавелевой кислоты
и щавелевой кислоты![]() определяются по формулам
определяются по формулам
![]() г/экв;
г/экв;
![]() г/экв,
г/экв,
где![]() ,
,![]() - молярные массы перманганата калия и
щавелевой кислоты соответственно;
- молярные массы перманганата калия и
щавелевой кислоты соответственно;![]() - число электронов, участвующих в процессе
окисления или восстановления.
- число электронов, участвующих в процессе
окисления или восстановления.
Оборудование и реактивы
Бюретки на 25 мл.
Пипетки на 10, 100 мл.
Колбы конические для титрования на 250 мл, 3 шт.
Колбы мерные на 250 мл.
Серная кислота, 2 н раствор.
Щавелевая кислота
![]() .
.
Перманганат калия,
0,01 н раствор (0,37 г
![]() на 1 л раствора).
на 1 л раствора).
1. Определение точной концентрации рабочего раствора KMnO4 по исходному веществу H2C2O4∙2H2O.
Раствор перманганата калия нельзя приготовить по точной навеске вещества, так как его концентрация приблизительно в течение недели постоянно уменьшается за счет химических реакций с загрязнениями, неизбежно присутствующими на стенках сосуда, в котором хранится раствор. Поэтому концентрацию перманганата калия устанавливают титрованием через неделю после его приготовления раствором щавелевой кислоты H2C2O42H2O.
Приготовление
стандартного раствора щавелевой кислоты.
На
аналитических весах взвесьте навеску
щавелевой кислоты массой около 0,158 г,
перенесите ее без потерь в мерную колбу
на 250 мл, растворите в дистиллированной
воде, разбавьте раствор до метки и
тщательно перемешайте. Титр раствора
![]() и его нормальную концентрацию
и его нормальную концентрацию![]() рассчитайте по формулам
рассчитайте по формулам
![]() г/мл;
г/мл;
![]() экв/л,
экв/л,
где![]() - масса навески щавелевой кислоты, г;
- масса навески щавелевой кислоты, г;![]() - объем мерной колбы, мл.
- объем мерной колбы, мл.
Титрование раствора KMnO4 по щавелевой кислоте. В колбу для титрования поместите приблизительно 10 мл 2 н раствора серной кислоты и нагрейте его до 80 - 85 С. Пипеткой отберите аликвотную часть (10,00 мл) приготовленного раствора щавелевой кислоты и внесите ее в нагретый раствор серной кислоты.
Параллельно заполните бюретку для титрования раствором перманганата калия. Титруйте по каплям горячий раствор щавелевой кислоты перманганатом калия, причем в начале процесса каждую следующую каплю раствора перманганата калия прибавляйте лишь после того, как исчезает окраска от предыдущей. Титруйте до появления бледно-розовой окраски раствора, устойчивой в течение не менее 30 с. Процесс титрования повторите не менее трех раз, причем результаты титрования (величины объемов раствора перманганата калия, затраченного на титрование) не должны различаться более чем на 0,1 мл.
Расчет нормальной
концентрации перманганата калия
![]() проведите по среднему результату:
проведите по среднему результату:
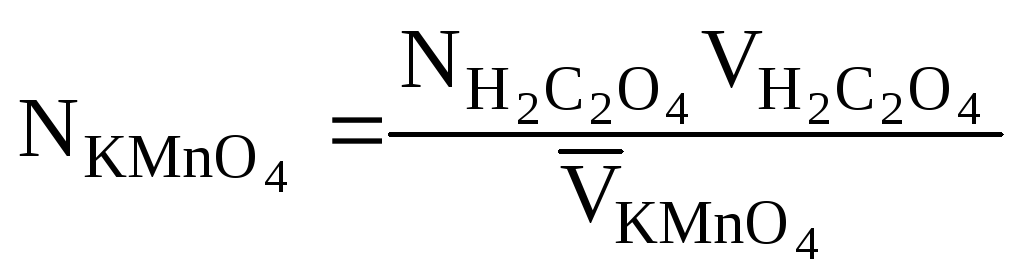 экв/л,
экв/л,
где
![]() - объем аликвоты раствора щавелевой
кислоты (равен 10,00 мл);
- объем аликвоты раствора щавелевой
кислоты (равен 10,00 мл);![]() - средний объем раствора перманганата
калия, затраченный на титрование, мл.
- средний объем раствора перманганата
калия, затраченный на титрование, мл.
