
- •Работа № 1 Качественное определение ионов токсичных металлов в воде
- •Бесцветные ионы Цинк
- •Опыт 1. Определение цинка
- •Опыт 2. Определение кадмия
- •Опыт 3. Определение свинца
- •Опыт 4. Определение ртути иодидом калия
- •Опыт 5. Определение висмута (III) тиомочевиной
- •Окрашенные ионы Железо
- •Опыт 6. Определение железа (III)
- •Опыт 7. Определение хрома
- •Опыт 8. Определение меди
- •Опыт 9. Анализ воды на содержание ионов тяжелых металлов (контрольная задача)
- •Определение ионов тяжелых металлов
- •Работа № 2 Качественное определение ионов токсичных неметаллов в воде
- •Опыт 1. Определение сульфид-иона
- •Опыт 2. Обнаружение иона аммония
- •Опыт 3. Определение нитрит-иона no2‾
- •Опыт 4. Обнаружение нитрат-иона no3‾
- •Опыт 5. Определение аниона фтора
- •Опыт 6. Определение фосфора
- •Опыт 7. Определение мышьяка
- •Опыт 8. Анализ воды на содержание анионов неметаллов (контрольная задача)
- •Определение ионов неметаллов
- •Работа № 3 Жесткость воды
- •А. Определение карбонатной жесткости воды Оборудование и реактивы
- •Результаты титрования воды раствором hCl
- •Б. Определение общей жесткости воды Оборудование и реактивы
- •Результаты титрования воды раствором эдта
- •Работа № 4 Определение окисляемости воды методом перманганатометрии
- •Оборудование и реактивы
- •А. Определение окисляемости воды обратным титрованием
- •Б. Определение окисляемости воды прямым титрованием
- •Работа № 5 Фотометрическое определение примесей тяжелых металлов в пресной воде
- •А. Определение железа в виде роданидного комплекса
- •Результаты фотометрирования растворов
- •Оборудование и реактивы
- •Описание определения
- •Б. Определение меди в виде аммиачного комплекса а) Метод калибровочного графика Оборудование и реактивы
- •Описание определения
- •Б) Метод стандартных добавок
- •Описание определения
- •В. Определение висмута в виде тиокарбамидного комплекса
- •Оборудование и реактивы
- •Описание определения
- •Г. Определение титана и ванадия при их совместном присутствии
- •Оборудование и реактивы
- •Описание определения
- •Работа № 6 Спектрофотометрическое определение примесей нефти и нефтепродуктов в природной воде
- •Внешний вид пленки нефти на поверхности воды в зависимости от ее толщины и количества нефти
- •Оборудование и реактивы
- •Описание определения
- •Электрохимические методы анализа объектов окружающей среды
- •Работа № 7 Определение рН воды и почвы
- •Оборудование и реактивы
- •А. Определение рН воды с применением индикаторов
- •Изменение окраски индикаторов
- •Б. Определение рН воды на иономере методом прямой потенциометрии
- •Описание определения
- •В. Определение рН почвы
- •Нормы внесения молотого известняка (кг/10 м2) при различных значениях pH почвы
- •Оборудование и реактивы
- •Работа № 8 Ионоселективное определение примесей различных ионов в природной и питьевой воде а. Определение хлорид-ионов
- •Основные характеристики ионоселективных электродов
- •Оборудование и реактивы
- •Описание определения
- •Результаты ионометрического определения ионов в воде
- •Б. Определение фторид-ионов
- •Оборудование и реактивы
- •Описание определения
- •В. Определение примесей железа
- •Оборудование и реактивы
- •Описание определения
- •Результаты титрования
- •Г. Определение нитрат-ионов
- •Оборудование и реактивы
- •Описание определения
- •Работа № 9 Определение содержания токсичных ионов тяжелых металлов в питьевой воде методом инверсионной вольтамперометрии
- •Оборудование и реактивы
- •Описание определения
- •Работа № 10 Определение меди и цинка при их совместном присутствии на катионите ку-2
- •Раздельное вымывание примесей с катионита ку-2
- •Оборудование и реактивы
- •Описание определения
- •Работа № 11 Определение кадмия в растворах методом хроматографии на бумаге
- •Оборудование и реактивы
- •Описание определения
- •Результаты хроматографического определения ионов кадмия Работа № 12 Определение уровня радиационного загрязнения окружающей среды
- •Оборудование
- •Описание определения
- •Литература
- •Содержание
А. Определение окисляемости воды обратным титрованием
Отберите пипеткой
100 мл исследуемой воды и перенесите в
колбу на 250 мл, добавьте 7 - 10 мл 2 н раствора
серной кислоты и 10,00 мл раствора
перманганата калия (пипеткой), закройте
колбу часовым стеклом или воронкой и
кипятите 10 мин (с начала кипения). После
кипячения добавьте при перемешивании
точно отмеренный объем щавелевой
кислоты, вычисленный по формуле
![]() где
где![]() - коэффициент соотношения, учитывающий
различие в концентрациях растворов
щавелевой кислоты и перманганата калия,
рассчитываемый следующим образом:
- коэффициент соотношения, учитывающий
различие в концентрациях растворов
щавелевой кислоты и перманганата калия,
рассчитываемый следующим образом:
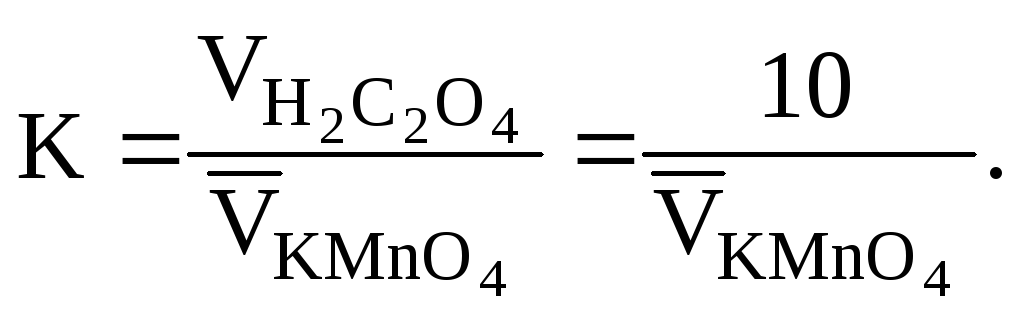
Обесцветившийся горячий раствор сразу же оттитруйте раствором перманганата калия до слабо-розового окрашивания.
Количество эквивалентов перманганата калия, затраченное на обратное титрование, равно количеству эквивалентов восстановителей, присутствующих в воде. Поэтому окисляемость воды (в пересчете на кислород) вычислите по формуле
![]() ,
мг/л,
,
мг/л,
где
![]() - нормальная концентрация раствора
перманганата калия, экв/л;
- нормальная концентрация раствора
перманганата калия, экв/л;![]() - объем раствора перманганата калия,
затраченный на обратное титрование,
мл;
- объем раствора перманганата калия,
затраченный на обратное титрование,
мл;![]() - эквивалентная масса кислорода (8,0); n -
число аликвотных частей воды. В данном
случае n определяется как
- эквивалентная масса кислорода (8,0); n -
число аликвотных частей воды. В данном
случае n определяется как
![]()
Примечания. 1. Важно строго соблюдать последовательность прибавления реактивов.
2. Довести раствор до кипения необходимо за минимальное время.
3. Если при кипячении в течение 10 мин раствор обесцветится, побуреет или появится коричневый осадок, определение следует повторить, взяв для анализа меньший объем воды и разбавив его до 100 мл дистиллированной водой. Соответственно в формуле для вычисления ХПК необходимо пересчитать число аликвот.
Б. Определение окисляемости воды прямым титрованием
Анализируемый раствор разбавьте дистиллированной водой в колбе на 100 мл до метки, перемешайте. Пипеткой на 10 мл отберите аликвотную часть воды и перенесите ее в колбу для титрования. Добавьте 5 мл 2 н H2SO4. Оттитруйте раствором перманганата калия известной концентрации до розовой окраски. Титрование проведите не менее трех раз и для расчета возьмите средний объем KMnO4.
ХПК воды рассчитайте по формуле
![]() ,
мг/л,
,
мг/л,
где
![]() - эквивалентная масса кислорода (8,0); n -
число аликвотных частей (n = 100/10).
- эквивалентная масса кислорода (8,0); n -
число аликвотных частей (n = 100/10).
После окончания работы промойте бюретку водой.
Рассчитайте абсолютную и относительную ошибки эксперимента.
Работа № 5 Фотометрическое определение примесей тяжелых металлов в пресной воде
Фотометрический анализ - это определение концентрации окрашенных веществ, основанное на измерении поглощения света раствором. Каждый истинный раствор обладает способностью избирательно поглощать электромагнитное излучение определенной длины волны, т.е. характеризуется строго индивидуальным спектром поглощения. Поэтому интенсивность окраски раствора связана с характером поглощения им света.
В основе метода фотометрии лежит объединенный закон Бугера - Ламберта - Бэра
A = lC,
где А - оптическая
плотность,
![]() ;
I0
- интенсивность монохроматического
света, падающего на раствор; I - интенсивность
света, прошедшего через раствор;
- молярный коэффициент поглощения,
зависящий от длины падающего света; l
- толщина поглощающего слоя раствора;
С - концентрация поглощающего вещества
в растворе. Таким образом, при
монохроматическом излучении и прочих
равных условиях
оптическая плотность раствора
пропорциональна концентрации определяемого
вещества.
;
I0
- интенсивность монохроматического
света, падающего на раствор; I - интенсивность
света, прошедшего через раствор;
- молярный коэффициент поглощения,
зависящий от длины падающего света; l
- толщина поглощающего слоя раствора;
С - концентрация поглощающего вещества
в растворе. Таким образом, при
монохроматическом излучении и прочих
равных условиях
оптическая плотность раствора
пропорциональна концентрации определяемого
вещества.
Выбор длины волны света и светофильтра в фотометрическом анализе определяет чувствительность и воспроизводимость результатов. Такой выбор осуществляется по спектру поглощения исследуемого раствора (зависимость оптической плотности от длины волны). Выбирается с помощью светофильтра область спектра, отвечающая максимальной оптической плотности λmax.
Концентрацию вещества при фотометрическом анализе обычно определяют по калибровочному графику, построенному в координатах А - С, где по оси ординат откладывается оптическая плотность раствора, а по оси абсцисс - его концентрация.
В зависимости от способа измерения поглощения раствора и формирования монохроматического излучения различают три разновидности фотометрического анализа.
Колориметрия - визуальное сравнение интенсивности окраски исследуемого раствора с окраской раствора известной концентрации. Окраска фиксируется при освещении раствора немонохроматическим излучением видимого участка спектра. Поэтому колориметрия является частным случаем спектрофотометрии.
Спектрофотометрия - измерение при помощи фотоприемников (фотоэлементов, фотоэлектронных умножителей и т.п.) поглощения монохроматического излучения. Главными преимуществами спектрофотометрии являются значительно бóльшая чувствительность, независимость результатов от индивидуальных особенностей наблюдателя, возможность использования не только видимой, но и других областей спектра.
Фотометрия - упрощенный способ монохроматизации света при помощи светофильтров.
Фотометрическому анализу обычно подвергают растворы окрашенных веществ. Поглощение света связано с переходами электронов внутри молекулы с основной орбитали на более высокие. На характер этих переходов в значительной степени влияет среда (природа растворителя, концентрация поглощающего вещества, присутствие других веществ, например, комплексообразователей, рН, температура). Кроме того, собственным поглощением в растворах обладает ограниченное число веществ. Поэтому в фотометрическом анализе широко используют различные химические реакции, приводящие к образованию окрашенных веществ. Чаще всего используют реакции комплексообразования.
Таким образом, фотометрический анализ обычно состоит из двух этапов: а) проведения химических реакций для получения окрашенных веществ, удобных для фотометрирования (фотометрические реакции); б) измерения поглощения приготовленных растворов. Каждый этап одинаково важен, так как от правильности выполнения всех операций и от учета всех факторов, влияющих на точность фотометрического определения, зависит конечный результат.
