
- •Г.А. Тихановская, л.М. Воропай, в.В. Кочетова химия
- •Предисловие
- •Введение
- •Основные понятия и законы в химии
- •1.1. Основные химические понятия
- •1.2 Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
- •1.3. Законы газового состояния. Определение молярных масс газообразных веществ
- •2. Строение атома и периодический закон д.И.Менделеева
- •2.1. Этапы на пути создания квантовой механики
- •2.2. Элементы квантово-механической теории атома
- •Характеристика квантовых чисел
- •3. Типы химической связи
- •3.1. Ковалентная связь. Метод валентных связей
- •Возможная геометрическая конфигурация молекул при Sp3 – гибридизации
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4. Водородная связь
- •3.5. Молекулярное взаимодействие
- •4. Общие закономерности протекания и типы химических реакций
- •4.1. Энергетика химических превращений
- •4.1.1. Термохимия. Закон Гесса
- •4.1.2. Энтропия
- •4.1.3. Энергия Гиббса и направленность химических процессов
- •4.2. Химическая кинетика
- •Стандартные теплоты (энтальпии) образования некоторых веществ
- •Стандартная энергия Гиббса образования некоторых веществ
- •Стандартные абсолютные энтропии некоторых веществ
- •4.2.1. Скорость химической реакции
- •4.2.2. Физические методы стимулирования химических превращений
- •4.2.3. Катализ
- •4.3. Химическое равновесие
- •4.3.1. Константа химического равновесия
- •4.3.2. Принцип Ле Шателье
- •5. Дисперсные системы
- •5.1. Способы выражения концентрации растворов
- •5.2. Свойства разбавленных растворов
- •5.3 Растворы электролитов
- •Степень диссоциации различных электролитов
- •5.4. Ионное произведение воды. Водородный показатель
- •5.5 Равновесие в гетерогенных системах, произведение растворимости
- •6. Гидролиз солей
- •Примеры сильных и слабых кислот и оснований
- •6.1. Произведение растворимости. Примеры решения задач
- •7. Жесткость воды
- •8. Окислительно-восстановительные процессы
- •8.1. Электродные потенциалы и электродвижущие силы
- •Стандартные электронные потенциалы(∆е0) некоторых металлов
- •8.2. Электролиз
- •8.3. Коррозия металлов
- •9. Кристаллическое состояние
- •9.1.Основные понятия
- •9.2 Симметрия кристаллов. Система кристаллов
- •9.3. Кристаллические решетки
- •10. Сплавы
- •10.1. Диаграммы состояния металлических систем
- •Библиографический список
- •Произведение растворимости малорастворимых веществ в воде при 25оС
- •Стандартные, окислительно – восстановительные потенциалы ( по отношению к потенциалу стандартного водородного электрода при t 25oC).
- •Термодинамические константы некоторых веществ
- •Оглавление
2. Строение атома и периодический закон д.И.Менделеева
Ядерная модель атома была создана на основе экспериментальных данных по рассеянию α-частиц металлической фольгой (Э. Резерфорд, 1911). Однако эта модель не укладывалась в рамки классической физики, согласно законам которой вращающийся по орбите электрон должен терять энергию на электромагнитное излучение и в результате поглощаться ядром. Для устранения недостатков модели Н. Бор (1913) ввел в описание атома квантовую теорию излучения (М. Планк,1900) и представление о дискретных (меняющихся скачками) энергетических состояниях электрона в атоме. Теория Бора для атома водорода выражена в трех постулатах, согласно которым электрон может вращаться вокруг ядра только по дозволенным, или стационарным (определенного радиуса), орбитам и при этом его энергия остается постоянной. Поглощение кванта энергии hν (ν- частота колебаний, h- постоянная Планка, равная 6,62∙10-34 Дж∙с ) переводит электрон на более удаленную от ядра орбиту, и тот же квант излучается при его обратном перескоке. Главное квантовое число n, принимая целочисленные значения 1,2,3,……, определяет номер орбиты или, соответственно, энергетический уровень, на котором находится электрон. Н. Бором были вычислены радиусы стационарных орбит и скорость движения по ним электрона.
Теория Бора привела в согласие модель атома с его спектрами, объяснив их происхождение и структуру [1].
2.1. Этапы на пути создания квантовой механики
Принцип неопределенности утверждает принципиальную невозможность одновременного определения с одинаковой степенью точности импульса электрона (р=mv) и его положения в пространстве.
Математическая запись этого принципа называется соотношением неопределенности: ∆ рх ∆ х >h , где ∆ рх и ∆ х – соответственно погрешности в определении составляющей импульса частицы и значения её координаты по оси Х. Чем меньше одна из этих величин ∆ рх или ∆ х, тем, соответственно, больше другая.
Это приводит к тому, что траекторию электрона заменяет только вероятность нахождения его в данной области пространства.
Гипотеза Луи де Бройля о том, что микрочастицы, подобно свету имеют двойственную природу (частица-волна) , выражена уравнением, связывающим длину волны (λ) с массой частицы (m), со скоростью её движения (v):
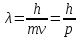
Справедливость гипотезы была подтверждена экспериментально К.Дэвиссоном и Л. Джермером (1927), показавшими аналогию дифракционной картины, которую дают пучок электронов и рентгеновское излучение. Для макрочастиц увеличение массы приводит к тому, что волновой процесс при их движении практически отсутствует.
2.2. Элементы квантово-механической теории атома
Основное уравнение квантовой механики – волновое уравнение Шредингера (1926), решениями которого являются так называемые волновые функции φ (пси), характеризующие состояние электрона в атоме. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества его орбитального движения (в силовом поле ядра) и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным n, орбитальным ℓ и магнитным mℓ.
Четвертое квантовое число, которое называют спиновым, характеризует собственное движение электрона. Значения четырех квантовых чисел полностью определяют состояние электрона в атоме (табл.1).
Таблица 1
