
- •Г.А. Тихановская, л.М. Воропай, в.В. Кочетова химия
- •Предисловие
- •Введение
- •Основные понятия и законы в химии
- •1.1. Основные химические понятия
- •1.2 Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
- •1.3. Законы газового состояния. Определение молярных масс газообразных веществ
- •2. Строение атома и периодический закон д.И.Менделеева
- •2.1. Этапы на пути создания квантовой механики
- •2.2. Элементы квантово-механической теории атома
- •Характеристика квантовых чисел
- •3. Типы химической связи
- •3.1. Ковалентная связь. Метод валентных связей
- •Возможная геометрическая конфигурация молекул при Sp3 – гибридизации
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4. Водородная связь
- •3.5. Молекулярное взаимодействие
- •4. Общие закономерности протекания и типы химических реакций
- •4.1. Энергетика химических превращений
- •4.1.1. Термохимия. Закон Гесса
- •4.1.2. Энтропия
- •4.1.3. Энергия Гиббса и направленность химических процессов
- •4.2. Химическая кинетика
- •Стандартные теплоты (энтальпии) образования некоторых веществ
- •Стандартная энергия Гиббса образования некоторых веществ
- •Стандартные абсолютные энтропии некоторых веществ
- •4.2.1. Скорость химической реакции
- •4.2.2. Физические методы стимулирования химических превращений
- •4.2.3. Катализ
- •4.3. Химическое равновесие
- •4.3.1. Константа химического равновесия
- •4.3.2. Принцип Ле Шателье
- •5. Дисперсные системы
- •5.1. Способы выражения концентрации растворов
- •5.2. Свойства разбавленных растворов
- •5.3 Растворы электролитов
- •Степень диссоциации различных электролитов
- •5.4. Ионное произведение воды. Водородный показатель
- •5.5 Равновесие в гетерогенных системах, произведение растворимости
- •6. Гидролиз солей
- •Примеры сильных и слабых кислот и оснований
- •6.1. Произведение растворимости. Примеры решения задач
- •7. Жесткость воды
- •8. Окислительно-восстановительные процессы
- •8.1. Электродные потенциалы и электродвижущие силы
- •Стандартные электронные потенциалы(∆е0) некоторых металлов
- •8.2. Электролиз
- •8.3. Коррозия металлов
- •9. Кристаллическое состояние
- •9.1.Основные понятия
- •9.2 Симметрия кристаллов. Система кристаллов
- •9.3. Кристаллические решетки
- •10. Сплавы
- •10.1. Диаграммы состояния металлических систем
- •Библиографический список
- •Произведение растворимости малорастворимых веществ в воде при 25оС
- •Стандартные, окислительно – восстановительные потенциалы ( по отношению к потенциалу стандартного водородного электрода при t 25oC).
- •Термодинамические константы некоторых веществ
- •Оглавление
5.3 Растворы электролитов
Соли, кислоты, основания в водном растворе диссоциируют, образуя ионы противоположных зарядов. Вследствие этого растворы проводят электрический ток и называются электролитами. Таким образом, электролит – раствор, содержащий ионы; если же при растворении вещества не происходит диссоциации молекул, такие вещества называются неэлектролитами.
Количественной характеристикой электролитической диссоциации является степень диссоциации α.
α.= Сдисс/Собщ–отношение концентрации молекул, распавшихся на ионы, к общей концентрации молекул. Если α=0, раствор неэлектролита, если α=1, молекулы электролита полностью распались на ионы.
По величине α электролиты можно условно разделить на сильные, средние и слабые. Для сильных электролитов α.>0,3 (>30%); для средних α.= 0,03 - 0,3 (2–30%), для слабых α.<0,03 (<30 %) (табл. 3).
Таблица 3
Степень диссоциации различных электролитов
(при См= 1 моль/литр, =25 ºС)
|
Электролит |
α, % |
Электролит |
α, % |
Электролит |
α, % |
|
HNOз |
82,0 |
Н3РО4 |
29,0 |
НСN |
0,01 |
|
HCl |
78,4 |
Н2SеО4 |
20,0 |
NН4ОН |
1,4 |
|
H2SO2 |
58,0 |
HF |
8,0 |
Н2S |
0,07 |
|
КОН |
77,0 |
CH2COOH |
1,36 |
|
|
|
NaОН |
73,0 |
Н2СО3 |
0,17 |
|
|
Концентрация ионов в растворе электролита зависит от молярной концентрации См, степени диссоциации α и числа ионов данного вида ni, на которое распадается молекула электролита.
Сионов=См∙αni. Например, для раствора Н2SO4 0,5 моль/л при α=50% концентрация ионов водорода [Н+]=0,5∙0,5∙2 моль/л.
Все соли, за исключением HgCl2 и Fe(CHS)3 – сильные электролиты.
Сильные и слабые электролиты имеют свои особенности.
При растворении слабых электролитов в воде происходит обратимая диссоциация, например, для СН3СООН имеет место равновесие:
СН3СООН
 Н+
+СН3СОО‾,
т.е. процесс обратим.
Н+
+СН3СОО‾,
т.е. процесс обратим.
Для обратимого равновесного процесса можно применить закон действующих масс. Константа равновесия в данном случае называется константой диссоциации:
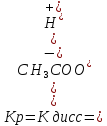
Константа диссоциации характеризует способность слабого электролита к распаду на ионы. Чем меньше величина Кдисс, тем слабее электролит. Например,
КСН3СООН = 1,82∙10-5, КНСN= 7,2∙10‾ ¹º , КНСN<КСН3СООН, т.е. НСN – более слабая кислота.
Обратимая диссоциация происходит в растворе слабого основания, например
NН4ОН NН4+
+ ОН‾;
NН4+
+ ОН‾;
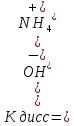
Кдисс = 1,76∙10-5, т.е. NН4ОН – слабое основание.
Если электролит диссоциирует по ступеням, то каждая ступень характеризуется своей константой диссоциации:
Н3РО4 Н++Н2РО4 КI=7,6∙10-3
Н++Н2РО4 КI=7,6∙10-3
Н2РО4 Н++НРО4 К2=6,2∙10-8
Н++НРО4 К2=6,2∙10-8
НРО4 Н++РО4‾ К3=4,4∙10-13
КI>К2>К3.
Н++РО4‾ К3=4,4∙10-13
КI>К2>К3.
Диссоциация в основном идёт по первой ступени, по третьей ступени на электролит практически не диссоциирует, о чём свидетельствует малая величина К3.
Удобнее пользоваться не величинами Кдисс, а величинами рК – показателями кислоты и основания:
pКкислоты = -lgКкислоты, рКоснования =-lgКоснования.
Для Н3Р04: рК1=2,12; рК2= 7,21; рК3= 12,26.
Для характеристики свойств амфотерных электролитов необходимо знать величины констант диссоциации по кислотному и основному типам. По соотношению величин этих констант можно судить о преобладании тех или иных свойств у амфотерного электролита.
Напомним, что диссоциация амфотерного электролита проходит по следующему уравнению (запись в общем виде):
R++
ОНֿ ROH
ROH H+ROֿ.
H+ROֿ.
Тогда для Ве(0Н)2, например, равновесие диссоциации имеет вид:
Ве²++
2OHֿ Ве(OН)2
Ве(OН)2 H2BeO2
H2BeO2 2H+Be22-;
2H+Be22-;
константа диссоциации по основному типу:

по кислотному типу
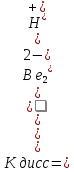
Поскольку Коск>Ккисл, у Ве(ОН)2 преобладают основные свойства.
В случае А1(0Н)3 Косн = 8 ∙10-25, Ккисл = 4∙10-13, следовательно, у А1(OН)3 преобладают кислотные свойства.
Примером электролита, у которого основные и кислотные свойства выражены примерно одинаково, может служить Ga(OH)3, у которого Ккисл=2∙10-12.
Константа диссоциации зависит от природы вещества и температуры , но не зависит от концентрации, поэтому она дает более общую характеристику электролита, чем α .
