
- •Г.А. Тихановская, л.М. Воропай, в.В. Кочетова химия
- •Предисловие
- •Введение
- •Основные понятия и законы в химии
- •1.1. Основные химические понятия
- •1.2 Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
- •1.3. Законы газового состояния. Определение молярных масс газообразных веществ
- •2. Строение атома и периодический закон д.И.Менделеева
- •2.1. Этапы на пути создания квантовой механики
- •2.2. Элементы квантово-механической теории атома
- •Характеристика квантовых чисел
- •3. Типы химической связи
- •3.1. Ковалентная связь. Метод валентных связей
- •Возможная геометрическая конфигурация молекул при Sp3 – гибридизации
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4. Водородная связь
- •3.5. Молекулярное взаимодействие
- •4. Общие закономерности протекания и типы химических реакций
- •4.1. Энергетика химических превращений
- •4.1.1. Термохимия. Закон Гесса
- •4.1.2. Энтропия
- •4.1.3. Энергия Гиббса и направленность химических процессов
- •4.2. Химическая кинетика
- •Стандартные теплоты (энтальпии) образования некоторых веществ
- •Стандартная энергия Гиббса образования некоторых веществ
- •Стандартные абсолютные энтропии некоторых веществ
- •4.2.1. Скорость химической реакции
- •4.2.2. Физические методы стимулирования химических превращений
- •4.2.3. Катализ
- •4.3. Химическое равновесие
- •4.3.1. Константа химического равновесия
- •4.3.2. Принцип Ле Шателье
- •5. Дисперсные системы
- •5.1. Способы выражения концентрации растворов
- •5.2. Свойства разбавленных растворов
- •5.3 Растворы электролитов
- •Степень диссоциации различных электролитов
- •5.4. Ионное произведение воды. Водородный показатель
- •5.5 Равновесие в гетерогенных системах, произведение растворимости
- •6. Гидролиз солей
- •Примеры сильных и слабых кислот и оснований
- •6.1. Произведение растворимости. Примеры решения задач
- •7. Жесткость воды
- •8. Окислительно-восстановительные процессы
- •8.1. Электродные потенциалы и электродвижущие силы
- •Стандартные электронные потенциалы(∆е0) некоторых металлов
- •8.2. Электролиз
- •8.3. Коррозия металлов
- •9. Кристаллическое состояние
- •9.1.Основные понятия
- •9.2 Симметрия кристаллов. Система кристаллов
- •9.3. Кристаллические решетки
- •10. Сплавы
- •10.1. Диаграммы состояния металлических систем
- •Библиографический список
- •Произведение растворимости малорастворимых веществ в воде при 25оС
- •Стандартные, окислительно – восстановительные потенциалы ( по отношению к потенциалу стандартного водородного электрода при t 25oC).
- •Термодинамические константы некоторых веществ
- •Оглавление
5.4. Ионное произведение воды. Водородный показатель
Вода
– очень слабый амфотерный электролит:
Н20
 Н+
+ ОН‾ при 24°С=1,6∙10‾9
Н+
+ ОН‾ при 24°С=1,6∙10‾9
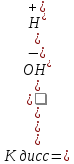
Подставляя в уравнение Кдисс [Н2O]=[Н+]∙[0Н-] концентрацию воды, которая вычисляется из соотношения [Н2O] =1000/18 = 55,5 моль/л, получаем выражение для константы воды: 1,8∙10-16∙55,5=[Н+]∙[0Н-]=1∙10-14=КН2О,
где КН2О=1∙10-14 - ионное произведение воды; КН2О зависит от температуры, с повышением температуры КН2О увеличивается, т.е. диссоциация Н20 происходит с поглощением тепла.
КН2О – постоянна не только для Н2О, но и для разбавленных водных растворов любых веществ [Н+]=[0Н-]=√КН2О=10-7моль/л.
Пользуясь КН2О, можно выразить любую реакцию среды через концентрацию ионов водорода. Нейтральный раствор [Н+]=[0Н-]=10-7моль/л. Кислый раствор [Н+]>10-7моль/л. Щелочной раствор [Н+]<10-7моль/л.
Количественное обозначение реакции среды можно упростить, если ввести водородный показатель pH и гидроксильный показатель pОH, тогда
pH= -lg[Н+]; pОH= -lg[0Н-]. Нейтральная среда pH=7; pОH=7. Кислая средаpH<7; pОH>7. Щелочная среда pH> 7; pОH<7.
5.5 Равновесие в гетерогенных системах, произведение растворимости
Примером
гетерогенной системы может служить
насыщенный раствор
труднорастворимого
соединения, находящегося в равновесии
с твердой фазой. К труднорастворимым
веществам относятся многие электролиты
- соли, основания (чаще всего амфотерные),
некоторые кислоты
(H2SiO3;
β-H2SnO3
и др.). Так, труднорастворимы галогениды
серебра, сульфаты бария и стронция,
карбонаты бария и кальция. Сульфиды
металлов, за исключением сульфидов
натрия и аммония,
характеризуются
очень малой растворимостью. Вследствие
малой растворимости раствор
труднорастворимого электролита
становится насыщенным при очень малых
концентрациях растворенного вещества.
Между
твердой фазой и раствором электролита
устанавливается равновесие, например,
AgCl Ag++CI-
Ag++CI-
твердая насыщенный
фаза раствор
В единицу времени в насыщенный раствор переходит столько ионов, сколько их вновь переходит в осадок. Это состояние равновесия характеризуется величиной константы равновесия
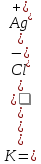
Концентрация твердой фазы – величина постоянная, т.е. [AgCl]тв= const, следовательно, [Ag+][Cl-] также величина постоянная, называемая произведением растворимости (ПР): ПРAgCI=[Ag+]∙[CI-].
Таким образом, в насыщенном растворе труднорастворимого соединения произведение концентраций его ионов при данной температуре есть величина постоянная. При написании ПР необходимо учитывать стехиометрические коэффициенты в уравнении диссоциации соединения, например: ПРAg2CrO4=[Ag+]2[CrO42-]; ПРAg3PO4=[Ag+]3[PO43-];: ПРAg2S3=[Ag+]2[S2-]3.
В общем виде для системы КmAn↔mkn+ nAn, ПР выразится следующим образом: ПРKmAn=[Kn+]m[Am-]n.
Из понятия ПР вытекает условие образования и растворения осадков. Если [Kn+]m[Am-]n= ПРKmAn , система находится в равновесии.
Если [Kn+]m [Am-]n>ПРKmAn или [Kn+]m [Am-]n<ПРKmAn, система стремится к новому состоянии равновесия, приводящему в первом случав к выпадению осадка, во втором - к его растворению. Эти процессы будут происходить до тех пор, пока не будут достигнуты ионные концентрации, соответствующие величине произведения растворимости. В таблице 4 приведены примеры некоторых труднорастворимых веществ.
Таблица 4
Произведение растворимости некоторых труднорастворимых веществ
|
Вещество |
ПР |
Вещество |
ПР |
|
CuS |
6,3∙10-36 |
α- ZnS |
1,6∙10-24 |
|
Cu2S |
25∙10-48 |
β - ZnS |
2,5∙10-22 |
|
HgS |
3∙10-52 |
ZnSe |
1∙10-21 |
Физико-химические свойства растворов электролитов.
Примеры решения задач.
Пример 1. Вычисление кажущейся степени диссоциации сильного электролита.
Вычислить степень диссоциации 0,2 М раствора муравьиной кислоты HCOOH, если Кд=2,1∙10-4.
Решение: По закону разбавления α=√(Кд/См) = √(2,1∙10-4/0,2)=3,24∙10-2 или 3,24%.
Пример 2. Вычисление степени диссоциации электролита по осмотическому давлению его раствора.
Рассчитайте кажущуюся степень электролитической диссоциации ZiCI в 0,1М раствора соли, если раствор изотоничен с 0,19 М раствором сахара С12Н22О11 при 0ºС.
Решение: Моль сахара равен 342 г.
Росм=(mRT)/(M∙V)= (342∙0,19∙8,3144∙273)/ (342∙10-3) = 4,31∙105 Па.
М(ZiCI)=42 г∙моль-1. По осмотическому давлению определяем изотонический коэффициент раствора ZiCI
i=(Pосм∙V)/(nRT)=(4,31∙103∙10-3∙42,39)/(4,239∙8,3144∙273)= 1,19.
Кажущаяся степень диссоциации в 0,1 М ZiCI равна
α=(i-1)/(n-1)=(1,9-1)/(2-1)=0,9 или 90 %.
Пример 3. Вычисление степени диссоциации электролита по понижению давления пара растворителя над раствором.
Давление пара водного раствора NaNO3(ω=0 ,08) равно 2268,8 Па при 20 °С. Давление паров воды при этой температуре равно 2337,8 Па. Найдите кажущуюся степень диссоциации нитрата натрия в этом растворе.
Решение. С помощью первого закона Рауля для электролитов вычисляем значение изотонического коэффициента для NaNO3:
i = (P0-P)∙(N+n)/P0∙n; M(NaNO3) = 85,00 г∙моль-1; n=8:85=0,094 моль; М(Н2О)=18,02 г∙моль-1;
i = (2337,8-2268,9) ∙ (0,094+5,911)/(2337,8∙0,094)=(0,69∙5,199)/219,75 = 1,63.
Кажущаяся степень диссоциации NaNO3 в этом растворе равна
α=(1,63-1)/(2-1) = 0,63 (или 63 %).
Пример 4. Вычисление изотонического коэффициента по повышению температуры кипения раствора.
Раствор, содержащий 8 г NaOH в 1000 г Н2О, кипит при 100,184°С. Определите изотонический коэффициент (для воды Е =-0,516°С).
Решение. Второй закон Рауля для растворов электролитов выражается уравнением ∆t0кип=ι∙ (Кэ∙100∙m)/(mр-ля∙М(р.в)). Тогда
ι = (∆t0кип∙mр-ля*М(р.в))/(Кэ∙m∙1000)= (0,184∙1000∙40)/(0,516∙1000∙8)=1,78.
Ионное произведение воды. Водородный показатель
Электростатическое взаимодействие полярных молекул воды приводит к их самоионизации: 2Н2О↔Н3О++ОН- или в упрощенной форме Н2О↔Н++ОН-;
Константа диссоциации воды весьма мала при 25°С

Принимая поэтому концентрацию воды [Н2О] величиной практически постоянной, можно записать К∙ [Н2О]=[Н+] ∙ [ОН-] = 1,8∙10-16[Н2О]. Но концентрация воды равна 1000/18=55,56 моль∙л-1, отсюда получаем
[Н+]∙[ОН-] = =1,8∙10-16∙55,56=1∙10-14=Кв.
Произведение концентраций ионов водорода и ионов гидроксида называется ионным произведением воды Кв. Ионное произведение воды есть величина постоянная при постоянной температуре. В чистой воде и нейтральных растворах[Н+]=[ОН-]=√10-14=10-7 моль∙л-1.
Математически более удобной характеристикой среды является водородный показатель рН, равный десятичному логарифму концентрации водородных ионов, взятому с обратным знаком: рН = -lg[Н+].
Тогда рН различных растворов будут иметь следующие значения:
кислый рН <7;
нейтральный рН = 7;
щелочной рН >7.
Аналогично, отрицательный десятичный логарифм концентрации гидроксо-ионов называется гидроксильным показателем и обозначается рОН. Следовательно,
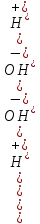
рН + рОН = 14.
Пример 1. Вычисление водородного показателя раствора.
Вычислите водородный показатель рН раствора гидроксида натрия, содержащегося в растворе в концентрации 4,2∙10-3 моль∙л-1 .
Решение. Концентрация ОН- ионов в растворе NaOH равна
[0Н-]=4,2∙10-3моль∙л -1. Исходя из ионного произведения воды Кв, находим концентрацию ионов водорода: [Н+]=КВ/[ОН-]=10-14/4,2∙10-3=0,24∙10-11. Водородный показатель раствора NaOH равен: рН= -lg([Н+])=-lg(0,24∙10-11)=11,62.
Пример 2. Определение концентрации ионов Н+ и ОН- в растворах сильных кислот и оснований.
Определите концентрацию ионов водорода и рН в 0,01 М раствора соляной кислоты.
Решение.
Соляная кислота – сильный электролит,
в растворе полностью диссоциирует
на ионы: НС1 Н+
+ С1-.
Концентрация ионов [Н+]
численно равна концентрации НС1. Из 0,01
моль НС1 образуется 0,01 моль иона Н+.
Отсюда [Н+]
=0,01∙10-2;
рН=-lg(1∙10-2)=2.
Н+
+ С1-.
Концентрация ионов [Н+]
численно равна концентрации НС1. Из 0,01
моль НС1 образуется 0,01 моль иона Н+.
Отсюда [Н+]
=0,01∙10-2;
рН=-lg(1∙10-2)=2.
Пример 3. Вычисление рН сильного электролита с учетом его коэффициента активности.
Найдите водородный показатель раствора НNO3, если его молярная концентрация равна 0,178 моль∙л-1.
Решение. При значительной концентрации сильного электролита его активная концентрация существенно отличается от истинной. Поэтому в таких случаях нужно вводить поправку на активность электролита. Определяем ионную силу раствора НNO3: J= 1/2∙ (0,176∙I2 + 0,178∙I2) = 0,356/2 = 0,178.
Далее по вычисленной ионной силе находим коэффициент активности иона [Н+]= f(Н+)=0.838. Тогда активность ионов [Н+], а (Н+) =0,83∙0,178=0,148. Водородный показатель раствора НNO3 равен: рН = -lg а(Н+) = -lg 0,148=0,83.
Пример 4. Определение концентрации ионов Н+ и ОН- в растворах слабых кислот и оснований.
Концентрации
[Н+]
и
[ОН-]
ионов в растворах слабой кислоты и
слабого основания могут быть вычислены,
если известны их константы диссоциации.
В общем виде формула для вычисления
концентрации [Н+]
в растворе слабой кислоты: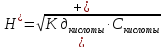
Концентрация
ионов [Н+]и
[ОН-]
в растворе слабого основания может быть
вычислена по формуле:
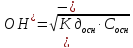 ;
[Н+]=
Кв/[ОН-];
;
[Н+]=
Кв/[ОН-];
 .
.
Определите концентрацию[Н+], [ОН-], рН, рОН, в 0,0М раствора муравьиной кислоты, если Кд(HCOOH)=2,1∙10-4
Решение:
[Н+]=√2,1∙10-4∙3∙10-2 = √6,3∙10-6= 2,5∙10-3 моль∙л-1;
рН= -lg 2,5∙10-3=3-lg 2,5 = 3-0,4= 2,6;
[ОН-]= Кв/[Н+]= 10-14/(2,5∙10-3)=4∙10-12 моль∙л-1;
рОН= 14-рН=14-2,6 = 11,4.
