
- •Г.А. Тихановская, л.М. Воропай, в.В. Кочетова химия
- •Предисловие
- •Введение
- •Основные понятия и законы в химии
- •1.1. Основные химические понятия
- •1.2 Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
- •1.3. Законы газового состояния. Определение молярных масс газообразных веществ
- •2. Строение атома и периодический закон д.И.Менделеева
- •2.1. Этапы на пути создания квантовой механики
- •2.2. Элементы квантово-механической теории атома
- •Характеристика квантовых чисел
- •3. Типы химической связи
- •3.1. Ковалентная связь. Метод валентных связей
- •Возможная геометрическая конфигурация молекул при Sp3 – гибридизации
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4. Водородная связь
- •3.5. Молекулярное взаимодействие
- •4. Общие закономерности протекания и типы химических реакций
- •4.1. Энергетика химических превращений
- •4.1.1. Термохимия. Закон Гесса
- •4.1.2. Энтропия
- •4.1.3. Энергия Гиббса и направленность химических процессов
- •4.2. Химическая кинетика
- •Стандартные теплоты (энтальпии) образования некоторых веществ
- •Стандартная энергия Гиббса образования некоторых веществ
- •Стандартные абсолютные энтропии некоторых веществ
- •4.2.1. Скорость химической реакции
- •4.2.2. Физические методы стимулирования химических превращений
- •4.2.3. Катализ
- •4.3. Химическое равновесие
- •4.3.1. Константа химического равновесия
- •4.3.2. Принцип Ле Шателье
- •5. Дисперсные системы
- •5.1. Способы выражения концентрации растворов
- •5.2. Свойства разбавленных растворов
- •5.3 Растворы электролитов
- •Степень диссоциации различных электролитов
- •5.4. Ионное произведение воды. Водородный показатель
- •5.5 Равновесие в гетерогенных системах, произведение растворимости
- •6. Гидролиз солей
- •Примеры сильных и слабых кислот и оснований
- •6.1. Произведение растворимости. Примеры решения задач
- •7. Жесткость воды
- •8. Окислительно-восстановительные процессы
- •8.1. Электродные потенциалы и электродвижущие силы
- •Стандартные электронные потенциалы(∆е0) некоторых металлов
- •8.2. Электролиз
- •8.3. Коррозия металлов
- •9. Кристаллическое состояние
- •9.1.Основные понятия
- •9.2 Симметрия кристаллов. Система кристаллов
- •9.3. Кристаллические решетки
- •10. Сплавы
- •10.1. Диаграммы состояния металлических систем
- •Библиографический список
- •Произведение растворимости малорастворимых веществ в воде при 25оС
- •Стандартные, окислительно – восстановительные потенциалы ( по отношению к потенциалу стандартного водородного электрода при t 25oC).
- •Термодинамические константы некоторых веществ
- •Оглавление
5.2. Свойства разбавленных растворов
Осмос. Закон Вант-Гоффа. Если между растворителем и раствором поместить полупроницаемую (проницаемую для молекул растворителя) перегородку, то возникает явление осмоса. Объем раствора начнет увеличиваться за счет разбавления его растворителем. При осмосе уровень жидкости в отсеке, содержащем более концентрированный раствор, будет подниматься до тех пор, пока гидростатическое давление избыточного столба жидкости не воспрепятствует переходу молекул растворителя в раствор.
Мерой интенсивности протекания осмоса является осмотическое давление, которое согласно закону Вант-Гоффа (1887г.) зависит от молярной концентрации раствора и температуры:
Росм=СМ∙R∙T,
где R – газовая постоянная, равная 8,31Дж/моль∙К; СМ – молярность.
Осмос играет большую роль в протекании многих природных процессов, так как ткани растительных и животных клеток представляют собой полупроницаемые перегородки, а внутриклеточная жидкость содержит много растворенных веществ.
Давление пара растворителя над раствором (первый закон Рауля).
Важной физико-химической характеристикой растворов является давление пара, определяющее состояние равновесия между конденсированной и газообразной фазами. Чем выше давление пар, тем больше равновесие смещено в сторону процесса испарения. Согласно 1-му закону Рауля относительное понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворённого вещества:
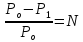 ,
,
где Р0-давление пара чистого растворителя; Р1- давление пара растворителя над раствором; N – мольная доля растворенного вещества.
Температуры кипения и замерзания растворов (второй закон Рауля).
Понижение давления пара над раствором обуславливает изменение температур кипения и замерзания растворов по отношению к чистому растворителю. Жидкость кипит, когда давление ее насыщенного пара становится равным внешнему давлению. Поэтому раствор (вследствие пониженного давления пара) закипает при более высокой, а кристаллизуется при более низкой температуре, чем чистый растворитель.
Согласно 2-му закону Рауля изменение температур кипения и замерзания растворов пропорционально моляльности растворов:
∆tкип=Кэ∙Сm; ∆tзам=Кк∙Сm,
где Кэ –эблуоскопическая («абулио» - кипеть), а Кк – криоскопическая («криос» - холод) константы растворителя. Например, Кэ для воды и бензола соответственно равна 0,52 и 2,57оС, Ккр=1,86 и 5,14оС. Сm-моляльная концентрация.
Для
растворов электролитов концентрация
частиц возрастает за счет диссоциации
молекул на ионы. Вследствие этого
изменяются рассмотренные ниже свойства
растворов на величину поправочного
(изотонического) коэффициента, который
обозначается i.
Изотонический коэффициент зависит от
степени диссоциации α вещества и
определяется уравнением i=I+d∙(n-1),
где n
– число ионов, на которое диссоциирует
молекула вещества. Например, для сульфата
натрия Na2SO4
n=3:
Na2SO4 2Na++SO42-.
i
для растворов неэлектролитов равен I,
для электролитов i>I.
2Na++SO42-.
i
для растворов неэлектролитов равен I,
для электролитов i>I.
Поэтому для растворов электролитов законы Вант-Гоффа и Рауля принимают следующий вид:
Росм=iСМRT; ∆Р/P=i∙N; ∆tкип=i∙Кэ∙Сm; ∆tзам=i∙Ккр∙Cm.
Осмотическое давление разбавленных растворов неэлектролитов
Осмотическое давление прямо пропорционально молярной концентрации раствора (СМ) и абсолютной температуре (Т). Эта зависимость дается уравнением Вант-Гоффа:
Росм=СМRT,
где R – универсальная газовая постоянная, значение которой определяется принятыми единицами измерения. Если давление измерять в Па, а объем в м3, то R=8,3144∙103Дж∙моль-1∙К-1; Т – абсолютная температура.
Поскольку СМ=n/V, то уравнение Вант-Гоффа аналогично уравнению Менделеева-Клапейрона, которое характеризует газовое состояние вещества:
РосмV=nRT
или
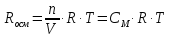
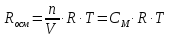
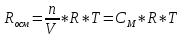 ,
,
где
n
– число молей растворенного вещества;
V
– объем раствора. Заменяя СМ
в выражении Р=СМRT
его выражением по формуле для молярной
концентрации
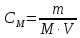
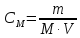 ,
гдеm
– масса растворенного вещества; М –
молярная масса растворенного вещества,
получим формулу, удобную для вычисления
молярной массы растворенного вещества
[2].
,
гдеm
– масса растворенного вещества; М –
молярная масса растворенного вещества,
получим формулу, удобную для вычисления
молярной массы растворенного вещества
[2].
Пример 1. Вычисление осмотического давления растворов. Определить величину осмотического давления раствора, если в 500мл раствора содержится 1,8г глюкозы С4Н12О6 при 25оС.
Решение.
Осмотическое давление раствора определяют
согласно закону Вант-Гоффа:
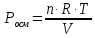
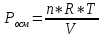 .
В 0,5л раствора содержится 1,8 глюкозы,
молярная масса которой равна 180г∙моль-1.
С
.
В 0,5л раствора содержится 1,8 глюкозы,
молярная масса которой равна 180г∙моль-1.
С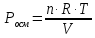 ледовательно,
в 0,5л раствора содержитсяn=1,8∙180=0,01моль
глюкозы.
ледовательно,
в 0,5л раствора содержитсяn=1,8∙180=0,01моль
глюкозы.
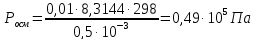
Пример 2. Вычисление молярной массы неэлектролита по относительному понижению давления пара растворителя над раствором.
Навеска
вещества массой 12,42г растворена в воде
объемом 500мл. Давление пара полученного
раствора при 20оС
равно 3732,7Па. Давление пара воды при той
же температуре 3742Па. 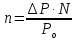 Как
по этим данным найти молярную массу (М)
растворенного вещества?
Как
по этим данным найти молярную массу (М)
растворенного вещества?
Решение. Для определения М надо вычислить n, пользуясь законом Рауля:
 ,
откуда
,
откуда
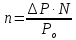
 ,
так как ∆Р=3742-3732,7=9,3Па и
,
так как ∆Р=3742-3732,7=9,3Па и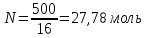 ,
,
то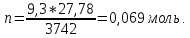
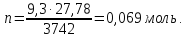
Поскольку
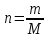 ,
то
,
то
Давление
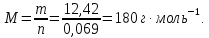
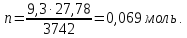 пара
разбавленных растворов неэлектролитов.
Первый закон Рауля.
пара
разбавленных растворов неэлектролитов.
Первый закон Рауля.
Давление пара растворов ниже давления пара чистых растворителей при той же температуре. Понижение давления пара ∆Р, отнесенное к Ро(∆Р/Ро) называют относительным понижением давления насыщенного пара раствора.
Закон
Рауля:
относительное понижение давления
насыщенного пара растворителя над
раствором равно молярной доле растворенного
вещества, т.е.
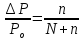 ,
гдеN
и n
– количества растворителя и растворенного
вещества соответственно. Закон Рауля
используют для определения молярной
массы вещества.
,
гдеN
и n
– количества растворителя и растворенного
вещества соответственно. Закон Рауля
используют для определения молярной
массы вещества.
Пример 1. Вычисление давления пара растворителя над раствором. Определите давление пара растворителя над раствором, содержащим 1,212∙1023 молекул неэлектролита в 100г воды при 100оС. Давление пара воды при 100оС равно 1,0133∙105Па.
Решение.
Относительное понижение давления пара
растворителя над раствором согласно
закону Рауля выражается соотношением:
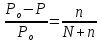 .
Количество растворителяN
и растворенного вещества n
находим:
.
Количество растворителяN
и растворенного вещества n
находим:
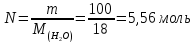 ;
;
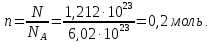
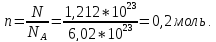
Давление
пара над раствором: 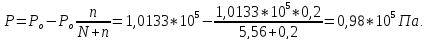
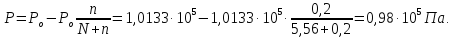
Пример
2.
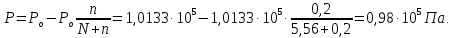
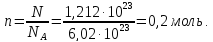 Вычисление
молярной массы неэлектролита по
относительному понижению давления пара
растворителя над раствором.
Вычисление
молярной массы неэлектролита по
относительному понижению давления пара
растворителя над раствором.
Рассчитайте молярную массу неэлектролита, если 28,5г этого вещества, растворенного в 745г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40оС. Давление водяного пара при этой же температуре равно 7375,9 Па.
Решение.
Относительное понижение давления пара
растворителя над раствором равно:
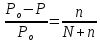 .
Находим:
.
Находим: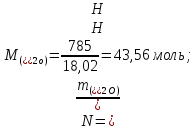
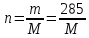 ,
гдеm
– масса неэлектролита, молярная масса
которого М г∙моль-1.
,
гдеm
– масса неэлектролита, молярная масса
которого М г∙моль-1.
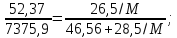 0,309 М + 0,202 = 28,5. 0,309 М = 28,298; М=91,58г∙моль-1.
0,309 М + 0,202 = 28,5. 0,309 М = 28,298; М=91,58г∙моль-1.
Молярная масса неэлектролита равна ≈92г∙моль-1.
Понижение температуры замерзания и повышение температуры кипения растворов. Второй закон Рауля
Растворы замерзают при более низкой температуре, а кипят при более высокой температуре, чем чистый растворитель. Понижение температуры замерзания и повышение температуры кипения раствора пропорционально моляльной концентрации растворенного вещества (второй закон Рауля), т.е.
∆toзам=КК∙С; ∆toкип=КЭ∙С;
где ∆toзам – понижение температуры замерзания раствора; ∆toкип – повышение температуры кипения раствора; КК – криоскопическая константа; КЭ – эбуллиоскопическая константа; С – моляльная концентрация растворенного вещества.
Если «m» граммов неэлектролита, имеющего молярную массу М, растворены в m граммах растворителя, то закон Рауля для неэлектролитов можно записать в следующем виде:
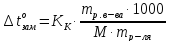
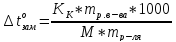 и
и
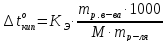
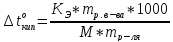
Указанные формулы позволяют находить молярную массу растворенного вещества.
Пример
1.
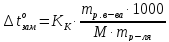
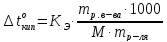 Определение
температуры кипения и замерзания
раствора неэлектролита.
Определение
температуры кипения и замерзания
раствора неэлектролита.
Определите температуру кипения и замерзания раствора, содержащего 1г нитробензола С6Н5NO2 в 10г бензола. Эбуллиоскопическая и криоскопическая константы бензола соответственно равны 2,57 и 51оС.
Решение. По закону Рауля следует, что
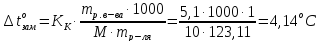
Тогда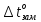 равна
равна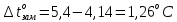
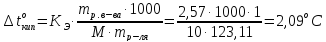
Температура
кипения раствора:
 .
.
Пример 2.Вычисление молярной массы неэлектролита по повышению температуры кипения раствора.
Раствор камфоры массой 0,552г в 17г эфира кипит при температуре на 0,461оС выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16оС. Определите молярную массу камфоры.
Решение. Молярную массу камфоры определяем пользуясь соотношением:
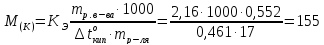
Молярная масса камфоры равна 155,14г∙моль-1.
Пример 3. Вычисление криоскопической константы растворителя. Вычислите криоскопическую константу воды, если водный раствор этилового спирта (ω=0,113) замерзает при -5оС.
Решение. Молярная масса этилового спирта равна 46,07. Из соотношения, приведенного в примере 1, получаем:
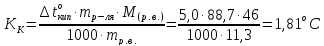
Криоскопическая константа воды КК = 1,81оС.
Пример 4. Вычислите температуры кристаллизации и кипения 2% -ного водного раствора глюкозы.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆Т) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением
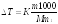 (1)
(1)
где К — криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°; т и М — соответственно масса растворенного вещества и его молярная масса; т1 — масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим по формуле (1):
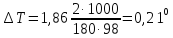
Вода кристаллизуется при 0С, следовательно, температура кристаллизации раствора 0 - 0,21 = - 0,21 С.
По формуле (1) находим и повышение температуры кипения – 2%-ного раствора:
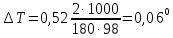
Вода кипит при 100°С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,06°С.
Пример 5. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С. Вычислите эбуллиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения ДТ = 46,529 - 46,3 = = 0,229°. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбуллиоскопическую константу:
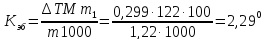
Пример 6. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 0 0С, следовательно, понижение температуры кристаллизации ∆Т=0 – (-0,279)=0,2790С. Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
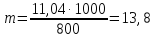
Подставляя в уравнение
 (2)
(2)
числовые значения, вычисляем молярную массу глицерина:
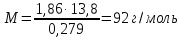
Пример 7. Вычислите массовую долю (%) водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна -0,4650С.
Решение: Температура кристаллизации чистой воды 00С, следовательно, ∆Т = 0 – (-0,465) = + 0,4650. Молярная масса мочевины 60 г/моль. Находим массу m (г) растворенного вещества, приходящуюся на 1000г воды, по формуле (2):
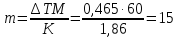
Общая масса раствора, содержащего 15г мочевины, составляет 1000+15=1015г. Процентное содержание мочевины в данном растворе находим из соотношения
В 1015г раствора – 15г вещества
В 100 г раствора – х
х = 1,48%
