
Биохимия растений
.pdf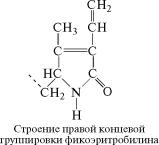
Фикобилины прочно соединяются ковалентными связями со специфическими белками, образуя ф и к о б и л и п р о т е и д ы,
которые имеют максимумы поглощения от 500 до 650 нм. Фико-
билипротеиды, включающие пигмент фикоэритробилин, получ˝и-
ли название фикоэритринов, а белки, содержащие фикоцианоби-
ëèí, — фикоцианинов. Фикобилипротеиды в клетках водорослей находятся в особых гранулах — фикобилисомах, расположенных на
наружной поверхности фотосинтетических мембран.
9.1.1.1.ИНИЦИИРОВАНИЕ СВЕТОМ ПЕРЕНОСА ЭЛЕКТРОНОВ И ПРОТОНОВ В МЕМБРАНАХ ХЛОРОПЛАСТОВ
Âопытах Р. Эмерсона и др. (1957) по изучению действия моно-
хроматического света разной длины волны на интенсивност˝ь фотосинтеза у хлореллы было выяснено, что максимальная скор˝ость
фотохимических реакций наблюдается при одновременном о˝све-
щении этих водорослей красным светом с длинами волн 650 и
680 нм, тогда как эффективность света каждой из указанных длин волн в отдельности оказалась более низкой. Обнаруженное я˝вление в дальнейшем назвали эффектом Эмерсона. Оно позволило
исследователям предположить существование в хлоропласт˝ах двух
взаимодействующих между собой фотохимических систем — ˝I è II, представляющих белково-пигментные комплексы, которые в определенном порядке входят в структуру хлоропластных м˝ембран. С помощью современных методов указанные белково-пиг-˝
ментные комплексы выделены из хлоропластов растений и до˝ста-
точно хорошо изучены.
Âсостав белково-пигментного комплекса фотосистемы I вход˝ят: димер пигмента П700 и мономер хлорофилла à695, образующих
реакционный центр;
светоулавливающий комплекс пигментов (около 300 молекул),
включающий хлорофилл à с максимумами поглощения 675—
695 нм, хлорофилл b и каротиноиды;
железосерные белки, имеющие группировки атомов 4Fe4S.
281
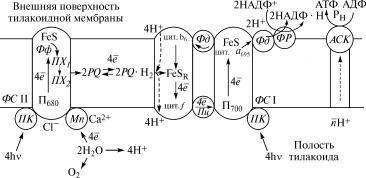
Рис. 9.3. Схема переноса электронов и протонов в тилакоидной˝ мембране хлоропластов:
ÏÊ — пигментные комплексы фотосистем (ÔÑ) I è II; ÏÕ1 — первичный пластохинон; ÏÕ2 — вторичный пластохинон; ÔÐ — фермент ферредоксин-НАДФ-оксидоредуктаза; FeSR— железосерный белок Риске; Ôô — феофетин; Ïö — пластоцианин; Ôä — ферредоксин; ÀÑÊ — АТФсинтетазный комплекс; Рí — неорганический фосфат; FeS — железосерные группировки в˝ составе белковых комплексов фотосистем I и II
Молекулы пигментов светоулавливающего комплекса погло-˝ щают кванты света, переходят в возбужденное состояние и п˝ередают энергию возбуждения с помощью механизма индуктивно˝го резонанса на пигмент П700, входящий в состав реакционного
центра фотосистемы I. Молекула пигмента П700, находящаяся в возбужденном синглетном состоянии, далее взаимодейству˝ет с первичным акцептором электронов хлорофиллом à695, передавая ему один электрон. При этом пигмент П700 переходит в окислен-
ное состояние (П+700), а хлорофилл à695 — в восстановленное (à–695).
Перевод пигмента П700 в исходное восстановленное состояние происходит за счет передачи электрона из фотосистемы II, а у˝ фотосинтезирующих бактерий в качестве источников электро˝нов для восстановления реакционного центра фотосистемы I исполь˝зуются электроны, образующиеся при окислении H2S, H2, углеводородов и других органических веществ.
Восстановленная форма хлорофилла à–695 передает электрон на вторичные акцепторы — железосерные белки, которые, в сво˝ю
очередь, способны восстанавливать водорастворимый желе˝зосерный белок ферредоксин, обладающий подвижностью в жидкой дисперсионной среде на внешней поверхности тилакоидных˝
мембран (рис. 9.3). Далее с участием фермента ферредоксин- НАДФ-оксидоредуктазы, содержащего в качестве кофермента ФАД, осуществляется перенос электронов от восстановленн˝ого
ферредоксина на окисленный НАДФ (НАДФ+), в результате чего
282

происходит образование одного из важнейших продуктов фо˝то-
синтеза — восстановленных динуклеотидов НАДФ (НАДФ · Н˝):
Белково-пигментный комплекс фотосистемы II включает сле-
дующие компоненты:
димер пигмента П680 и феофетин, играющие роль реакционно-
го центра;
светоулавливающий комплекс пигментов, в состав которого˝ входят молекулы хлорофилла à с максимумами поглощения 670—
683 нм, хлорофилл b и каротиноиды;
молекулы пластохинонов, служащие вторичными акцепторам˝и электронов.
Как и в фотосистеме I, молекулы пигментов светоулавливаю-
щего комплекса фотосистемы II поглощают кванты света и пер˝е- дают энергию возбуждения на пигмент П680 в составе реакционно-
го центра, переводя его в возбужденное синглетное состоян˝ие.
Возбужденная молекула П680 становится донором электрона для первичного акцептора — молекулы феофетина, который переходит
в восстановленное состояние и передает электрон на перви˝чный
пластохинон, действие которого как акцептора электрона у˝силивается железосерной группировкой в составе белкового комп˝лекса.
От первичного восстановленного пластохинона электрон п˝ередает-
ся на вторичный пластохинон, который далее взаимодейству˝ет с липидорастворимым переносчиком электронов — димером п˝ласто-
хинона, не связанным с белковым комплексом фотосистемы II.
В хлоропластах растений найдено несколько разновидност˝ей пластохинонов, которые могут функционировать в качестве˝ пере-
носчиков электронов. Все они являются производными бензо˝хи-
нона, содержащего боковой радикал в виде соединенных в це˝пь остатков изопрена, но различаются числом таких остатков и˝ нали-
чием гидроксилированных и ацилированных группировок. Та˝к,
например, пластохинон А имеет следующие строение:
283

Для перевода молекулы пластохинона в восстановленное со˝-
стояние необходимо присоединить два электрона и два прот˝она.
Донором электронов для липидорастворимого пластохинона˝ служит вторичный пластохинон, находящийся в структуре белко˝вого
комплекса фотосистемы II, а протоны присоединяются из стро˝мы
с внешней поверхности тилакоидной мембраны, прилегающей˝ к
той части белкового комплекса, в которой локализован втор˝ич-
ный пластохинон.
Учитывая, что липидорастворимый переносчик электронов
функционирует в виде димера, реакция его восстановления м˝ожет
быть выражена следующим уравнением:
2PQ + 4e + 4H+ ¾¾® 2PQ ·H2
Восстановление в исходное состояние пигмента П680 в реакци-
онном центре фотосистемы II происходит за счет электронов˝, об-
разующихся в результате фотоокисления молекул воды. В это˝м процессе участвуют специфические белки, содержащие кати˝оны
марганца и входящие в структуру белкового комплекса фото˝систе-
мы II. Один из таких белков содержит в активном центре четыр˝е
катиона Mn2+, способных легко переходить в окисленное состояние (Mn3+) и отщеплять от молекул воды электроны, передавая их на другой белковый переносчик, содержащий два атома Mn, который далее осуществляет перенос электронов на окисленн˝ый
пигмент П680, переводя его в исходное восстановленное состоя-
ние. Определено, что активность белка, взаимодействующего˝ с
молекулой воды, зависит от наличия в реакционной среде ионов Са2+ è Cl–.
В результате фотоокисления молекулы воды разлагаются на˝
кислород и катионы Н+ (протоны):
2H2O ¾¾¾®–4e O2 + 4H+
Кислород и протоны выделяются на внутренней поверхности˝
тилакоидных мембран.
284

В передаче электронов от фотосистемы II на фотосистему I принимает участие белково-цитохромный комплекс, содержа˝щий цитохромы b6 è f, а также железосерный белок Риске, имеющий активную группировку 2Fe2S. В составе белково-цитохромного
комплекса есть участок связывания восстановленной форм˝ы липидорастворимого переносчика электронов 2PQ · H2, при взаимо-
действии с которым переносчик подвергается окислению, от˝давая электроны на железосерный белок Риске и высвобождая прот˝оны
на внутренней поверхности тилакоидной мембраны:
2PQ ·H2 ¾¾¾®–4e 2PQ + 4H+
Восстановленный железосерный белок Риске передает элек˝т-
роны на цитохром f, а последний далее восстанавливает водора-
створимый низкомолекулярный (10 500) белок — пластоцианин,
содержащий медь. Атом меди в структуре этого белка соедин˝ен
координационными связями с остатками цистеина, метионин˝а
(через атом S) и гистидина (через азот имидозольной группировки).
Восстановленный пластоцианин способен перемещаться в жидкой дисперсионной среде на внутренней поверхности ти˝лако-
идной мембраны и переносить электроны от белково-цитохро˝м-
ного комплекса на окисленный пигмент П700 в составе реакцион-
ного центра фотосистемы I.
Таким образом, в процессе взаимодействия двух фотосистем˝
под действием света инициируется направленный поток эле˝ктро-
нов, образующихся в результате фотоокисления молекул вод˝ы, к
реакционному центру фотосистемы I, а от него на ферредокси˝н, с участием которого синтезируются восстановленные динукл˝еотиды НАДФ · Н. Рассмотренная выше последовательность перено˝са
электронов получила название нециклического транспорта˝ элект-
ронов при фотосинтезе, который обычно изображается в виде˝ так называемой Z-схемы (рис. 9.4).
Учитывая, что при фотоокислении воды одна молекула кисло-˝ рода (О2) образуется из двух молекул воды, на реакционный центр фотосистемы II переносится четыре электрона, которые возм˝ещают электронную недостаточность, вызванную передачей так˝ого же количества электронов из реакционного центра в электрон˝транспортную цепь при поглощении четырех квантов света пигмен˝т-
ным комплексом данной фотосистемы. Переносимые по элект-
ронтранспортной цепи фотосистемы II четыре электрона пере˝даются далее на реакционный центр фотосистемы I для возмеще˝ния электронной недостаточности, вызванной передачей таког˝о же количества электронов на восстановление НАДФ+ после погло-
285
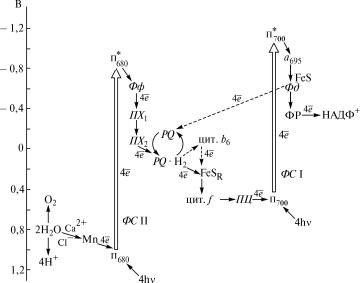
Рис. 9.4. Схема нециклического и циклического переноса элек˝тронов в мембранах хлоропластов (Z-схема)
Сокращенные обозначения такие же, как и на рисунке 9.3. Напра˝вление циклического переноса электронов показано штриховой линией. Слева дана шкала˝ стандартных электродных потенциалов в вольтах при рН 7
щения четырех квантов света пигментным комплексом фотос˝ис-
темы I. Всего при образовании одной молекулы О2 по электрон-
транспортной цепи, образующей Z-схему, осуществляется перенос четырех электронов, который индуцируется при поглоще˝нии
восьми квантов света (4 в фотосистеме I + 4 в фотосистеме II), в˝
результате чего осуществляется синтез двух молекул восс˝тановленного динуклеотида НАДФ · Н.
Следует отметить важную роль реакционных центров, в кото-˝
рых происходит превращение световой энергии, затраченно˝й на возбуждение молекул пигментов, в химическую энергию восс˝та-
новленных переносчиков электронов, возникающих при акце˝пти-
ровании электронов от пигментов П700 è Ï680.
Как было показано ранее, в процессе переноса электронов с˝ участием липидорастворимого пластохинона и белково-цит˝о- хромного комплекса происходит также перенос протонов че˝рез мембрану тилакоида. Протоны акцептирует восстановленны˝й липидорастворимый пластохинон с внешней поверхности тила˝коид-
286
ной мембраны, а их высвобождение происходит при взаимодей˝- ствии восстановленного липидорастворимого пластохинон˝а с бел- ково-цитохромным комплексом уже в той его части, которая о˝б- ращена к внутренней поверхности тилакоидной мембраны. В р˝е-
зультате на ней возникает избыточный положительный заря˝д, тогда как на внешней поверхности — отрицательный, обусловл˝енный
избыточной концентрацией анионов, с которыми были связан˝ы протоны. Кроме того, необходимо учитывать, что во внутренней
полости тилакоидов остаются протоны, образовавшиеся в ре˝-
зультате фотоокисления воды, которые также формируют пол˝о-
жительный заряд на внутренней поверхности тилакоидной мемб-
ðàíû.
Накопление на внешней и внутренней поверхностях тилакои˝д-
ной мембраны разноименных зарядов инициирует образован˝ие
трансмембранного электрохимического потенциала, энерги˝я ко-
торого может быть использована для осуществления эндерг˝они-
ческих реакций синтеза веществ.
Наряду с нециклическим в хлоропластах растений происход˝ит
также и циклический транспорт электронов, который осущес˝твля-
ется с участием белкового комплекса фотосистемы I, белков˝о-ци-
тохромного комплекса с цитохромами b6 è f, а также ферредокси-
на и липидорастворимого пластохинона.
При циклическом транспорте электронов под действием све˝та
электроны из реакционного центра фотосистемы I через втор˝ич-
ные акцепторы — железосерные белки — передаются на фер˝ре-
доксин, который далее, взаимодействуя с белково-цитохромн˝ым
комплексом, переносит их на пластохинон PQ (cм. рис. 9.4). Восстановленный пластохинон акцептирует протоны с внешней˝ поверхности тилакоидной мембраны и присоединяется к той ча˝сти
белково-цитохромного комплекса, где локализованы молеку˝лы цитохрома b6. Передав электроны на молекулы цитохрома b6, пластохинон окисляется и высвобождает протоны на внутренню˝ю поверхность тилакоидной мембраны, инициируя таким образом˝ со-
здание трансмембранного потенциала. От цитохрома b6 электро-
ны далее передаются с участием железосерного белка Риске˝ и цитохрома f на пластоцианин, который, передвигаясь в жидкой фазе на внутренней поверхности тилакоидной мембраны, пер˝е- носит их на окисленный пигмент П700 в реакционном центре
фотосистемы I, переводя его в исходное восстановленное со˝-
стояние.
Таким образом, согласно циклической схеме при поглощении˝ квантов света электроны от возбужденной молекулы пигмен˝та
Ï700 в реакционном центре фотосистемы I передаются последова-
тельно по указанной ранее цепи переносчиков, инициируя об˝ра-
зование трансмембранного потенциала, а затем снова возвр˝аща-
287
ются в реакционный центр. При этом не происходит образова˝ния восстановленных динуклеотидов НАДФ · Н.
Наличие в хлоропластах циклической системы переноса эле˝ктронов можно легко обнаружить, если блокировать с помощью
специального ингибитора дихлорфенилдиметилмочевины передачу электронов в фотосистему I из фотосистемы II. У фотосинтезир˝у-
ющих бактерий фотосистема II отсутствует и поэтому у них фу˝нкционирует только система циклического транспорта элект˝ронов с
участием фотосистемы I.
Белковые комплексы фотосистем I и II неравномерно распре-
делены в хлоропластных мембранах. Белково-пигментный ком˝п-
лекс фотосистемы II преимущественно локализован в мембран˝ах, образующих граны, а более высокая концентрация белково-пи˝г-
ментного комплекса фотосистемы I наблюдается в ламеллах, окру-
женных стромой. Белково-цитохромный комплекс равномерно˝ ло-
кализован как в гранах, так и в ламеллах, не образующих структуру
гран. Перенос электронов между белковыми комплексами осу˝ществляют молекулы липидорастворимого пластохинона, а так˝же во-
дорастворимых белков ферредоксина и пластоцианина, спос˝обных
перемещаться на поверхности мембран в жидкой фазе — стро˝ме.
Определенной подвижностью обладают и белковые комплек-
сы, которые могут подвергаться фосфорилированию, в резуль˝тате чего при диссоциации протонов возрастает их отрицательн˝ый за-
ряд, вызывающий перемещение белкового комплекса к внутре˝н-
ней поверхности мембраны, имеющей положительный заряд. Та˝-
кое перемещение в составе мембран белкового комплекса фо˝тоси-
стемы II способствует более быстрому переносу электронов ˝на реакционный центр фотосистемы I. Фосфорилирование белковых˝ комплексов катализируют ферменты киназы, которые активи˝ру-
ются восстановленным пластохиноном и ингибируются его о˝кисленной формой. В результате отщепления под действием соот˝ветствующих фосфатаз остатков фосфорной кислоты от белково˝го комплекса уменьшается его отрицательный заряд и он возвр˝аща-
ется в исходное состояние, после чего может снова подверг˝аться
фосфорилированию.
9.1.1.2. ФОТОФОСФОРИЛИРОВАНИЕ
Кроме восстановленных динуклеотидов НАДФ · Н важнейшим
продуктом фотохимических реакций является АТФ. В опытах с˝
изолированными хлоропластами растений было показано, чт˝о под действием света у них индуцируется синтез АТФ из АДФ и нео˝р-
ганического фосфата:
ÀÄÔ + Í3ÐÎ4 ¾¾¾¾¾¾®Ñâåò ÀÒÔ + Í2Î
Хлоропласты
288
В отсутствие света фосфорилирование АДФ не происходило. Исходя из этого, исследователи сделали вывод, что эндерго˝ническая реакция синтеза АТФ ( G°′ = 30,6 кДж/моль) сопряжена с использованием энергии поглощенных хлоропластами квантов˝ све-
та. Сопоставление стандартных окислительно-восстановит˝ельных потенциалов компонентов электронтранспортной цепи в ме˝мбра-
нах хлоропластов (табл. 9.1) показывает, что такой сопряженн˝ый синтез АТФ возможен. Разница стандартных окислительно-во˝с-
становительных потенциалов П680 первичного донора электронов
реакционного центра фотосистемы II и à695 первичного акцептора
электронов фотосистемы I составляет более 1,8 В, что обеспеч˝ива-
ет перепад в изменении свободной энергии более 170 кДж · моль–1, тогда как в стандартных условиях для образования 1 моля ма˝кро-
эргических связей при фосфорилировании АДФ затрачивает˝ся
30,6 кДж свободной энергии.
9.1. Окислительно-восстановительные потенциалы основных к˝омпонентов цепи переноса электронов в хлоропластах (восстановленные фор˝мы)
Kомпоненты электронтранспортной цепи |
Å°′, B |
|
|
Ï680 — донор электронов в реакционном центре |
+1,12 |
фотосистемы II |
|
Феофетин — первичный акцептор электронов |
–0,61 |
в реакционном центре фотосистемы II |
|
Первичный пластохинон в белковым комплексе |
–0,13...–0,3 |
фотосистемы II |
|
Вторичный пластохинон в белковом комплексе |
–0,01 |
фотосистемы II |
|
Липидорастворимые пластохиноны |
0…+0,1 |
Железосерный белок Риске |
+0,32 |
Цитохром f |
+0,36—0,40 |
Пластоцианин |
+0,37 |
Ï700 — донор электронов в реакционном центре |
+0,40—0,45 |
фотосистемы I |
|
à695 — первичный акцептор электронов в реакционном |
–0,73 |
центре фотосистемы I |
|
Железосерные белки в фотосистеме I |
–0,50—0,55 |
Ферредоксин |
–0,43 |
Ферредоксин-НАДФ-оксидоредуктаза |
–0,36 |
Цитохром b6 |
–0,18…+0,1 |
Однако при этом возникает вопрос: каким путем происходит
превращение поглощенной при фотосинтезе световой энерг˝ии в химическую энергию макроэргических связей АТФ? В наиболь˝-
шей степени механизм указанного превращения объясняет хемиосмотическая гипотеза, разработанная английским биохимиком
П. Митчеллом в 1961—1966 гг. Большинство положений этой ги-
потезы подтверждено экспериментами. Применение хемиосм˝оти-
289
ческой гипотезы для объяснения механизма фотофосфорилирования было предложено в 1967 г. А. Ягендорфом и в настоящее вре-
мя получило признание большинства исследователей.
Согласно хемиосмотической гипотезе эндергонический про˝- цесс фосфорилирования АДФ с участием неорганического фо˝сфата в хлоропластах растений сопряжен с использованием эне˝ргии
трансмембранного электрохимического потенциала, которы˝й об-
разуется при переносе электронов, индуцируемом в результ˝ате поглощения квантов света.
Процесс образования АТФ из АДФ и неорганического фосфата˝
катализирует АТФ-синтетазный белковый комплекс, получив˝ший название сопрягающего фактора. Он состоит из 19 белковых субъе-
диниц пяти типов, которые содержат участки связывания АДФ˝ и
неорганического фосфата. Сопрягающий фактор имеет глобу˝лярную структуру и локализован на внешней поверхности тилак˝оид-
ной мембраны. С ним связан другой белковый комплекс, выпол˝-
няющий функцию ионного канала, через который по концентра˝- ционному градиенту осуществляется транспорт катионов в˝одоро-
äà Í+ из внутреннего пространства тилакоида на его поверхность.
Проходя через ионный канал, катионы водорода попадают в АТФ-синтетазный комплекс и, активируя его, инициируют син˝тез
ÀÒÔ (ñì. ðèñ. 9.3).
Функционирование АТФ-синтетазного комплекса было прове˝- рено в экспериментах с изолированными от организма мембр˝ан-
ными структурами. Так, в одном из опытов использовали иску˝сст-
венные мембраны, образованные из выделенных растительны˝х фосфолипидов. С такими искусственными мембранными струк-
турами связывали АТФ-синтетазу с соответствующим ионным˝ каналом, выделенную из животных тканей, а в качестве хрома˝тофора вводили бактериородопсин, который, поглощая кванты света, инициировал создание протонного градиента. Под его˝ действием АТФ-синтетазный комплекс катализировал синте˝з АТФ из добавленных в искусственную среду АДФ и неоргани- ческого фосфата.
При рассмотрении процессов фотофосфорилирования возни-˝ кает также вопрос о количестве АТФ, синтезируемой в расче˝те на единицу поглощенной световой энергии или на 1 моль выделя˝ю- щегося в ходе фотосинтеза кислорода. Как было указано ран˝ее, при функционировании системы нециклического транспорта˝
электронов одна молекула кислорода (О2) образуется из двух мо-
лекул воды, подвергшихся фотоокислению. При этом внутри т˝и-
лакоида остаются четыре протона (4Н+), а по электронтранспортной цепи фотосистем II и I осуществляется перенос четырех эл˝ек-
тронов, который инициируется в результате поглощения пиг˝мент-
290
