
Биохимия растений
.pdfными комплексами фотосистем I и II восьми квантов света (по четыре кванта каждой фотосистемой).
В процессе переноса указанных четырех электронов по элек˝т-
ронтранспортной цепи от белково-пигментного комплекса ф˝отосистемы II на белково-цитохромный комплекс происходит вос˝- становление и затем окисление липидорастворимого пласт˝охино-
на, которое сопряжено с переносом четырех протонов из вне˝шне-
го матрикса во внутреннюю полость тилакоида. Таким образо˝м, в результате переноса четырех электронов по системе нецик˝личес-
кого транспорта во внутренней полости тилакоида накапли˝вается
восемь протонов, которые создают трансмембранный электр˝охимический потенциал. Как только энергия этого потенциала д˝ости-
гает определенной величины, начинает функционировать бе˝лко-
вый ионный канал, по которому протоны движутся из внутрен˝ней полости тилакоида на внешнюю его поверхность, предотвращ˝ая
дальнейшее увеличение трансмембранного потенциала.
Из ионного канала протоны поступают в АТФ-синтетазный белковый комплекс и в нем инициируют фосфорилирование АД˝Ф
с участием неорганического фосфата:
ÀÄÔ + Í3ÐÎ4 → ÀÒÔ + Í2Î
Непосредственный механизм образования АТФ пока еще
окончательно не установлен. Наиболее вероятно, что на каж˝дые два протона, поступающие в АТФ-синтетазный комплекс по ио˝н- ному каналу, может синтезироваться одна молекула АТФ. Есл˝и же учитывать, что в ходе образования одной молекулы О2 во внутрен-
ней полости тилакоида накапливается восемь протонов, а по˝ электронтранспортной цепи переносится четыре электрона, то с˝огласно указанному количественному выходу возможен синтез че˝тырех
молекул АТФ.
Однако не все протоны, выходящие через ионный канал на внешнюю поверхность тилакоида, участвуют в образовании АТФ, часть из них затрачивается на синтез восстановленных˝ динуклеотидов НАДФ · Н, поэтому реальный выход АТФ при нециклическом транспорте электронов в расчете на одну моле˝кулу образующегося О2 составляет не четыре молекулы, а три или
даже меньше.
Дополнительное количество АТФ в системе фотофосфорили-
рования может синтезироваться за счет функционирования˝ цик-
лического транспорта электронов, в ходе которого также ос˝уществляется перенос протонов из внешнего матрикса во внутр˝еннюю полость тилакоидов, вызывающий возникновение трансмемб˝ранного электрохимического потенциала, способного инициир˝овать
291
синтез макроэргических фосфатных связей АТФ в результат˝е фосфорилирования АДФ с участием неорганического фосфата.
Образовавшиеся в ходе фотохимических реакций биоэнерге˝ти-
ческие продукты фотосинтеза НАДФ · Н и АТФ далее использ˝у- ются в фотосинтезирующих клетках в процессах синтеза угл˝еводов и различных неуглеводных продуктов при осуществлении др˝угих
эндергонических процессов, происходящих в листьях расте˝ний
или в клетках других фотосинтезирующих организмов.
9.1.2.ТЕМНОВАЯ СТАДИЯ ФОТОСИНТЕЗА
Âходе темновых реакций фотосинтеза происходит эндергон˝и-
ческий процесс образования углеводов из диоксида углеро˝да
(ÑÎ2) и воды, в котором в качестве энергетических источников
используются продукты световых реакций НАДФ · Н и АТФ. Пос-
ледовательность химических превращений в темновой стад˝ии фотосинтеза была выяснена американскими биохимиками М. Ка˝ль-
вином, А. Бенсоном и Д. Басхемом в 1946—1953 гг. и впоследствии
названа циклом Кальвина, поскольку открытые ими превраще˝ния носили циклический характер. Все эти реакции протекают в ˝строме — жидкой дисперсионной среде хлоропластов.
Для установления первичных продуктов, которые образуютс˝я
при фотосинтезе из СО2 è Í2О, М. Кальвин и его сотрудники ис-
пользовали культуру водорослей хлореллы, в которую вводи˝ли на
свету СО2, меченный 14Ñ, â âèäå Í214ÑÎ3, через короткие промежутки времени отбирали пробы клеток суспензии водоросле˝й и
фиксировали их метанолом. После этого из клеток хлореллы ˝выделяли углеводы и другие органические вещества и определяли в них наличие радиоактивной метки, обусловленной включени˝ем в эти продукты 14С. При этом было установлено, что при коротких экспозициях клеток водорослей в суспензионной среде (0,1—5 ˝с),
содержащей 14ÑÎ2, большая часть радиоактивной метки обнаруживалась в карбоксильной группе 3-фосфоглицериновой кисл˝оты. Последнее свидетельствовало о том, что фосфоглицеринова˝я кислота является первичным продуктом фотосинтеза.
Âдальнейшем с использованием радиоактивной метки в виде˝ 14Ñ è 32Р было показано, что первичным акцептором, с которым
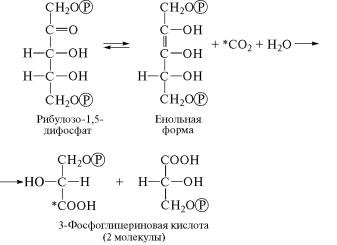
взаимодействует СО2, служит рибулозо-1,5-дифосфат è ÷òî ýòó ðå-
акцию катализирует фермент рибулозодифосфаткарбоксилаза
(4.1.1.39). Учитывая, что для образования карбоксильной группы
кроме СО2 требуется еще молекула воды, первую реакцию цикла Кальвина можно записать следующим образом:
292
(1)
Диоксид углерода в ходе реакции взаимодействует с енольн˝ой формой рибулозо-1,5-дифосфата, при этом образуется неустойч˝и- вый продукт — β-кетокислота, который под действием фермента гидролизуется, превращаясь в 3-фосфоглицериновую кислоту˝. При этом радиоактивный углерод обнаруживается в карбокс˝ильной группе одной из двух синтезирующихся молекул 3-фосфог˝ли- цериновой кислоты.
Фермент рибулозодифосфаткарбоксилаза в большом количе-˝
стве содержится в хлоропластах растений (до 16 % общего количе- ства белков), а также в клетках зеленых и пурпурных бактери˝й. Он состоит из восьми пар неидентичных субъединиц и имеет бол˝ь-
шую молекулярную массу (560 000). Для проявления каталитичес-
кой активности этого фермента необходимо присутствие ка˝тионов Mg2+.
Рибулозодифосфаткарбоксилаза аллостерически активиру˝ется фруктозо-6-фосфатом и аллостерически ингибируется фрукто˝зо-
1,6-дифосфатом, которые образуются при последующих превра-
щениях в цикле Кальвина 3-фосфоглицериновой кислоты, явля˝ю-
щейся продуктом действия данного фермента. Образовавшая˝ся
под действием рибулозодифосфаткарбоксилазы 3-фосфоглиц˝ери- новая кислота в последующих реакциях восстанавливается˝ до альдегида.
Вначале молекула 3-фосфоглицериновой кислоты активирует˝-
ся путем фосфорилирования с участием АТФ. Эту реакцию катализирует фермент фосфоглицераткиназа (2.7.2.3), включающий 355 аминокислотных остатков и активируемый катионами Мg2+:
293

 (2)
(2)
Продукт реакции 1,3-дифосфоглицериновая кислота — мак-
роэргическое соединение, характеризующееся высоким зна˝чени-
ем потенциала переноса фосфатной группы (при гидролизе G°′ = –49 êÄæ · ìîëü–1), в связи с чем оно легко подвергается
восстановлению в следующей реакции под действием фермен˝та
триозофосфатдегидрогеназы (1.2.1.9) с участием восстановленной
формы динуклеотида НАДФ · Н:
(3)
В ходе восстановительной реакции происходит синтез 3-фос-
фоглицеринового альдегида и отщепление от 1,3-дифосфоглиц˝е-
риновой кислоты минерального фосфата. Участвующие в синт˝езе 3-фосфоглицеринового альдегида АТФ и НАДФ · Н являются пр˝о-
дуктами световой стадии фотосинтеза.
Как было показано ранее, в результате связывания одной мо˝ле-
êóëû ÑÎ2 в первой реакции цикла Кальвина образуются две молекулы 3-фосфоглицериновой кислоты, которые в ходе реакций (2˝) и (3) превращаются в две молекулы 3-фосфоглицеринового альд˝е- гида, а последние довольно легко изомеризуются в фосфодио˝кси-
ацетон. Реакцию изомеризации катализирует фермент триозофосфатизомераза (5.3.1.1):
(4)
294
Представленная реакция легко обратима, так как сопровожд˝а- ется небольшим изменением свободной энергии. Фермент три˝- озофосфатизомераза отличается высокой молярной активно˝стью (2800 кат · моль–1 фермента для превращения в фосфодиокси-
ацетон).
Образовавшиеся триозофосфаты не накапливаются в хлороп˝ла-
стах. Под действием фермента альдолазы (4.1.2.13) они конденсируются, превращаясь во фруктозо-1,6-дифосфат:
(5)
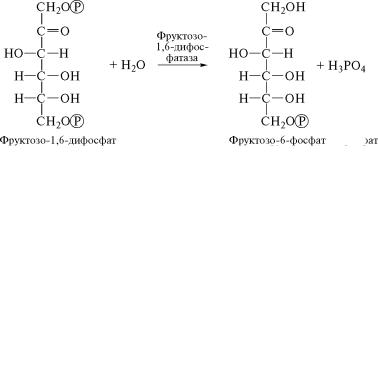
После этого от фруктозо-1,6-дифосфата происходит гидроли-
тическое отщепление остатка фосфорной кислоты. Реакцию к˝атализирует фермент фруктозо-1,6-дифосфатаза (3.1.3.11). Â õîäå
этой реакции фруктозодифосфат превращается во фруктозо˝-6-
фосфат:
(6)
Фруктозо-1,6-дифосфатаза — фермент, активируемый светом.
Его активирование происходит с участием восстановленно˝го под
действием света ферредоксина, который совместно со специ˝фи- ческим белком переводит фруктозо-1,6-дифосфатазу в активно˝е состояние. От действия этого фермента зависит интенсивность
включения СО2 в первой реакции цикла Кальвина. Если актив-
ность фруктозо-1,6-дифосфатазы низкая, то повышается концен˝т-
рация фруктозо-1,6-дифосфата, который аллостерически ингиб˝и-
295
рует фермент рибулозодифосфаткарбоксилазу, вследствие ˝чего понижается скорость первой реакции цикла Кальвина, катал˝изируемой данным ферментом. Если же фруктозо-1,6-дифосфатаза находится в активной форме, то повышается концентрация фр˝ук-
тозо-6-фосфата, являющегося аллостерическим активатором р˝и- булозодифосфаткарбоксилазы. При таких условиях связыва˝ние
ÑÎ2 проходит с максимальной скоростью.
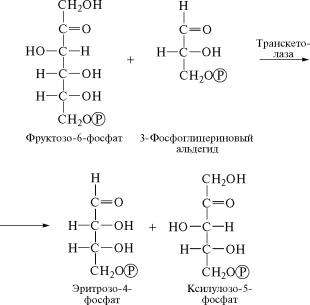
На следующем этапе фотосинтеза фермент транскетолаза
(2.2.1.1) катализирует перенос концевого двууглеродного ради-˝
кала, содержащего кетонную группу, от фруктозо-6-фосфата на˝
3-фосфоглицериновый альдегид, который образуется в резуль˝тате
присоединения к рибулозо-1,5-дифосфату еще одной молекулы СО2 и повторения реакций (2) и (3). В результате взаимодействия
гексозы и триозы синтезируются новые углеводные продукт˝ы —
эритрозо-4-фосфат и ксилулозо-5-фосфат:
(7)
Еще одна молекула 3-фосфоглицеринового альдегида, синтези˝-
рованная в результате связывания второй молекулы СО2, изоме-
ризуется далее в реакции (4) в фосфодиоксиацетон, который з˝атем
соединяется с эритрозо-4-фосфатом, образуя седогептулозо-˝1,7-
296
дифосфат. Эту реакцию катализирует фермент трансальдолаза (2.2.1.2):
(8)
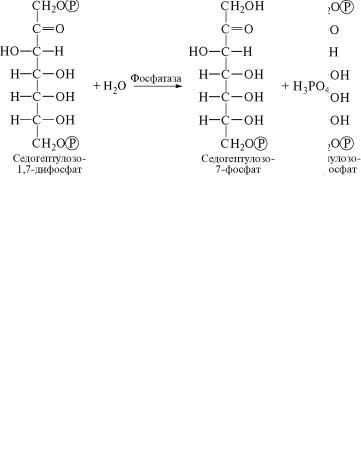
В следующей реакции происходит гидролиз седогептулозо-1,7˝-
дифосфата, который катализирует специфическая фосфатаза. В ходе реакции от седогептулозо-1,7-дифосфата отщепляется ос˝та-
ток фосфорной кислоты и таким образом осуществляется син˝тез
седогептулозо-7-фосфата:
(9)
После этого снова вступает в действие фермент транскетол˝аза, катализирующий перенос двууглеродного радикала с кетог˝руппой от седогептулозо-7-фосфата на 3-фосфоглицериновый альдеги˝д,
который синтезируется за счет связывания в первой реакци˝и цик-
ла Кальвина уже третьей молекулы СО2. Продукты реакции, ката-
лизируемой транскетолазой, — пятиуглеродные производные мо-
носахаридов ксилулозо-5-фосфат и рибозо-5-фосфат:
297
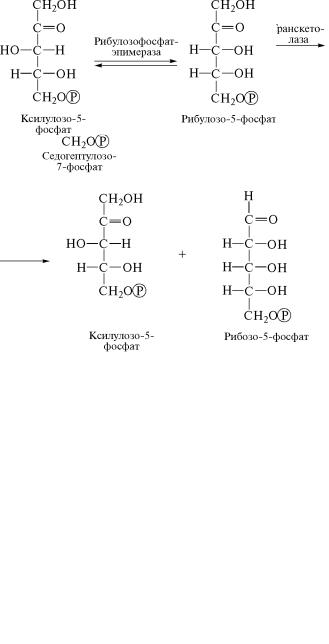
(10)
В последующих реакциях цикла Кальвина осуществляется из˝о- меризация фосфорнокислых производных пентоз, которая об˝ес-
печивает регенерацию первичного акцептора СО2 — рибулозо-1,5-
дифосфата. Образовавшиеся в реакциях (7) и (10) молекулы кси-
лулозо-5-фосфата превращаются в рибулозо-5-фосфат под действием фермента рибулозофосфатэпимеразы (5.1.3.1), который способен изменять на противоположную пространственную ˝ориентацию водорода и гидроксильной группы у третьего углер˝одно-
го атома пентозы:
(11)
298
Превращение рибозо-5-фосфата в рибулозо-5-фосфат катализирует фермент рибозофосфатизомераза (5.3.1.6):
(12)
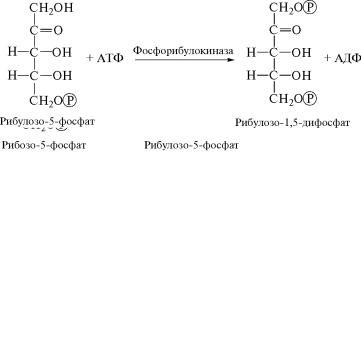
Окончательную регенерацию первичного акцептора СО2 îñó-
ществляет фермент фосфорибулокиназа (2.7.1.19), катализирующий
фосфорилирование от АТФ рибулозо-5-фосфата:
(13)
В ходе указанных ранее 13 реакций происходит включение в состав углеводных производных трех молекул СО2 и потребление трех молекул первичного акцептора рибулозо-1,5-дифосфата, п˝ри
этом осуществляется синтез шести молекул 3-фосфоглицерин˝ово-
го альдегида, из которых пять затрачиваются на регенераци˝ю трех молекул рибулозо-1,5-дифосфата и одна молекула 3-фосфоглице-˝ ринового альдегида остается как продукт темновой стадии˝ фотосинтеза. Ее синтез сопряжен с использованием биоэнергети˝ческих
продуктов световой стадии фотосинтеза АТФ и НАДФ · Н.
Восстановленные динуклеотиды НАДФ · Н участвуют в реак˝- ции (3) цикла Кальвина, которая в ходе синтеза шести молекул˝
3-фосфоглицеринового альдегида повторяется 6 раз, следова˝тельно, в этих реакциях используется шесть молекул восстановл˝енных
динуклеотидов НАДФ · Н. АТФ участвует в реакции (2), котора˝я,
как и реакция (3), повторяется 6 раз, и в реакции (13), которая при˝
299
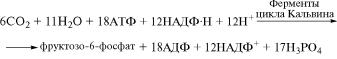
синтезе трех молекул первичного акцептора СО2 рибулозо-1,5-ди- фосфата повторяется 3 раза. Всего при связывании трех моле˝кул СО2 и восстановлении их до уровня 3-фосфоглицеринового альдегида потребляется девять молекул АТФ.
Однако 3-фосфоглицериновый альдегид не накапливается в хлоропластах, он используется для синтеза гексозы. Часть ˝молекул
3-фосфоглицеринового альдегида изомеризуется в фосфодио˝ксиацетон, который далее под действием альдолазы конденсиру˝ется с
оставшимися молекулами 3-фосфоглицеринового альдегида, и˝ таким образом осуществляется синтез фруктозо-1,6-дифосфата.
После гидролиза этого соединения с участием фруктозо-1,6-ди˝- фосфатазы образуется фруктозо-6-фосфат. Если учесть, что дл˝я
синтеза фруктозо-6-фосфата потребуется связывание шести м˝олекул СО2 в первой реакции цикла Кальвина и все вышеуказанные превращения, связанные с синтезом одной молекулы 3-фосфог˝ли- церинового альдегида, должны повториться еще раз, суммарн˝ое
уравнение темновой стадии фотосинтеза может быть записа˝но в следующем виде:
В опытах с использованием СО2, меченного 14С, было показано, что в течение 1—3 мин после экспозиции растений в атмосф˝е- ре 14ÑÎ2 все промежуточные продукты цикла Кальвина насыщаются меченым углеродом, а при более длительных экспозиция˝х 14С обнаруживается уже в составе сахарозы, крахмала, органи˝чес-
ких кислот, аминокислот, липидов, белков и других органиче˝ских веществ хлоропластов.
Следует отметить, что из всех реакций цикла Кальвина толь˝ко первая и последняя (13) специфичны для фотосинтезирующих клеток, тогда как другие реакции могут протекать в любых д˝ругих клетках и тканях фотосинтезирующих организмов в ходе син˝теза, распада и превращений углеводов. При этом промежуточные м˝е-
таболиты, образующиеся в цикле Кальвина, выводятся из это˝го
цикла и потребляются для синтеза различных органических˝ веществ в хлоропластах и листьях растений. Конечный продукт˝ цикла Кальвина фруктозо-6-фосфат также включается в биосинте˝ти-
ческие реакции, происходящие в фотосинтезирующих тканях, или
превращается в транспортные формы, которые по флоэме пост˝у-
пают в акцепторные органы растений.
300
