
Биохимия растений
.pdf
способен присоединять два электрона и два протона и превр˝а- щаться в восстановленную форму:
Окисленную форму убихинона принято записывать в виде сим˝- вола КоQ или Q, восстановленную — КоQ · Н2.
Большинство ферментов электронтранспортной цепи мито-
хондрий связаны c их внутренней мембраной, плотность кото˝рой выше, чем у внешней мембраны, и содержит в своем составе бол˝ь-
ше белков и меньше фосфолипидов (значение отношения фосф˝о-
липиды : белки примерно равно 0,27). В отличие от легкопрониц˝а- емой внешней мембраны внутренняя мембрана митохондрии н˝е-
проницаема для многих соединений (за исключением нейтрал˝ь- ных молекул с молекулярной массой менее 150).
Путем фрагментирования физическими и химическими методами внутренней мембраны митохондрий исследователям-би˝охи- микам удалось выделить четыре ферментных комплекса, кото˝рые катализируют перенос электронов и протонов на определен˝ных участках электронтранспортной цепи митохондрий. Перенос электронов и протонов между этими связанными с мембранам˝и ферментными комплексами осуществляют подвижные перенос˝- чики — убихинон и цитохром c. Ферментные комплексы I, II и III пронизывают внутреннюю митохондриальную мембрану и
способны осуществлять перенос через мембрану протонов, со-
здавая таким образом трансмембранный электрохимический˝ по-
тенциал.
Ферментный комплекс I осуществляет перенос электронов и
протонов от НАД · Н, образующихся в цикле Кребса, на кофер-
341
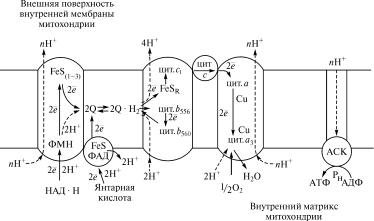
.
Рис. 9.8. Схема переноса электронов и протонов по системе пе˝реносчиков, локализованных во внутренней мембране митохондрий:
FeS(1–3) — железосерные белки ферментного комплекса I; ФМН — акц˝ептор электронов и протонов от НАД · Н в составе ферментного комплекса I; ФАД — ˝акцептор электронов и протонов от янтарной кислоты в составе ферментного комплекса II; FeS —˝ железосерные белки ферментного комплекса II (FeS*1–3); FeSR — железосерный белок Риске в составе ферментного комплекса III; цит. b556, öèò. b560, öèò. c1 — цитохромы в составе ферментного комплекса III; цит. à, öèò. à3 — цитохромы в составе ферментного комплекса IV; 2Q €2Q · H2 — липидорастворимый переносчик электронов и протонов (убихинон); цит. c — водорастворимый переносчик электронов (цитохром ñ); АСК — АТФ-синтетазный комплекс
мент Q. Передача двух электронов и двух протонов происходи˝т со стороны внутреннего матрикса митохондрии на флавинмоно˝нуклеотид (ФМН), входящий в состав ферментного комплекса I (рис. 9.8). Затем электроны передаются с участием FeS-белков от ФМН · Н2 на димер убихинона 2Q, а протоны высвобождаются на внешней стороне митохондриальной мембраны.
Окисленный убихинон, приняв электроны от FeS-белка, присоединяет два протона из внутреннего матрикса и превраща˝ется в восстановленную форму 2Q · Н, которая диффундирует через ˝липидную фазу митохондриальной мембраны к ферментному ком˝п- лексу III.
В составе ферментного комплекса III имеются цитохромы ñ1, b556 è b560, а также железосерный белок Риске (FeSR). Этот ферментный комплекс переносит электроны от восстановленно˝го
убихинона на цитохром ñ и одновременно выполняет функцию Н+-помпы, т. е. осуществляет трансмембранный перенос прото-˝
нов. При взаимодействии с ферментным комплексом III восста-
новленная форма убихинона 2Q · Н акцептирует два электрон˝а от
342
цитохрома b560 и в таком состоянии становится способной присоединить два протона из внутреннего матрикса митохондрии˝, превращаясь в восстановленную форму 2Q · Н2. Полностью восстановленный кофермент Q передает два электрона цитохрому b556 è
два электрона железосерному белку FeSR, который далее передает их цитохрому ñ1. Цитохром b556, приняв два электрона от восста-
новленного кофермента Q, переводит далее в восстановленно˝е состояние цитохром b560, который снова может быть донором элект-
ронов для восстановления подвижного переносчика электр˝онов и
протонов — убихинона.
В процессе передачи электронов от восстановленного убих˝ино-
íà 2Q · Í2 на цитохром ñ с участием ферментного комплекса III происходит высвобождение четырех протонов с внешней сто˝роны
внутренней мембраны митохондрии, что приводит к созданию˝ оп-
ределенной величины трансмембранного электрохимическо˝го по-
тенциала. Таким образом, с участием цитохромов b560 è b556 оказы-
вается возможным при переносе каждой пары электронов и пр˝о- тонов от ферментного комплекса I на цитохром ñ присоединение
из внутреннего матрикса и перенос через мембрану двух доп˝олни-
тельных протонов. После передачи электронов и протонов на˝
ферментный комплекc III восстановленный убихинон превраща˝-
ется в окисленную форму и может снова диффундировать чере˝з липидную фазу митохондриальной мембраны к ферментному
комплексу I (или II) и акцептировать новую пару электронов и
протонов и далее осуществлять их перенос на ферментный ко˝мп-
ëåêñ III è ò. ä.
Ферментный комплекс II катализирует окисление янтарной кислоты с участием кофермента ФАД и передает электроны ок˝исленному убихинону. Передачу электронов от ФАД · Н2 на убихинон
выполняют железосерные группировки FeS*1—3. Поскольку ферментный комплекс II не пересекает внутреннюю мембрану мит˝о- хондрии, высвобождающиеся при окислении ФАД · Н2 протоны остаются во внутреннем матриксе митохондрии и поэтому не˝ ис-
пользуются для создания трансмембранного электрохимиче˝ского
потенциала. Однако при переносе каждой пары электронов от˝ ФАД · Н2 на цитохром ñ ферментный комплекс III осуществляет трансмембранный перенос двух протонов.
Функцию переноса электронов от ферментного комплекса III к˝
ферментному комплексу IV выполняет водорастворимый белок˝
цитрохром ñ, который способен перемещаться на внешней поверхности внутренней митохондриальной мембраны в жидкой физ˝иологической среде, заполняющей пространство между внешне˝й и
внутренней мембранами митохондрии. Цитохром ñ акцептирует
электроны от цитохрома ñ1, находящегося в составе ферментного
комплекса III, и, перемещаясь в жидкой дисперсионной среде н˝а
343
внешней поверхности внутренней митохондриальной мембра˝ны, передает их цитохрому à в составе ферментного комплекса IV, который кроме гемовой группировки содержит еще атом меди, у˝ча- ствующий в переносе электронов. Восстановленный цитохро˝мà
передает электроны цитохрому à3, в составе которого наряду с гемом активную роль в транспорте электронов выполняет атом˝
меди. Восстановленный цитохром à3, связывая кислород, ионизирует его атомы, отдавая им переносимые по цепи переносчик˝ов
электроны. Ионизированные атомы кислорода, взаимодейств˝уя с
протонами внутреннего митохондриального матрикса, обра˝зуют
молекулы воды: О2–+2Í+ → Í2Î.
Ферментный комплекс IV при переносе электронов от цитохрома ñ на кислород выполняет вместе с тем электрохимическую
работу по переносу протонов из внутреннего митохондриал˝ьного
матрикса на внешнюю поверхность внутренней мембраны мит˝о-
хондрии.
В растительных клетках (в отличие от животных) с участием ферментов митохондрий происходит также окисление НАД ·˝ Н,
поступающих из цитоплазмы. В этом процессе участвуют флав˝и-
новые дегидрогеназы, локализованные как во внешней, так и˝ во
внутренней мембране митохондрии. Первые из них передают
электроны от НАД · Н, поступающих из цитоплазмы, на цитохром ñ, а вторые — окисленному убихинону. Как происходит пе-
ренос электронов от восстановленных форм убихинона и цит˝о-
хрома ñ на кислород, нами уже показано. Восстановленные динук-
леотиды НАДФ · Н не способны передавать электроны и прот˝оны
в электронтранспортную цепь митохондрий, а передают их на˝ окисленные динуклеотиды НАД+ в результате так называемой трансгидрогеназной реакции.
9.3.4.ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Ñпроцессом переноса электронов электронтранспортной ц˝е-
пью митохондрий тесно сопряжен синтез АТФ. При изучении р˝а-
боты систем синтеза АТФ с участием изолированных митохон˝д- рий выяснено, что способностью к образованию АТФ обладают˝ только неповрежденные митохондрии. В исследованиях В. А. ˝Белицера и Г. Калькара (1937) было показано, что в процессе синте˝-
за АТФ происходит потребление неорганического фосфата и˝ АТФ. В дальнейшем С. Очоа (1941) установил количественный
выход АТФ в расчете на один атом кислорода, использованно˝го в
процессе дыхания, при окислении различных субстратов и эк˝спе-
риментально доказал, что в результате переноса двух элект˝ронов по всей электронтранспортной цепи митохондрий соотноше˝ние
344
числа синтезированных молекул АТФ к числу потребленных а˝томов кислорода составляет 3 : 1.
Затем в 1949—1955 гг. с использованием искусственных акцепторов электронов были выяснены участки электронтранспо˝ртной
цепи, на которых при переносе электронов обеспечивается з˝апас свободной энергии, необходимый для синтеза АТФ. Таких уча˝ст-
ков оказалось три. Один из них включает ферментный компле˝кс I, осуществляющий перенос электронов от НАД · Н на окислен˝ный
убихинон и сопутствующий перенос протонов из внутреннег˝о
матрикса на внешнюю поверхность внутренней мембраны мит˝о-
хондрий. Второй участок, создающий потенциал для синтеза
АТФ, — это ферментный комплекс III. Третий участок представ˝- ляет собой ферментный комплекс IV. На каждом из этих участко˝в
происходит трансмембранный перенос протонов, создающий˝ оп-
ределенной величины трансмембранный электрохимический˝ по-
тенциал, обладающий значительным запасом свободной энер˝гии.
При переносе электронов от ФАД · Н2 на ферментный комплекс III с участием убихинона трансмембранного переноса протоно˝в не
наблюдается, поэтому на этом участке не создается запас с˝вобод-
ной энергии для синтеза АТФ.
Исходя из полученных экспериментальных данных, было уста˝-
новлено, что при окислении каждой молекулы НАД · Н на тре˝х участках электронтранспортной цепи создается запас сво˝бодой
энергии, достаточный для синтеза АТФ, при реализации кото˝рого
в результате переноса пары электронов на кислород и сопут˝ствую-
щего переноса через мембрану митохондрии шести протонов˝ про-
исходит образование трех молекул АТФ. При окислении же ка˝ж- дой молекулы ФАД · Н2 только на двух участках электронтранспортной цепи создается потенциал для синтеза АТФ, поэтому˝ в
результате переноса электронов от ФАД · Н2 на кислород в расчете на каждую переносимую пару электронов осуществляется пе˝ренос через мембрану четырех протонов и в конечном итоге образо˝вание двух молекул АТФ.
Учитывая, что разность стандартных окислительно-восста-
новительных потенциалов НАД · Н и кислорода составляет˝ 0,82 – (–0,32) = 1,14 В, можно рассчитать изменение свободной энергии при окислении 1 моля НАД · Н кислородом. Оно рассчи- тывается по формуле G°′ = –nF E°′ = –2 · 96,4 · 1,14 = –219,8 êÄæ.
На синтез же трех молей АТФ затрачивается 30,6 · 3 = 91,8 кДж
энергии. Эффективность использования энергии в этом проц˝ессе равна ~42 %. Если по такой же схеме произвести расчет коэффициента использования энергии в ходе окисления в митохонд˝риях
ÔÀÄ · Í2, то мы получим ~36 %.
Процесс образования АТФ в митохондриях, сопряженный с
окислением восстановленных динуклеотидов, являющихся п˝ро-
345
дуктами дыхания, получил название окислительного фосфорилирования. Механизм этого процесса в настоящее время наиболее удовлетворительно объясняется хемиосмотической гипоте˝зой, предложенной в 1961 г. английским биохимиком П. Митчеллом.
Согласно этой гипотезе для синтеза АТФ в митохондриях исп˝ользуется энергия трансмембранного электрохимического пот˝енциа-
ла, который образуется на внутренней мембране митохондри˝и в результате переноса через нее протонов из внутримитохон˝дриаль-
ного матрикса ферментными комплексами электронтранспор˝тной
цепи митохондрий. Синтез АТФ катализирует АТФ-синтетазны˝й
ферментный комплекс (F1), локализованный на внутренней по-
верхности митохондриальной мембраны (см. рис. 9.8), который˝ по своему строению и выполняемой функции сходен с АТФ-синте-˝
тазным комплексом хлоропластных мембран.
АТФ-синтетазный комплекс соединяется на мембране с други˝м
белковым комплексом F0, который пронизывает внутреннюю ми-
тохондриальную мембрану и выполняет роль ионного канала˝, способного осуществлять по электрохимическому градиент˝у
транспорт протонов через мембрану с ее внешней поверхнос˝ти во
внутренний матрикс. При этом установлено, что при прохожд˝е-
нии через ионный канал каждой пары протонов под действием˝
АТФ-синтетазы происходит синтез одной молекулы АТФ согла˝с- но реакции
Í3ÐÎ4 + ÀÄÔ → ÀÒÔ + Í2Î.
Исходя из такого механизма действия АТФ-синтетазного ком˝- плекса, можно заключить, что если при окислении одной моле˝кулы восстановленного динуклеотида НАД · Н ферментами эл˝ект-
ронтранспортной цепи митохондрий осуществляется перено˝с че- рез мембрану шести протонов, то при обратном их прохожден˝ии через ионный канал инициируется синтез трех молекул АТФ.
Если же при окислении ФАД · Н2 осуществляется трансмембран-
ный перенос только четырех протонов, то и при их прохожден˝ии
через ионный канал осуществляется синтез двух молекул АТ˝Ф. Механизм образования АТФ в активном центре АТФ-синтетазн˝о- го комплекса окончательно еще не выяснен.
Протоны, проходящие через ионный канал, согласно химичес-˝
ким принципам образования связей направленно воздейств˝уют на
один из атомов кислорода, соединенный с фосфором или в нео˝р- ганическом фосфате, или в АДФ, при этом образуется молекул˝а воды. Неорганический фосфат и АДФ связываются в нужной ор˝и-
ентации группировками активного центра АТФ-синтетазы. По˝-
скольку они являются кислотами и подвергаются диссоциац˝ии, к
активному центру присоединяются анионы, содержащие элек˝тро-
346

отрицательные атомы кислорода, на один из которых воздейс˝твуют протоны, поступающие из ионного канала. После образова˝- ния молекулы воды становится возможным возникновение фо˝с- фоэфирной связи между остатками фосфорной кислоты неорг˝ани-
ческого фосфата и АДФ с последующим синтезом молекулы АТФ˝:
Известны вещества, способные разобщать процессы дыхания˝ и окислительного фосфорилирования. Под воздействием этих˝ ве-
ществ активируется транспорт электронов по электронтра˝нспорт-
ной цепи митохондрий, но ингибируется синтез АТФ. Разобща˝ю-
щее действие таких веществ заключается в том, что они пере˝носят
протоны через мембрану по электрохимическому градиенту˝, разряжая трансмембранный электрохимический потенциал. К ве˝ще-
ствам-ингибиторам окислительного фосфорилирования отно˝сит-
ся 2,4-динитрофенол.
У растений во внутренней мембране митохондрий кроме ос-
новной электронтранспортной цепи функционирует еще оди˝н механизм передачи электронов на кислород. Он осуществляетс˝я с
участием так называемой альтернативной оксидазы, способной акцептировать электроны от КоQ · Н2. Такой перенос электронов не сопряжен с синтезом АТФ, а весь запас свободной энергии, ос˝вобождающейся при окислении, превращается в теплоту. Функци˝ю альтернативной оксидазы, вероятно, выполняют вещества хино-
идной природы. Их активность как оксидаз возрастает при п˝овы-
шении концентрации в клетках АТФ или снижении активности˝ основной дыхательной цепи митохондрий.
9.3.5. ЭНЕРГЕТИЧЕСКИЙ ВЫХОД РЕАКЦИЙ ДЫХАНИЯ
Основные биоэнергетические продукты реакций дыхания — молекулы АТФ, образующиеся в процессах субстратного фосф˝о-
рилирования, а также восстановленные формы динуклеотидо˝в
ÍÀÄ · Í è ÔÀÄ · Í2, при окислении которых в митохондриях в
результате окислительного фосфорилирования осуществля˝ется
синтез АТФ. Таким образом, для оценки энергетического эфф˝екта
347

дыхания необходимо определить возможный суммарный выхо˝д АТФ и сопоставить его с изменением свободной энергии полн˝ого окисления глюкозы или фруктозы до СО2 è Í2О. Полезный энергетический выход определяется как изменение свободной э˝нергии
âходе гидролиза АТФ, которое при стандартных условиях составляет –30,6 êÄæ · ìîëü–1.
Как было показано ранее, в процессе гликолиза сначала про˝исходит фосфорилирование фруктозы с участием двух молекул АТФ
и синтез фруктозо-1,6-дифосфата, который образует две молеку˝лы
триозы, каждая из которых окисляется до пировиноградной к˝ис-
лоты. В ходе окисления каждой из триоз дважды осуществляе˝тся
синтез АТФ в результате реакций субстратного фосфорилир˝ования и синтез НАД · Н при окислении 3-фосфоглицеринового аль-
дегида в 3-фосфоглицериновую кислоту. Поскольку превращен˝ию
âпировиноградную кислоту подвергаются две молекулы триозы, в
итоге синтезируются две молекулы НАД · Н и четыре молекулы
АТФ. При окислении в митохондриях одной молекулы НАД · Н в результате реакций окислительного фосфорилирования обр˝азуют-
ся три молекулы АТФ, а при окислении двух молекул НАД · Н
возможен синтез шести молекул АТФ. Следовательно, суммарн˝ый
выход АТФ в реакциях гликолиза складывается из четырех мо˝ле-
кул АТФ, образованных в ходе субстратного фосфорилирован˝ия в цитоплазме, и шести молекул АТФ, синтезирующихся путем
окислительного фосфорилирования в митохондриях, т. е. он˝ со-
ставляет 10 молекул АТФ, но две из них затрачиваются на фос-
форилирование гексозы, поэтому фактический выход АТФ при
окислении одной молекулы гексозы до пировиноградной кис˝лоты равен восьми молекулам АТФ. Изменение свободной энерги˝и при гидролизе 8 молей АТФ в стандартных условиях составляет
–30,6 · 8 = –245 êÄæ.
Исходя из того что при полном окислении глюкозы в стандартных условиях выделяется 2872 кДж · моль–1 энергии, а при окислении пировиноградной кислоты 1144 кДж · моль–1, общее
изменение свободной энергии в ходе окисления 1 моля глюко˝-
зы до пировиноградной кислоты в стандартных условиях рав˝но (–2872) – (–1144 · 2) = –584 кДж. На основе этих данных коэффициент полезного использования энергии, освобождающейся˝ в процессе гликолиза, будет равен:
Êèñï = 245·100 = 42 %. 584
В ходе окисления одной молекулы пировиноградной кислоты˝ в
реакциях цикла Кребса образуются четыре молекулы восста˝нов-
ленных динуклеотидов НАД · Н, одна молекула ФАД · Н2, кроме
348

того, в результате субстратного фосфорилирования синтез˝ируется одна молекула АТФ. Восстановленные динуклеотиды НАД · Н образуются при окислительном декарбоксилировании пировин˝оградной и α-кетоглутаровой кислот, а также в реакциях окисления
изолимонной и яблочной кислот. Кроме того, при окислении я˝н- тарной кислоты возникает одна молекула ФАД · Н2. Çà ñ÷åò ðåàê-
ций окислительного фосфорилирования при окислении четы˝рех молекул НАД · Н могут синтезироваться 3 · 4 = 12 молекул АТФ, а
при окислении ФАД · Н2 — две молекулы АТФ, т. е. всего за счет
окислительного фосфорилирования образуется 14 молекул АТ˝Ф.
Учитывая, что еще одна молекула АТФ синтезируется путем с˝уб-
стратного фосфорилирования, получаем, что всего при окисл˝ении одной молекулы пировиноградной кислоты в реакциях цикла˝
Кребса может образоваться 15 молекул АТФ. При их гидролизе в˝
стандартных условиях высвобождается –30,6 · 15 = –459 кДж сво-
бодной энергии в расчете на 1 моль окисленной пировиногра˝дной
кислоты. Общее же изменение свободной энергии при окислен˝ии 1 моля пировиноградной киcлоты до СО2 è Í2О в стандартных ус-
ловиях равно –1144 кДж. Коэффициент полезного использовани˝я
энергии в этом процессе составляет:
Êèñï = |
459·100 |
= 40 %. |
|
1144 |
|||
|
|
В целом в результате окисления одной молекулы глюкозы в процессе дыхания может синтезироваться 38 молекул АТФ,
включая 8 молекул АТФ за счет гликолиза и 30 молекул АТФ в
результате окисления восстановленных динуклеотидов, ко˝торые
образуются в цикле Кребса в ходе превращения двух молекул˝ пировиноградной кислоты, возникающих при гликолизе из одно˝й молекулы глюкозы. В стандартных условиях суммарное измен˝е- ние свободной энергии при гидролизе 38 молей АТФ составляе˝т
–30,6 · 38 = –1163 кДж. Общее изменение свободной энергии при
окислении одного моля глюкозы до СО2 è Í2О в стандартных условиях равно –2872 кДж. Коэффициент полезного действия реак˝- ций аэробного окисления глюкозы будет равен:
ÊÏÄ = 1163·1002872 = 40%.
Следует отметить, что в физиологической среде живых клето˝к концентрация АТФ значительно меньше, чем принято для стан˝-
дартных условий (1 моль · л–1), поэтому изменение свободной
энергии при гидролизе АТФ будет не –30,6 кДж · моль–1, а более
349

отрицательной величиной –40...–42 кДж · моль–1. Поэтому коэффициент использования энергии при реакциях дыхания в физ˝иологической среде фактически имеет более высокие значени˝я — 53—56 %.
Остальная энергия, высвобождающаяся в дыхательном проце˝с- се, в основном выделяется в виде теплоты, которая затрачив˝ается
на испарение воды и повышение температуры физиологическ˝ой среды. Для живых функционирующих клеток это может быть по˝-
лезным, так как при повышении температуры возрастает ско-
рость биохимических превращений, что ускоряет биосинтет˝ичес-
кие процессы. Однако повышение температуры за счет дыхатель-
ных процессов при хранении растительных продуктов являе˝тся нежелательным явлением, так как становится причиной порч˝и и
потерь сохраняемой продукции.
На активность функционирования электронтранспортной
цепи митохондрий и ферментного комплекса, катализирующе˝го
окислительное фосфорилирование, очень сильное влияние о˝казывает обеспеченность клеток кислородом. Однако для нормал˝ьного
осуществления дыхания нужна невысокая концентрация кис˝лоро-
да в атмосфере, вполне достаточно 6—9%-й. Последнее объясня-
ется тем, что первичное формирование живых систем на Земл˝е
происходило при низких концентрациях кислорода в атмосф˝ере. Но даже при достаточной обеспеченности клеток кислородо˝м ско-
рость его потребления в митохондриях зависит от концентр˝ации
АДФ, которая определяется соотношением
[ÀÒÔ] [ÀÄÔ]·[Ðí ] .
При этом содержание неорганического фосфата, как правило˝, не является ограничивающим фактором дыхания, за исключен˝ием тех условий, когда наблюдается сильный дефицит фосфорног˝о
питания. Поэтому чаще всего на активность дыхания в митох˝онд-
риях влияет соотношение [АТФ] : [АДФ]. Если в клетках организма активизируются биосинтетические процессы, связанные˝ с потреблением АТФ, то возрастание концентрации АДФ по принци˝- пу смещения химического равновесия ускоряет синтез АТФ и˝ ин-
тенсивность переноса электронов по электронтранспортно˝й цепи
митохондрий.
Ингибирование дыхания происходит при высоких концентра˝-
öèÿõ ÑÎ2 как конечного продукта дыхательных реакций. Кроме
того, в листьях растений под влиянием повышенной концентр˝а-
öèè ÑÎ2 могут закрываться устьица, вследствие чего уменьшается поступление кислорода.
350
