
Биохимия растений
.pdfществ. К ним относятся 3-фосфоглицериновый альдегид и фосф˝о-
диоксиацетон, 3-фосфоглицериновая и фосфоенолпировиногр˝адная кислоты. Фосфоглицериновый альдегид, кроме реакций гл˝и- колиза, участвует также в пентозофосфатном цикле, где явл˝яется промежуточным продуктом и через него осуществляется свя˝зь между этими двумя важнейшими биохимическими процессами˝, происходящими в цитоплазме растительных клеток.
При восстановлении фосфодиоксиацетона образуется глице˝- ролфосфат, который дает начало реакциям синтеза ацилглиц˝ери-
нов, фосфолипидов и гликолипидов. Из 3-фосфоглицериновой кислоты образуется оксипировиноградная кислота и амино˝кислота серин. Фосфоенолпировиноградная кислота необходима д˝ля
синтеза щавелевоуксусной кислоты и фенольных соединени˝й.
9.3.2.ЦИКЛ ДИ- И ТРИКАРБОНОВЫХ КИСЛОТ
Âопытах с дрожжами Л. Пастер обнаружил, что в присутствии˝
кислорода снижается интенсивность брожения (превращени˝е глюкозы в спирт), но одновременно наблюдается интенсивны˝й рост биомассы дрожжей. В дальнейшем было показано, что уси˝ление биохимической активности клеток дрожжей в аэробных у˝сло-
виях связано с функционированием дыхательного цикла, про˝межуточными продуктами которого являются органические ки˝слоты. Анализируя полученные данные о влиянии органических к˝ис-
лот на дыхательные процессы, Г. А. Кребс в 1937 г. предложил последовательность реакций окисления лимонной кислоты ˝до
ÑÎ2 è Í2О, которую в дальнейшем стали называть циклом ди- и трикарбоновых кислот или циклом Кребса. Ферменты, катализ˝и-
рующие реакции цикла Кребса, локализованы в матриксе или ˝во
внутренней мембране митохондрий.
Непосредственно в реакции цикла Кребса вступает произво˝д- ное пировиноградной кислоты — ацетил-КоА, которое образ˝уется
âрезультате окислительного декарбоксилирования пирови˝ноград-
ной кислоты, катализируемого мультиферментным пируватд˝егидрогеназным комплексом. Ферментный комплекс растворен в м˝ат-
риксе митохондрий. Его молекулярная масса составляет до 9˝ · 106. Он состоит из трех ферментов: декарбоксилазы с тиаминпирофосфатом в качестве кофермента; дигидролипоилдегидрогеназы, содержащей ФАД; дигидролипоилтрансацетилазы, представляющей собой сердцевинный фрагмент в мультиферментном комплексе˝,
включающий остатки липоевой кислоты.
На первом этапе пировиноградная кислота взаимодействуе˝т с тиаминпирофосфатом декарбоксилазы, в результате чего от˝ пиро-
виноградной кислоты отщепляется СО2 и происходит образование гидроксиэтильного производного тиаминпирофосфата (ТПФ˝):
331
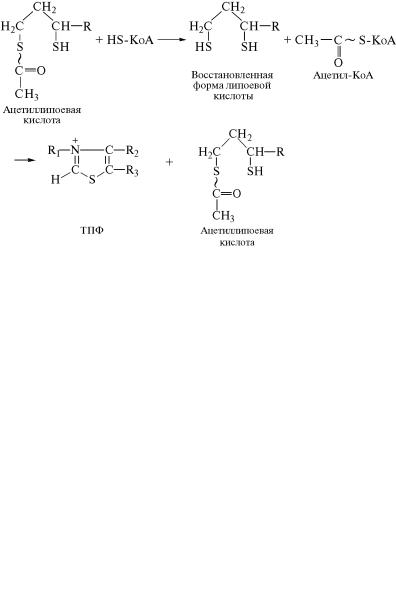
Затем гидроксиэтильное производное ТПФ взаимодействует˝ с окисленной формой липоевой кислоты в составе фермента ди˝гид-
ролипоилтрансацетилазы. В ходе окислительно-восстанови˝тель- ной реакции гидроксильная группа переносится на остаток˝ липо-
евой кислоты и превращается в ацетильную группу с образов˝анием связ˝ь липоевой
Под действием этого же фермента ацетильная группа с макро˝-
эргической связью переносится от ацетиллипоевой кислот˝ы на
кофермент А:
В качестве продуктов данной стадии превращения пировино˝- градной кислоты образуются регенерированный тиаминпиро˝фосфат, восстановленная форма липоевой кислоты и ацетил-КоА.˝
332

Восстановленная форма липоевой кислоты подвергается ок˝ис-
лению под действием фермента дигидролипоилдегидрогеназы, который отщепляет электроны и протоны от восстановленной лип˝ое-
вой кислоты и передает их на окисленный НАД, в результате ч˝его
регенерируется окисленная форма липоевой кислоты и синт˝ези-
руются восстановленные динуклеотиды НАД · Н:
Фермент — ФАД · Н2 + ÍÀÄ+ → Фермент — ФАД + НАД · Н+ + Í+
Таким образом, конечными продуктами окислительного дека˝р-
боксилирования пировиноградной кислоты являются ацетил˝-КоА,
восстановленные динуклеотиды НАД · Н и СО2. НАД · Н включает-
ся в различные восстановительные реакции, катализируемы˝е дегид-
рогеназами, или, как мы увидим далее, становится донором элект-
ронов и протонов для системы окислительного фосфорилиро˝вания,
локализованной в мембранах митохондрий. Ацетил-КоА, как и˝ пи-
ровиноградная, щавелевоуксусная и α-кетоглутаровая кислоты —
важный промежуточный продукт обмена веществ организмов˝. Он
используется для синтеза жирных кислот, углеводов и многи˝х аминокислот и также образуется при их распаде.
Синтез ацетил-КоА в ходе окислительного декарбоксилиров˝а- ния пировиноградной кислоты регулируется концентрациям˝и АТФ
и АДФ, а также НАД · Н и НАД+. Высокая концентрация АТФ ал-
лостерически ингибирует активность пируватдегидрогена˝зного
комплекса. При высокой концентрации НАД · Н также наблюд˝ает-
ся ингибирование активности данного ферментного компле˝кса вследствие пониженной концентрации НАД+, необходимого для регенерации кофермента ФАД · Н2 в окисленную форму ФАД.
В реакциях аэробного дыхания образовавшийся при окислительном декарбоксилировании пировиноградной кислоты ац˝етилКоА включается в реакции цикла Кребса. Вначале происходит˝ конденсация ацетил-КоА с енольной формой щавелевоуксусн˝ой кислоты, в ходе которой ацетильная группировка кофермент˝а А соединяется с углеродной цепью щавелевоуксусной кислот˝ы, в результате чего синтезируется лимонная кислота. Эту реакци˝ю катализирует фермент цитратсинтаза (4.1.3.7):
(1)
333
Фермент цитратсинтазу аллостерически ингибирует повыше˝н- ная концентрация АТФ. Поэтому при высокой обеспеченности˝ клетки энергией, когда повышается концентрация АТФ, вслед˝- ствие ингибирования цитратсинтазы ацетил-КоА будет мень˝ше
включаться в реакции цикла Кребса и больше использоватьс˝я на биосинтетические процессы.
В ходе дальнейших превращений лимонная кислота превраща˝- ется в öèñ-аконитовую кислоту в результате отщепления молекулы
воды под действием фермента аконитатгидратазы (4.2.1.3), ëîêà-
лизованного во внутренней мембране митохондрий:
(2)
В последующей реакции öèñ-аконитовая кислота под действием того же фермента присоединяет молекулу воды, превращая˝сь в
изолимонную кислоту:
(3)
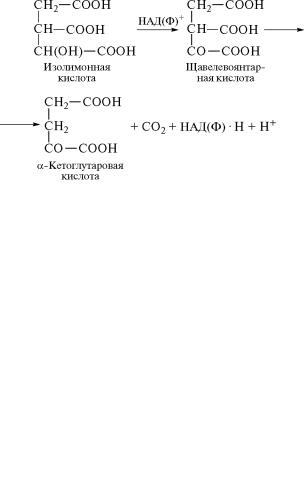
Изолимонная кислота окисляется в щавелевоянтарную кисл˝оту
под действием НАДили НАДФ-специфичного фермента изоцитратдегидрогеназы (1.1.1.41). Образовавшаяся щавелевоянтарная
кислота самопроизвольно декарбоксилируется, превращаяс˝ь вα-
кетоглутаровую кислоту:
(4)
334

Фермент изоцитратдегидрогеназа ингибируется высокой ко˝н- центрацией НАД · Н и аллостерически активируется лимонной кислотой. Это — опережающая активация, когда определенн˝ый метаболит (в данном случае лимонная кислота) активирует ф˝ер-
менты, катализирующие его последующие превращения. Продукт реакции (4) α-кетоглутаровая кислота, подобно пиро-
виноградной кислоте, подвергается окислительному декар˝боксилированию под действием α-кетоглутаратдегидрогеназного ôåð-
ментного комплекса, который имеет такой же состав и строе˝ние,
как и пируватдегидрогеназный комплекс. В результате дека˝рбок-
силирования α-кетоглутаровой кислоты образуется ацильная груп-
пировка янтарной кислоты, которая переносится на коферме˝нт А с образванием макроэргического соединения сукцинил~S-КоА.
Суммарное уравнение процесса окислительного декарбокси˝лиро-
вания α-кетоглутаровой кислоты можно представить в следующем
âèäå:
(5)
α-Кетоглутаратдегидрогеназный комплекс ингибируется выс˝о- кой концентрацией НАД · Н и аллостерически активируется АДФ
и АМФ, тогда как при высокой концентрации АТФ действие фер˝-
ментного комплекса подавляется.
В ходе дальнейших превращений энергия макроэргической связи сукцинил~S-КоА используется для синтеза АТФ, который˝ осуществляется в процессе субстратного фосфорилировани˝я и ка-
тализируется ферментом сукцинил-КоА-синтетазой (6.2.1.5). Âíà-
чале фермент образует макроэргическое промежуточное со˝единение с группировкой кофермента А, а ацильный радикал янтар˝ной кислоты превращается в свободную янтарную кислоту. Кофер˝-
ментная группировка присоединяется к атому азота амидаз˝оль-
ного кольца гистидина в каталитическом центре фермента. Затем
группировка кофермента А в каталитическом центре фермен˝та
замещается на остаток фосфата с образованием макроэргич˝еского фосфофермента (фермент ~ Р), от которого остаток фосфор-
335

ной кислоты с макроэргической связью переходит на АДФ, ос˝уществляя таким образом синтез АТФ. Суммарное уравнение проц˝есса фосфоролитического расщепления сукцинил-КоА и сопряжен˝ного с ним синтеза АТФ можно записать в виде следующей схемы:
(6)
Как показано в представленных ранее реакциях, у растений ˝в
результате фосфоролитического расщепления сукцинил-КоА˝ осу-
ществляется синтез АТФ, тогда как в клетках животного орг˝анизма в аналогичном процессе происходит синтез ГТФ с участие˝м
ГДФ. Образовавшаяся в реакции (6) янтарная кислота окисляе˝тся
с участием фермента сукцинатдегидрогеназы, локализованного во
внутренней мембране митохондрий. Сукцинатдегидрогеназа˝ со-
держит в качестве кофермента динуклеотиды ФАД. В ходе этой реакции янтарная кислота превращается в фумаровую:
(7)
Сукцинатдегидрогеназа аллостерически ингибируется щав˝еле-
воуксусной кислотой и активируется АТФ и восстановленны˝м
убихиноном (КоQ · Н2).
В следующей реакции к фумаровой кислоте присоединяется
молекула воды под действием фермента фумаратгидратазы
(4.2.1.2) и образуется яблочная кислота:
(8)
В дальнейшем яблочная кислота окисляется в щавелевоуксу˝с- ную кислоту с участием НАД-специфичного фермента малатдегидрогеназы (1.1.1.37):
(9)
336

Малатдегидрогеназа ингибируется повышенной концентрац˝и-
ей щавелевоуксусной кислоты и НАД · Н.
Кетоформа щавелевоуксусной кислоты самопроизвольно пре˝- вращается в свою енольную форму:
(10)
После этого енольная форма щавелевоуксусной кислоты мож˝ет взаимодействовать с новой молекулой ацетилкофермента А˝, и рассмотренный нами цикл реакций будет повторяться снова.
Если исключить промежуточные продукты, образующиеся в
реакциях окислительного дикарбоксилирования пировиног˝рад-
ной кислоты и цикла Кребса, и записать только вещества, вхо˝дящие и выходящие из этого цикла при условии полного прохож˝де-
ния всех указанных выше реакций, то можно получить следую˝щее
суммарное уравнение:
Из этого уравнения следует, что пировиноградная кислота в˝
ходе происходящих превращений окисляется с образование˝м трех
молекул СО2 и пяти молекул восстановленных динуклеотидов НАД · Н, НАДФ · Н и ФАД · Н2. Источником кислорода для реак-
ций окисления служат молекулы воды, две из них показаны в л˝е- вой части уравнения и одна высвобождается при взаимодейс˝твии Н3ÐÎ4 и АДФ. Молекулы воды также являются донорами электронов и протонов для синтеза восстановленных динуклеотидо˝в.
Итак, можно заключить, что молекулы кислорода не принимают прямого участия в реакциях цикла Кребса, хотя указанны˝е ре-
акции и активируются кислородом. Непосредственное участ˝ие
кислорода в реакциях дыхания происходит на стадии окисле˝ния восстановленных динуклеотидов, образующихся при окисли˝тельном декарбоксилировании пировиноградной кислоты и в реа˝кциях цикла Кребса, с участием ферментных комплексов, локали˝зованных во внутренних мембранах митохондрий. Эти процессы˝ будут рассмотрены далее.
Кроме восстановленных динуклеотидов в цикле Кребса синт˝е- зируется также АТФ из неорганического фосфата и АДФ путем˝ реализации механизма субстратного фосфорилирования. Ка˝к мы увидим далее, при окислении восстановленных динуклеотид˝ов
также осуществляется синтез молекул АТФ, являющихся унив˝ер-
337

сальными для многих организмов биоэнергетическими прод˝укта-
ми, способными осуществлять транспорт энергии в организм˝е и участвовать в реакциях сопряженного синтеза веществ.
В реакциях окислительного декарбоксилирования пировино˝-
градной кислоты и цикла Кребса образуются не только важны˝е биоэнергетические продукты, но и промежуточные метаболи˝ты, с
участием которых осуществляется связь обмена углеводов˝ с обме-
ном липидов, аминокислот, белков и других органических ве˝-
ществ в организме. Как было указано ранее, к таким вещества˝м
относится ацетил-КоА.
Важными промежуточными продуктами являются также щаве-
левоуксусная и α-кетоглутаровая кислоты. В результате их амини-
рования синтезируются аспарагиновая и глутаминовая ами˝нокис-
лоты, которые занимают центральное место в обмене азотист˝ых
веществ, и из этих аминокислот при их распаде образуются у˝ка-
занные ранее кетокислоты. В результате оказывается возмо˝жным окисление аминокислот путем включения образующихся из н˝их кетокислот в цикл Кребса.
Наряду с кетокислотами в цикле Кребса образуются лимонна˝я
и изолимонная, öèñ-аконитовая, янтарная, фумаровая, яблочная
кислоты, через которые осуществляется связь цикла Кребса˝ с об-
меном органических кислот. Благодаря тому что при распаде˝ ли-
пидов, изопреновых производных, ряда аминокислот и других˝
азотистых веществ образуется ацетил-КоА, они могут исполь˝зо-
ваться в организмах как субстраты дыхания, так как получа˝емый в
процессе их распада ацетил-КоА может включаться в реакции˝
цикла Кребса и подвергаться полному окислению.
Если в ходе окисления ацетил-КоА в реакциях цикла Кребса
промежуточные продукты не выводятся из цикла для синтеза˝ других веществ, то происходит полная регенерация первого про˝дукта,
с которым реагирует ацетил-КоА, — щавелевоуксусной кисл˝оты. Однако в реальных физиологических условиях из цикла Креб˝са постоянно потребляются на различные биосинтетические п˝роцессы те или иные промежуточные метаболиты, поэтому цикличес˝- кий ход регенерации щавелевоуксусной кислоты в этих случ˝аях не
завершается и для обеспечения хода реакций цикла постоян˝но
поддерживается необходимая концентрация щавелевоуксус˝ной кислоты в матриксе митохондрий путем ее дополнительного˝
синтеза.
У растений и бактерий первичный синтез щавелевоуксусной˝
кислоты осуществляется под действием фермента фосфопируваткарбоксилазы èç ÑÎ2 и фосфоенолпировиноградной кислоты:
338

В животных клетках аналогичную функцию выполняет фермент пируваткарбоксилаза, катализирующий реакцию карбоксилирования пировиноградной кислоты:
Таким образом, цикл Кребса является связующим звеном в
обмене различных групп органических веществ и конечным э˝та-
пом их окисления. В ходе этих реакций высвобождается знач˝и- тельное количество энергии окисляющихся субстратов и св˝язы-
вается главным образом в виде восстановленных форм динук˝лео-
тидов НАД · Н и ФАД · Н2, энергия которых используется для
синтеза АТФ.
9.3.3. ОКИСЛЕНИЕ БИОЭНЕРГЕТИЧЕСКИХ ПРОДУКТОВ ЦИКЛА КРЕБСА
У аэробных организмов восстановленные формы динуклеоти˝-
äîâ ÍÀÄ · Í è ÔÀÄ · Í2 подвергаются окислению молекулярным
кислородом на заключительной стадии процесса дыхания. Их˝ окисление катализируют ферментные комплексы, входящие в˝ со-
став внутренней мембраны митохондрий. Первые сведения об˝
окислении субстратов цикла Кребса кислородом воздуха бы˝ли по-
лучены в 1925 г. О. Г. Варбургом и Д. Кейлином, которые открыли˝
действие фермента цитохромоксидазы, способного переносить
электроны на молекулярный кислород.
В последующий период были выяснены все основные перенос-
чики электронов и протонов от восстановленных динуклеот˝идов на молекулярный кислород, а в 1959 г. Б. Чанс по результатам спектрометрических исследований и на основе изучения де˝йствия специфических ингибиторов составил из них цепь дыхатель˝ных
ферментов, которую в настоящее время называют электронтранспортной цепью митохондрий (ЭТЦ). По современным представлениям она включает следующие компоненты:
339
Как видно из приведенной схемы, электроны и протоны от ФАД · Н2 и НАД · Н передаются на кофермент Q, который, превращаясь в восстановленную форму, становится активным донор˝ом электронов для последовательности переносчиков, состоя˝щей из
цитохромов. Протоны высвобождаются в физиологическую ср˝еду и далее взаимодействуют с ионизированными атомами кисло˝рода,
образуя молекулы воды: 2Н+ + Î2– → Í2О. Ионизация кислорода происходит в результате переноса на него электронов от ци˝то-
хромной системы под действием фермента цитохромоксидазы,
имеющего в своем составе цитохромы à è à3.
Перенос электронов в электронтранспортной цепи митохон˝д-
рий осуществляется в соответствии с общим химическим при˝нципом от переносчика с более отрицательным стандартным оки˝сли-
тельно-восстановительным потенциалом в направлении воз˝раста-
ния величины стандартного потенциала (табл. 9.2).
9.2. Стандартные окислительно-восстановительные потенциал˝ы компонентов электронтранспортной цепи митохондрий
Сокращенное |
|
|
|
|
|
|
Название компонента ЭТЦ |
E°′, Â |
|
обозначение |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
ÍÀÄ · Í |
Восстановленный никотинамидаденинди- |
–0,32 |
|||||||
|
нуклеотид |
|
|
|
|||||
ÔÌÍ · Í2 |
Восстановленный флавинмононуклеотид |
–0,30…–0,07 |
|||||||
FeS1(2Fe2S) |
Железосерные белки в составе ферментного |
–0,31 |
|||||||
FeS2(4Fe4S) |
|
комплекса I |
|
–0,02 |
|||||
FeS3(4Fe4S) |
|
|
|
|
|
|
|
|
–0,25 |
ÔÀÄ · Í2 |
Восстановленный флавинадениндинуклеотид |
–0,05 |
|||||||
FeS*(2Fe2S) |
Железосерные белки в составе ферментного |
–0,01 |
|||||||
1 |
|
|
|
|
|
|
|
|
|
FeS*(2Fe2S) |
|
комплекса II |
|
+0,23 |
|||||
2 |
|
|
|
|
|
|
|
|
|
FeS* (4Fe4S) |
|
|
|
|
|
|
|
|
+0,08 |
3 |
|
|
|
|
|
|
|
|
|
Q · Í2 |
Восстановленный убихинон |
+0,07 |
|||||||
b556 |
Цитохромы в составе ферментного |
+0,075 |
|||||||
b560 |
|
комплекса III (восстановленные) |
+0,08 |
||||||
ñ1 |
|
|
|
|
|
|
|
|
+0,24 |
FeSR |
|
Железосерный белок Риске (2Fe2S) |
+0,28 |
||||||
ñ |
|
Цитохром c (Fe2+) |
+0,24 |
||||||
à |
|
Цитохром à (Fe2+) |
+0,21 |
||||||
à |
Цитохром à |
3 |
(Fe2+) |
+0,39 |
|||||
3 |
|
|
|
|
|
|
+ ¾¾® |
|
|
Î2 |
1 |
/2Î2 |
|
|
|
|
+0,82 |
||
e |
|
||||||||
|
|
+2 +2H ¬¾ H2O |
|||||||
Кофермент Q, или убихинон, как и пластохинон, относится к липидорастворимым производным хинона, содержащим в хино˝-
идной группировке метоксильные группы и ненасыщенный из˝о-
преноидный радикал, включающий от шести до десяти изопрен˝о-
вых группировок. У млекопитающих и растений структура уби˝хинона включает десять изопреновых группировок. Кофермент˝ Q
340
