
Биохимия растений
.pdf
Пируватдекарбоксилаза (4.1.1.1) расщепляет пировиноградную кислоту с образованием уксусного альдегида и СО2:
Коферментом у этого фермента служит фосфорнокислое про-
изводное витамина В1 — тиаминпирофосфат.
Ä å ê à ð á î ê ñ è ë à ç û à ì è í î ê è ñ ë î ò катализируют отщепление СО2 от аминокислот. Роль кофермента у них выполняет
пиридоксальфосфат — производное витамина В6.
Глутаматкарбоксилаза (4.1.1.15) отщепляет СО2 от глутаминовой кислоты с образованием γ-аминомасляной кислоты:
Рибулозодифосфаткарбоксилаза (4.1.1.39) участвует в процессе
связывания СО2 в хлоропластах в результате присоединения к ри- булозо-1,5-дифосфату:
Рибулозодифосфаткарбоксилаза содержится в растениях, а˝ так-
же пурпурных и зеленых бактериях. Она представляет собой ˝высокомолекулярный белок, состоящий из 16 полипептидных субъе˝ди-
ниц и проявляющий каталитическую активность в присутств˝ии
катионов Mg2+.
Фруктозодифосфатальдолаза (4.1.2.13) растений и животных
катализирует обратимую реакцию расщепления фруктозо-1,6-д˝и-
фосфата на 3-фосфоглицериновый альдегид и фосфодиоксиаце˝- тон:
261

Ферментный белок состоит из тетрамерных молекул, имеющих˝
в активном центре каталитически активные группировки ли˝зина,
гистидина, цистеина и тирозина.
Изоцитратлиаза (4.1.3.1) в глиоксисомах растительных клеток
расщепляет изолимонную кислоту на янтарную и глиоксилов˝ую
кислоты:
Цитратсинтаза (4.1.3.7) — важный фермент цикла ди- и три-
карбоновых кислот, который участвует в синтезе лимонной к˝ис-
лоты из щавелевоуксусной кислоты и ацетил-КоА:
У г л е р о д - к и с л о р о д - л и а з ы (4.2) — подкласс лиаз, включающий большую группу ферментов, которые отщепляют
или присоединяют молекулу воды к различным субстратам. Бо˝ль-
шинство таких реакций обратимы. Важнейшие представители˝ уг-
лерод-кислород-лиаз — карбоангидраза, фумаратгидратаза˝, фос-
фопируватгидратаза, аконитатгидратаза.
262
Карбоангидраза (4.2.1.1) катализирует обратимую реакцию гидратации СО2 с образованием гидрокарбонат-иона:
¾¾® |
– |
+ H |
+ |
O=C=O+ H2Î ¬¾ HO—COO |
|
|
Ферментный белок представляет собой мономер, включающий ~260 аминокислотных остатков и имеющий в каталитическом
центре катион Zn2+, который соединен хелатными связями с тре-
мя имидазольными группировками остатков гистидина и мол˝еку-
лой воды. Именно эта молекула воды присоединяется в ходе ф˝ер-
ментативной реакции к СО2. Очень высока молярная активность этого фермента — 106 êàò · ìîëüô–1.
Фумаратгидратаза (4.2.1.2) присоединяет молекулу воды к фу-
маровой кислоте, при этом образуется яблочная кислота:
Эта реакция имеет важное значение для процесса дыхания.
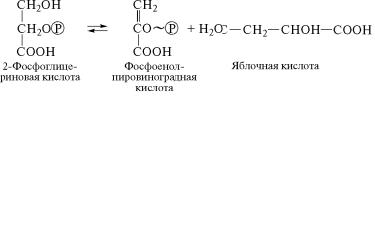
Фосфопируватгидратаза (4.2.1.11) отщепляет молекулу воды от
2-фосфоглицериновой кислоты, в результате чего образуется˝ мак-
роэргическое соединение — фосфоенолпировиноградная к˝ислота:
Этот фермент проявляет каталитическую активность в прис˝утствии катионов Mg2+ è Mn2+ и играет важную роль в процессе дыхания.
По аналогичному механизму происходят реакции дегидрата˝ции
и гидратации, катализируемые ферментом аконитатгидратазой (4.2.1.3). В ходе таких ферментативных реакций происходят вза-
имные превращения лимонной, öèñ-аконитовой и изолимонной
кислот в цикле ди- и трикарбоновых кислот.
У г л е р о д - а з о т - л и а з ы (4.3) — ферменты, катализиру-
ющие присоединение и отщепление азотсодержащих группир˝о-
âîê.
263

Аспартаза (4.3.1.1) — один из важных ферментов этой группы,
катализирующая у бактерий присоединение аммиака к фумар˝овой кислоте с образованием аспарагиновой кислоты:
В процессе распада аминокислот с участием аспартазы може˝т
происходить и обратная реакция превращения аспарагинов˝ой в
фумаровую кислоту.
8.8.5. ИЗОМЕРАЗЫ
Ферменты изомеризации катализируют структурные и про-
странственные изменения в молекулах органических вещес˝тв, в результате которых происходят взаимопревращения изомер˝ов. В
ходе таких превращений осуществляются внутримолекулярн˝ое пе-
ремещение отдельных атомов и атомных группировок; перегр˝уп-
пировки внутри молекулы, связанные с таутомерными превра˝ще-
ниями или смещением двойных связей; стереохимическая пер˝е- стройка молекулы. Изомеразы играют важную роль в процесса˝х
превращения углеводов, органических кислот, стеролов, мно˝гих
азотистых веществ. Рассмотрим некоторые реакции, катализ˝ируе-
мые изомеразами.
Э п и м е р а з ы (5.1) изменяют пространственное расположение водорода и гидроксила у одного из углеродных атомов м˝оно-
сахаридов.
Рибулозофосфатэпимераза (5.1.3.1), относящаяся к таким фер-
ментам, осуществляет взаимные превращения рибулозо-5-фосф˝а- та и ксилулозо-5-фосфата:
К этому же подклассу изомераз (5.1) относятся и рацемазы, катализирующие взаимопревращения D- и L-изомеров.
264

Ф е р м е н т ы и з о м е р и з а ц и и а л ь д о з и к е т о з (5.3). Из ферментов, составляющих этот подкласс, рассмотрим триозофосфатизомеразу, рибозофосфатизомеразу и глюкозо˝фосфатизомеразу, действие которых наиболее хорошо изучено.
Триозофосфатизомераза (5.3.1.1) катализирует обратимую реакцию превращения 3-фосфоглицеринового альдегида в фосфоди˝-
оксиацетон:
Механизм действия этого фермента рассмотрен ранее на с. 182—184.
Рибозофосфатизомераза (5.3.1.6) осуществляет взаимопревра-
щение рибулозо-5-фосфата и рибозо-5-фосфата:
С участием этого фермента происходит образование рибозы˝,
используемой для синтеза рибонуклеотидов, входящих в сос˝тав
макроэргических нуклеозидполифосфатов, каталитических˝ центров многих ферментов, а также рибонуклеиновых кислот.
Глюкозофосфатизомераза (5.3.1.9) ускоряет обратимое превращение глюкозо-6-фосфата во фруктозо-6-фосфат:
265

Такие превращения постоянно происходят в организмах в пр˝о- цессе дыхания и фотосинтеза.
Фосфоглицератмутаза (5.4.2.1) относится к ферментам, осуществляющим внутримолекулярный перенос фосфатных групп. О˝на
катализирует обратимое превращение 3-фосфоглицериновой˝ кислоты в 2-фосфоглицериновую:
Данная реакция происходит при анаэробном превращении мо˝-
носахаридов.
8.8.6. ЛИГАЗЫ
Ферменты, относящиеся к классу лигаз, катализируют эндерг˝о-
нические реакции синтеза веществ, которые сопряжены с гид˝ро-
лизом АТФ или превращениями других макроэргических соед˝и-
нений. В связи с этим лигазы очень часто называют синтетазами.
Подразделение на подклассы у них зависит от типа образующ˝ейся связи.
К а р б о к с и л а з ы (6.4) — один из подклассов лигаз, катали-
зирующих присоединение СО2 к карбоновым кислотам.
Пируваткарбоксилаза (6.4.1.1) осуществляет с участием АТФ
синтез щавелевоуксусной кислоты из пировиноградной кис˝лоты и
ÑÎ2:
Карбоксилазы содержат в каталитическом центре биотинов˝ый
кофермент.
Аспарагинсинтетаза (6.3.1.1) è глутаминсинтетаза (6.3.1.2) катализируют соответственно сопряженный с гидролизом АТФ˝ син-
тез аспарагина и глутамина:
266

А ц и л - К о А - с и н т е т а з ы (6.2.1) присоединяют остатки
различных карбоновых кислот к коферменту А. Эти реакции т˝ак-
же сопряжены с гидролизом АТФ:
Ацетил-КоА-синтетаза (6.2.1.1) — важнейший представитель этой группы лигаз. Под действием этого фермента образуетс˝я макроэргическое соединение — ацетилкофермент А.
А м и н о а ц и л - т Р Н К - с и н т е т а з ы (6.1.1) присоеди-
няют к соответствующим транспортным РНК остатки аминоки˝с- лот, данные реакции требуют участия АТФ:
267
Образующиеся в ходе этих реакций комплексы аминокислот с˝ соответствующими тРНК далее участвуют в синтезе белковы˝х полипептидов.
Контрольные вопросы. 1. Какова биологическая роль ферментов? 2. Как используются ферменты в пищевых производствах, сельском хо˝зяйстве, медицине? 3. Какое строение имеют молекулы ферментных белков? 4. В чем с˝остоит механизм ферментативного превращения молекул субстратов? 5. К˝акие свойства ферментов объясняют гипотезы «ключа и замка» и «индуцирован˝ного соответствия»? 6. В чем заключаются особенности действия ферментов, имеющ˝их в качестве коферментов биотин, липоевую кислоту, флавиновые и железосе˝рные группировки, а также гемы? 7. Каковы механизмы действия ферментов, имеющи˝х в качестве коферментов НАД, НАДФ, кофермент А, а также производные тиа˝мина и пиридоксина? 8. Как определяется и в каких единицах выражается к˝аталитическая активность ферментов? 9. Что характеризует показатель «пери˝од полужизни фермента»? 10. В чем состоит природа образования изоферментов? ˝11. Какова биологическая роль изоферментов? 12. Как изменяется активность ф˝ерментов в зависимости от температуры, рН физиологической среды, концентра˝ции фермента и субстрата? 13. Как действуют на ферменты активаторы и ингиби˝торы? 14. Какие известны разновидности активаторов и ингибиторов ферме˝нтов? 15. Каковы особенности локализации ферментов в клетках организмов? 16. Ка˝к осуществляется регуляция конститутивных ферментов? 17. В чем состоят механ˝измы регуляции индуцируемых ферментов? 18. Каковы механизмы регуляции фер˝ментативной активности с участием гормонов, зимогенов, а также под действием света? 19. По какому принципу осуществляется классификация ферментов˝? 20. Как участвуют в биохимических превращениях важнейшие группы оксидореду˝ктаз — аэробные и анаэробные дегидрогеназы, оксигеназы, катализаторы пероксидного окисления и переноса электронов? 21. Каково участие в метаболизме транс˝фераз, переносящих одноуглеродные остатки, кетонные, аминные и фосфатные˝ группы, ацильные и гликозидные остатки, группировки кофермента А? 22. Как˝ действуют на субстраты различные гидролазы — эстеразы, гликозидазы,˝ протеазы, дезамидазы и дезаминазы, полифосфатазы? 23. В чем состоят особенности каталитического действия углерод-углерод-лиаз, углерод-кислород-лиаз, угл˝ерод-азот-лиаз? 24. Какие реакции катализируют эпимеразы, ферменты изомеризации альдоз и кетоз, ферменты внутримолекулярного переноса фосфатных остатков? 25. Каковы биологическая роль лигаз и важнейшие реакции, катализи˝руемые этими ферментами?
268

9. ОБМЕН УГЛЕВОДОВ
∙
9.1. ФОТОСИНТЕЗ
По современным представлениям фотосинтез — это эндерго˝-
нический окислительно-восстановительный процесс образо˝вания
âклетках фотосинтезирующих организмов органических ве˝ществ
из диоксида углерода и воды за счет поглощения и использо˝вания энергии солнечного света. В ходе фотосинтеза, кроме синте˝за
органических веществ, в результате химических реакций пр˝оисхо-
дит разложение молекул воды и выделение в атмосферу кислоро-
да, обеспечивая таким образом существование на Земле аэро˝бных
организмов, включая человека и животных. Фотосинтезирующ˝ие организмы поглощают из биосферы ежегодно около 75 млрд т у˝г-
лерода, из которого образуют до 200—240 млрд т органических ве˝-
ществ (в расчете на сухую массу), и выделяют при этом в атмос˝фе-
ру до 100—120 млрд т кислорода.
Êфотосинтезирующим (фототрофным) организмам относятся высшие растения, цианобактерии (синезеленые водоросли), а˝ так-
же зеленые и пурпурные бактерии. Благодаря их деятельност˝и осуществляется первичный синтез органических веществ, к˝оторые
âдальнейшем используются как источники энергии и углеро˝да для гетеротрофных организмов. За счет фотосинтеза формир˝уется урожай сельскохозяйственных, технических и лекарственн˝ых
культур; создается биомасса лесов, пастбищ и растительной˝ фло-
ры морей и океанов. Из продуктов фотосинтеза в толще Земли˝ образовались важнейшие топливные ресурсы, которые составл˝яют основу энергетики и используются как сырье для перерабат˝ывающей промышленности. В ходе фотосинтеза из атмосферы посто˝-
янно происходит поглощение СО2, вследствие чего предотвраща-
ется создание избыточной концентрации диоксида углерод˝а, что имеет важное значение в регулировании теплового режима б˝иосферы Земли.
Космическая роль фотосинтеза была впервые научно обосно˝ва-
на в трудах К. А. Тимирязева, который показал, что в поглоще˝нии
солнечного света растениями участвуют молекулы хлорофи˝лла.
Он отметил, что именно с помощью фотосинтеза происходит
269

улавливание солнечной энергии и превращение ее в химичес˝- кую, тепловую и другие формы энергии. Работам К. А. Тимирязева предшествовали открытия других ученых, внесших боль˝шой вклад в изучение процесса фотосинтеза: Дж. Пристли, Ж. Сен˝е-
бье, Т. Соссюра, П. Ж. Пельтье, Ю. Сакса.
Световая и темновая стадии фотосинтеза. В результате обобще-
ния результатов опытов по фотосинтезу, выполненных разны˝ми исследователями к концу XIX в., было установлено, что под воз˝-
действием солнечных лучей у фотосинтезирующих организм˝ов
образуются углеводы (в виде глюкозы и крахмала) и выделяет˝ся
молекулярный кислород (О2). Синтез этих продуктов происходит
с участием диоксида углерода (СО2) и воды и поэтому может быть выражен следующим уравнением:
В 1914—1941 гг. А. А. Рихтер, Р. Эмерсон и У. Арнольд показа-
ли, что более высокая эффективность фотосинтеза наблюдае˝тся у
растений, которые находятся в прерывистом режиме освещен˝ия,
состоящем из световых вспышек определенной длительност˝и и следующих за ними темновых промежутков тоже определенно˝й
продолжительности. Исходя из этих опытов, стало понятно, ч˝то
на свету образуются первичные продукты фотосинтеза, кото˝рые
затем вступают в химические реакции синтеза углеводов, пр˝оисхо-
дящие уже без участия света. Химические реакции, иницииру˝е- мые светом, было предложено называть световыми реакциями ôî-
тосинтеза, а биохимические превращения, при фотосинтезе п˝ро-
исходящие без участия света и способные протекать как на ˝свету,
так и в темноте, называют темновыми реакциями фотосинтеза. В 1941 г. А. П. Виноградов и Р. В. Тейс, применив изотопный анализ, выяснили, что соотношение изотопов 18Î è 16О в выделяемом при фотосинтезе кислороде такое же, как в кислороде воды. С˝ле-
довательно, выделяемый кислород образуется в результате˝ фото-
химического разложения молекул воды. Учитывая новые данн˝ые о происхождении кислорода, образующегося в ходе фотохимич˝еских реакций, суммарное уравнение фотосинтеза для высших р˝астений было предложено записывать в следующем виде:
Из этого уравнения видно, что водород воды, вступающей в ре˝- акции фотосинтеза, затрачивается на восстановление СО2 äî óðîâ-
ня углеводов, при этом в качестве дополнительного продукт˝а с
270
