
- •Оглавление
- •Введение
- •1. Интерференция света
- •1.1. Электромагнитная волна на границе раздела сред
- •1.2. Интерференция света и условия её наблюдения. Когерентные источники света
- •1.2. Интерференция света в тонких пленках
- •2. Дифракция
- •2.1. Явление дифракции света. Условия ее наблюдения. Принцип Гюйгенса – Френеля
- •2.2. Метод зон Френеля. Прямолинейность распространения света
- •2.3. Дифракция на простейших преградах
- •Дифракция на круглом диске
- •Дифракция Фраунгофера
- •Дифракция на одной щели
- •Дифракция на дифракционной решетке
- •3. Поляризация
- •3.1. Естественный и поляризованный свет
- •3.2. Методы получения поляризованного света. Закон Брюстера
- •3.3. Анализ поляризованного света. Закон Малюса
- •3.4. Интерференция поляризованного света
- •3.5.Применение поляризованного света
- •4. Квантовые свойства света
- •4.1. Тепловое излучение и его характеристики
- •4.2. Законы теплового излучения
- •4.3. Оптическая пирометрия
- •4.4. Законы фотоэлектрического эффекта. Уравнение Эйнштейна
- •4.5. Практическое применение фотоэффекта
- •4.6. Фотоны. Масса и импульс фотона
- •4.7. Давление света
- •4.8. Эффект Комптона
- •4.9. Двойственная корпускулярно-волновая природа света
- •5. Атомная физика. Элементы квантовой физики
- •5.1. Модели атома. Спектры излучения атомов водорода
- •5.2. Постулаты Бора
- •Решая совместно уравнение второго закона Ньютона для электрона
- •5.3. Волновые свойства вещества. Гипотеза де Бройля. Принцип неопределенности
- •5.4. Волновая функция и уравнение Шредингера
- •Функция будет принимать то или иное значение в зависимости от внешних условий. Внешние условия – это силы, действующие на микрочастицу, представлены потенциальной функцией u ( X, y, z, t ).
- •5.5.Квантовомеханическое описание состояния электрона в атоме. Принцип Паули. Структура электронных оболочек атома
- •5.6.Вынужденное излучение. Лазеры
- •6.Атомное ядро. Элементарные частицы
- •6.1.Характеристики атомного ядра. Размер, состав и заряд атомного ядра
- •6.2. Дефект массы и энергия связи ядра
- •6.3. Ядерные силы
- •6.4. Радиоактивность. Закон радиоактивного распада
- •6.5. Элементарные частицы
- •6.6. Элементы космологии
- •Литература
5.2. Постулаты Бора
Предположение Бора заключалось в том,
что классическая электромагнитная
теория просто неприменима к электрону,
движущемуся вокруг ядра. Он предположил,
что два члена в формуле Бальмера
представляют собой полные энергии
электрона на двух «разрешенных» орбитах
в атоме водорода. Если умножить обе
части формулы Бальмера на hи ввести
обозначения
![]() ,
то можно написать
,
то можно написать
hν =En –Em.
Бор предположил, что энергия электрона не теряется на излучение, когда он движется по любой из разрешенных орбит.
Электрон излучает энергию только тогда, когда он совершает переход между двумя разрешенными орбитами.
Энергия испущенного фотона в точности равна разности энергий электрона на этих орбитах.
Чтобы доказать правильность этих предположений, Бор попытался вычислить энергии этих состояний. Оказалось, что можно получить ряд дискретных разрешенных значений энергии «на орбитах» только при том предположении, что момент импульса квантуется, т.е. меняется скачком. В итоге в основу своей теории Бор положил два постулата.
Первый постулат Бора(постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергию. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
mevrn=nħ, (n= 1, 2, 3, …), (5.3)
где meмасса электрона,v его скорость наn-й орбите. Стационарные состояния соответствуют дискретному (прерывному) ряду дозволенных значений энергииEn.
Второй постулат Бора(правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
hν=EnEm(5.4)
Энергия фотона равна разности энергий соответствующих стационарных состояний (ЕnиЕm —соответственно энергии стационарных состояний атома до и после излучения (поглощения)). ПриEm<Enпроисходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией. ПриЕm>Еn его поглощение (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту.
Набор возможных дискретных частот ν =(En Em)/hквантовых переходов и определяет линейчатый спектр атома. Величинаnназывается главным квантовым числом.
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем – систем, состоящих из ядра с зарядом Zeи одного электрона (например, ионы Не+, Li2+).
Решая совместно уравнение второго закона Ньютона для электрона
Fk=man,
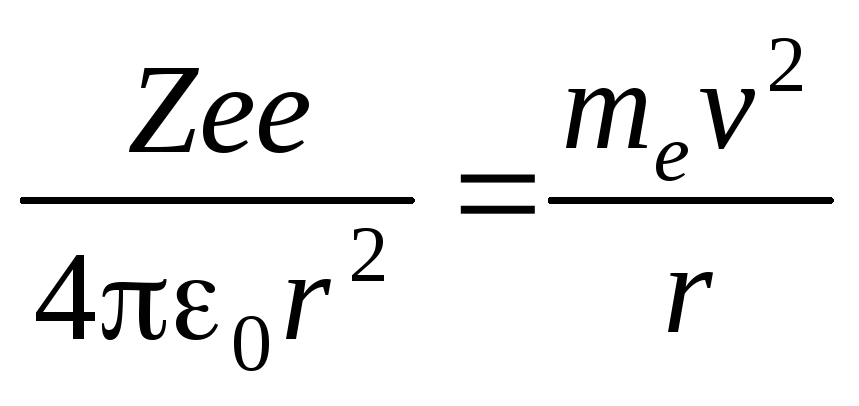 ,
(5.5)
,
(5.5)
(где mе иv масса и скорость электрона на орбите радиусаr; ε0электрическая постоянная; Fk– кулоновская сила) и уравнение (5.3), получим выражение для радиусаn-й стационарной орбиты:
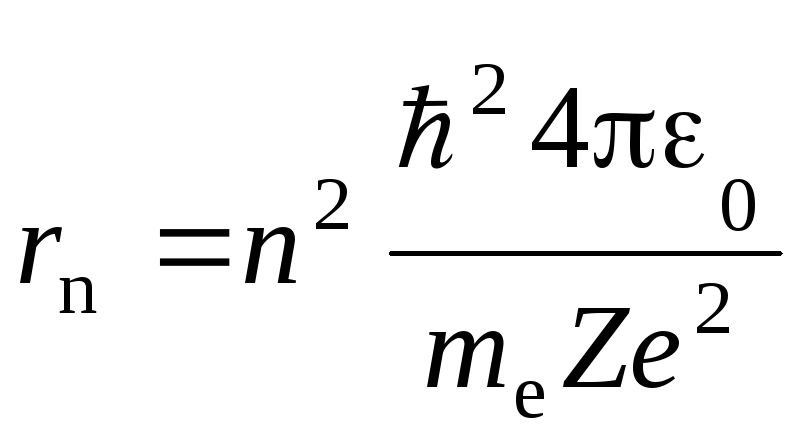 ,
гдеn = 1, 2, 3, ... . (5.6)
,
гдеn = 1, 2, 3, ... . (5.6)
Для атома водорода (Z= 1) радиус первой орбиты электрона приn =1, называемыйпервым боровским радиусом(r1 =а), равен
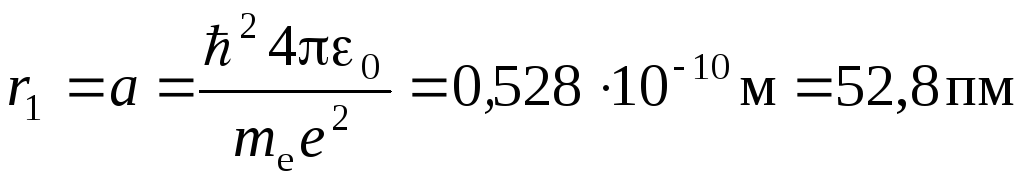 .
.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (mv2 /2) и потенциальной энергии в электростатическом поле ядра (qφ = –Ze2/(4πε0r)
![]() ,
(5.7)
,
(5.7)
(при
этом учли, что
![]() ).
).
Подставляя квантованные для радиуса n-й стационарной орбиты значения (5.6) в (5.7), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
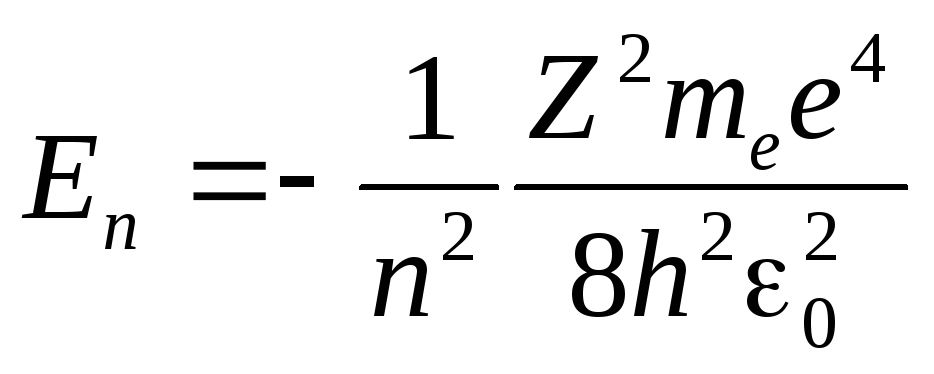 ,
(n
=
1, 2, 3, …), (5.8)
,
(n
=
1, 2, 3, …), (5.8)
где знак минус означает, что электрон находится в связанном состоянии.
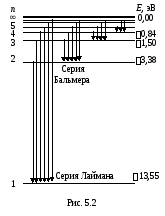
Из формулы (5.8) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n.Целое числоnв выражении (5.8), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние сn= 1 являетсяосновным(нормальным)состоянием; состояния сn >1 являются возбужденными.Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными.
Придавая nразличные целочисленные значения, получим для атома водорода (Z= 1), согласно формуле (5.8), возможные уровни энергии. Энергия атома водорода с увеличениемnвозрастает, и энергетические уровни сближаются. Атом водорода обладает, таким образом, минимальной энергией (E1= – 13,55 эВ) приn= 1 и максимальной (Emax = 0) приn = ∞. Следовательно, значениеEmax= 0 соответствует ионизацииатома (отрыву от него электрона).
Согласно второму постулату Бора (5.3), при переходе атома водорода (Z= 1) из стационарного состоянияn в стационарное состояниет с меньшей энергией испускается квант
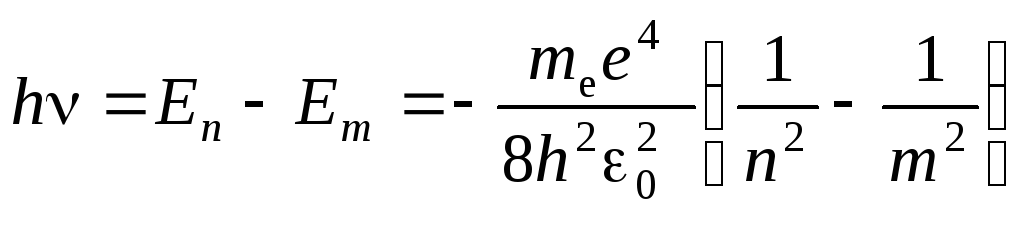 ,
,
откуда частота излучения
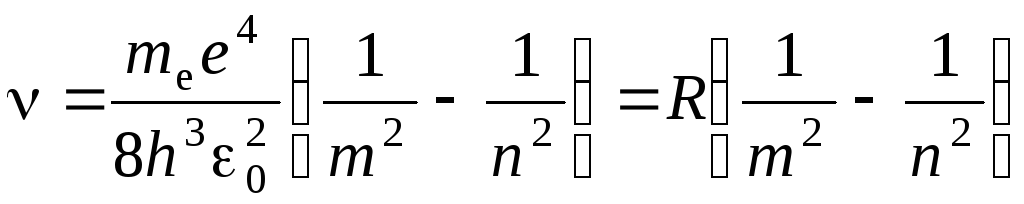 (5.9)
(5.9)
Теория Бора была первым шагом в создании квантовой механики. Дальнейшее развитие атомной физики показало справедливость постулатов Бора не только для атомов, но и для других микроскопических систем – для молекул и атомных ядер. Эта часть теории Бора сохранилась при дальнейшем развитии квантовой теории. Иначе обстоит дело с моделью атом Бора, основанной на рассмотрении движения электрона в атоме по законам классической механики при наложении дополнительных условий квантования. Вскоре выяснилось, что электронам присущи свойства, не согласующиеся с представлением о планетарном их движении.
