
- •Оглавление
- •Введение
- •1. Интерференция света
- •1.1. Электромагнитная волна на границе раздела сред
- •1.2. Интерференция света и условия её наблюдения. Когерентные источники света
- •1.2. Интерференция света в тонких пленках
- •2. Дифракция
- •2.1. Явление дифракции света. Условия ее наблюдения. Принцип Гюйгенса – Френеля
- •2.2. Метод зон Френеля. Прямолинейность распространения света
- •2.3. Дифракция на простейших преградах
- •Дифракция на круглом диске
- •Дифракция Фраунгофера
- •Дифракция на одной щели
- •Дифракция на дифракционной решетке
- •3. Поляризация
- •3.1. Естественный и поляризованный свет
- •3.2. Методы получения поляризованного света. Закон Брюстера
- •3.3. Анализ поляризованного света. Закон Малюса
- •3.4. Интерференция поляризованного света
- •3.5.Применение поляризованного света
- •4. Квантовые свойства света
- •4.1. Тепловое излучение и его характеристики
- •4.2. Законы теплового излучения
- •4.3. Оптическая пирометрия
- •4.4. Законы фотоэлектрического эффекта. Уравнение Эйнштейна
- •4.5. Практическое применение фотоэффекта
- •4.6. Фотоны. Масса и импульс фотона
- •4.7. Давление света
- •4.8. Эффект Комптона
- •4.9. Двойственная корпускулярно-волновая природа света
- •5. Атомная физика. Элементы квантовой физики
- •5.1. Модели атома. Спектры излучения атомов водорода
- •5.2. Постулаты Бора
- •Решая совместно уравнение второго закона Ньютона для электрона
- •5.3. Волновые свойства вещества. Гипотеза де Бройля. Принцип неопределенности
- •5.4. Волновая функция и уравнение Шредингера
- •Функция будет принимать то или иное значение в зависимости от внешних условий. Внешние условия – это силы, действующие на микрочастицу, представлены потенциальной функцией u ( X, y, z, t ).
- •5.5.Квантовомеханическое описание состояния электрона в атоме. Принцип Паули. Структура электронных оболочек атома
- •5.6.Вынужденное излучение. Лазеры
- •6.Атомное ядро. Элементарные частицы
- •6.1.Характеристики атомного ядра. Размер, состав и заряд атомного ядра
- •6.2. Дефект массы и энергия связи ядра
- •6.3. Ядерные силы
- •6.4. Радиоактивность. Закон радиоактивного распада
- •6.5. Элементарные частицы
- •6.6. Элементы космологии
- •Литература
5. Атомная физика. Элементы квантовой физики
5.1. Модели атома. Спектры излучения атомов водорода
Еще в античные времена возникло представление об атомах как неделимых мельчайших частицах вещества («атомос»неразложимый). К началу XVIII в. существование атомов было доказано, но атомы по-прежнему считались неделимыми. В 1869 г. Д. И. Менделеев разработал Периодическую систему элементов, отражающую единую природу атомов. Напрашивался вывод о том, что атом имеет сложное строение. Когда было доказано, что электрон является составной частью любого атома, встал вопрос о строении атома. Результаты исследований свойств электрона и радиоактивности позволили строить конкретные модели атома.
Первая модель атома принадлежит Дж. Томсону (1903 г.). Согласно этой модели атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10 м, внутри которого около своих положений равновесия колеблются электроны; отрицательный суммарный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что атом устроен иначе. Это открытие принадлежит английскому физику Резерфорду. Он исследовал прохождение αчастиц в веществе через золотую фольгу толщиной примерно 1 мкм. α–частицыположительно заряженные частицы с зарядом 2е-и массой, примерно в 7300 раз большей массы электрона. Проходя через фольгу, основная их часть незначительно отклонилась (согласно предложенной Томсоном модели атома). Но совершенно неожиданно оказалось, что примерно 1 частица из 20000 возвращается назад в сторону источника. Легкие электроны не могут существенно изменить движение тяжелых и быстрых частиц. Значительное отклонение α–частиц обусловлено тем, что они наталкиваются на тяжелую частицу с положительным зарядом. Объем этой тяжелой частицы очень мал по сравнению с объемом атома, так как сильно отклоняются лишь немногие α–частицы. Чтобы объяснить результаты опытов Резерфорд в 1911 г. предложил принципиально новую модель атома, напоминающую по строению Солнечную систему - планетарную (ядерную) модель атома. Согласно этой модели положительно заряженная часть атома не распределена по всему его объему, а сосредоточена в чрезвычайно малом объемеядреатома (размер – 10-15… 10-14м). Вокруг положительного ядра, имеющего зарядZe(Z– порядковый номер элемента в системе Менделеева,е элементарный заряд), по замкнутым орбитам движутся электроны, подобно планетам вокруг Солнца, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращатьсяZэлектронов. В атоме действуют электрические (кулоновские) силы.
Электрон движется вокруг ядра по круговой орбите радиуса r (с центростремительным ускорением). Согласно классической электродинамике ускоренно движущийся электрон должен непрерывно излучать электромагнитные волны, терять энергию на излучение и упасть на ядро. Однако этого не происходит. Другая трудность состояла в следующем: если принять, что частота излучаемого электроном света равна частоте колебаний электрона в атоме (или числу оборотов в одну секунду), то излучаемый свет по мере приближения электрона к ядру должен непрерывно изменять свою частоту. Соответственно спектр излучаемого света должен быть сплошным (в нем должны присутствовать все частоты). Но это противоречит опыту. Атом излучает волны вполне определенных частот, типичных для данного химического элемента, и характеризуется спектром, состоящим из отдельных спектральных линий – линейчатым спектром (рис. 5.1).
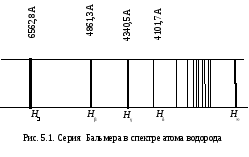
Швейцарский ученый И. Бальмер (1885 г.) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
![]() ,
(n= 3, 4, 5, …), (5.1)
,
(n= 3, 4, 5, …), (5.1)
где R =1,10·107 м-1 постоянная Ридберга. Так как частота = c/, то эта формула может быть представлена для частот. В дальнейшем были обнаружены серии линий в ультрафиолетовой и инфракрасной области спектра. Все серии линий в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
![]() ,
(5.2)
,
(5.2)
где mимеет в каждой данной серии постоянное значение,т =1, 2, 3, 4, 5, 6 (определяет серию), ппринимает целочисленные значения начиная с (т+1) (определяет отдельные линии этой серии).
Таким образом, в рамках модели атома Резерфорда не могли быть объяснены устойчивость атома и линейчатые спектры его излучения. Противоречия модели Резерфорда оказалось возможным разрешить, лишь отказавшись от ряда привычных представлений классической физики.
Датский физик Нильс Бор в 1913 г. предпринял смелую попытку объяснить результаты анализа спектра атома водорода. Это была первая попытка построить качественно новую (квантовую) теорию атома.
