
МЕТОДИЧЕСКОЕ ПОСОБИЕ- Орг. химия-Часть 1
.pdf
|
|
. |
|
|
дегидрир |
||
C2H5OH |
|
окислен |
|
перв.спирт |
|||
. |
|||
|
|
||
O
H2 + H3C C 
H
|
|
O |
|
|
|
|
|
|
O |
|
|
|
O |
|
|
|
|||||
H2O + H3C |
|
C |
|
|
H3C |
|
C |
|||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
H |
|
|
|
|
|
|
OH |
|
H3C CH CH3
OH
. дегидрир
окислен.
H2 + H3C C CH3 O
H2O + H3C C CH3 O
OH
H3C C CH3 CH3
окислен.
|
|
|
|
|
|
|
|
O |
H3C |
|
C |
|
CH3 + H |
|
C |
||
|
|
|
||||||
|
|
|
|
|
|
|
|
OH |
|
|
O |
||||||
|
|
|
|
|
|
|||
Образование различных продуктов при дегидрировании и окислении позволяет отличить первичные, вторичные и третичные спирты.
Отдельные представители
Метиловый спирт, CH3OH, кипит при температуре 64,7 °С. В промышле-ности основным способом его получения служит синтез из
СО и Н2 на цинк-хромовом катализаторе ( ZnO+Cr2O3), tсинтеза= 400 °С и Р = 200…300 атм.
CO + 2H2 
 CH3OH
CH3OH
Раньше метанол получали сухой перегонкой древесины (отсюда и его тривиальное название «древесный спирт»).
Метанол имеет очень широкое применение. Он хороший растворитель и используется в лакокрасочной и нефтеперерабатывающей промышленности. В больших количествах из него получают формальдегид, метил- и диметиланилин, метиламины, многие красители, медицинские препараты и другие вещества. Метанол
является сильным ядом.
Этиловый спирт кипит при температуре 78,3 °С. По объему производства этиловый спирт занимает ведущее место среди других органических продуктов. Этанол можно получать брожением сахаристых веществ, чаще всего глюкозы, которая содержится в виноградном соке. Сырьем может служить крахмал и целлюлоза, которые при гидролизе дают глюкозу. Источником крахмала служат хлебные злаки, рис,
101
кукуруза, картофель – пищевые продукты, источником целлюлозы – древесина. Значительное развитие получил синтез этанола гидратацией этилена.
Большое количество этилового спирта идѐт на получение дивинила
– сырья для производства синтетического каучука, моторного топлива и добавок к нему, диэтилового эфира, хлороформа, этилена высокой чистоты, сложных эфиров, используемых как растворители лаков и как душистые вещества. Этанол – хороший растворитель и антисептик.
Пропиловый спирт выделяют из сивушного масла, побочного продукта при получении этанола брожением. Изопропиловый спирт получают гидратацией пропилена. Применяются эти спирты и их эфиры как растворители. Из изопропилового спирта дегидрированием или окислением получают ацетон.
Бутанол-1 в технике в основном получают брожением глюкозы. Он и его эфиры используются как растворители.
Изобутиловый спирт (2-метилпропанол-1) выделяют из сивушного масла. Идѐт на получение изобутилена, изомасляного альдегида, используется как растворитель.
Третичный бутиловый спирт синтезируют гидратацией изобутилена. Это важное алкилирующее средство при введении в
органическое соединение трет-бутильной группы.
Высшие спирты получают синтетически. Они используются в производстве моющих средств.
2.1.1.2 Ненасыщенные одноатомные спирты
Ненасыщенные спирты могут быть этиленового, ацетиленового и других рядов ненасыщенных соединений. Следует иметь в виду, что алкены не могут нести гидроксил при углероде во втором валентном состоянии (sp2). Структуры
 C
C  C
C
OН
неустойчивы и изомеризуются в
C |
|
C |
|||
|
|||||
|
|
|
|
|
|
H |
|
O |
|||
Вот некоторые ненасыщенные спирты:
HOH2C |
|
CH |
|
CH2 |
аллиловый спирт, винилкарбинол, |
|
|
пропенол |
|||
|
|
|
|
|
|
|
|
|
|
|
102 |

H3C |
|
|
|
CH |
|
|
CH |
|
|
CH2 |
метилвинилкарбинол, бутен-3-ол-2 |
||
|
|
|
|
|
|
|
|||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
||||||||||
|
|
OH |
|||||||||||
|
|
|
|||||||||||
HOH2C |
|
|
C |
|
|
CH |
пропаргиловый спирт, |
||||||
|
|
|
|
||||||||||
|
|
ацетиленилкарбинол, пропин-2-ол-1 |
|||||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Виниловый спирт, СН2=СН–ОН, в свободном состоянии не существует. Однако, известны его эфиры, например, винилацетат, получаемый из уксусной кислоты и ацетилена:
|
|
|
O |
|
|
|
O |
||||
H3C |
|
C |
+ HC |
|
CH |
|
H3C |
|
C |
||
|
|
||||||||||
|
|
|
|
||||||||
|
|
||||||||||
|
|
|
OH |
|
|
|
O CH |
|
CH2 |
||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||
Винилацетат используется для получения поливинилацетата и поливинилового спирта, из которого готовят ценные полимеры.
Аллиловый спирт обладает свойствами как спиртов, так и олефинов. Получают его гидролизом хлористого аллила в 5 %-ном растворе щѐлочи.
ClH2C CH CH2 + H2O
CH2 + H2O  HOH2C CH
HOH2C CH CH2 + HCl
CH2 + HCl
Используют в производстве глицерина.
Пропаргиловый спирт получают конденсацией ацетилена с формальдегидом:
O
HC |
|
CH + H |
|
C |
|
HC |
|
C |
|
CH2OH |
|
|
|||||||||
|
|
|
|
|
||||||
|
|
H
Является промежуточным продуктом в синтезах аллилового спирта, глицерина, дивинила.
2.1.2 Многоатомные спирты
Спирты, содержащие несколько гидроксильных групп, называются многоатомными. Различают двух-, трех-, четырехатомные и т. д. спирты. Двухатомные спирты называют гликолями, трехатомные – глицеринами.
2.1.2.1 Гликоли
Гидроксильные группы в гликолях содержатся у различных атомов углерода. Гликоли с двумя гидроксилами у одного углеродного атома нестойки. Они отщепляют воду с образованием альдегидов или кетонов.
Изомерия гликолей определяется взаимным расположением гидроксильных групп и изомерией углеродного скелета. В зависимости от взаимного расположения групп OH– различают α-, β-, γ-, δ-, … гликоли. В зависимости от характера углеродных атомов, несущих гидроксилы, гликоли могут быть первично-вторичными, первичнотретичными, двупервичными, двувторичными и т.д.
103

Названия гликолей могут даваться двумя способами. По номенклатуре ИЮПАК к названию основной углеродной цепи добавляют суффикс –диол и указывают номера углеродных атомов самой длинной углеродной цепи, несущих гидроксильные группы. Названия α-гликолей могут производиться от названия соответствующего этиленового углерода с добавлением слова гликоль. Классификация и названия гликолей даны ниже на примере бутандиолов:
H2C |
|
|
|
|
|
|
|
CH |
|
|
|
CH2 |
|
|
|
|
CH3 |
α-гликоль |
первично- |
бутандиол-1,2; |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вторичный |
1,2-бутиленгликоль |
||||
HO OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
H2C |
|
|
|
CH2 |
|
|
|
|
|
CH |
|
|
|
|
CH3 |
β-гликоль |
первично- |
бутандиол-1,3 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вторичный |
|||||||||
OH |
|
|
|
|
|
|
OH |
|
|
|
|
|||||||||||||||||||||||||
H2C |
|
|
CH2 |
|
|
|
|
CH2 |
|
|
|
|
CH2 |
γ-гликоль |
дву- |
бутандиол-1,4 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
первичный |
|||||||||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||||||||||||
H3C |
|
|
CH |
|
|
|
|
|
|
CH |
|
|
|
CH3 |
α-гликоль |
дву- |
бутандиол-2,3 |
|||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
OH |
|
|
|
|
вторичный |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
первично- |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α-гликоль |
2-метилпропандиол-1,2 |
|
|
|
H2C |
|
|
|
C |
|
|
|
|
CH3 |
|||||||||||||||||||||||||
|
|
|
|
|
|
третичный |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
дву- |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
β-гликоль |
2-метилпропандиол-1,3 |
|
|
H2C |
|
|
CH |
|
|
|
CH2 |
||||||||||||||||||||||||||||
|
|
|
|
первичный |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
||||||||||||||||
Способы получения
В принципе, гликоли могут быть получены всеми обычными синтетическими методами получения спиртов.
Примером могут служить следующие реакции.
– Гидролиз дигалогенпроизводных насыщенных углеводородов и галогенгидринов:
H3C |
|
|
CHCl |
|
CH2Cl + 2H2O |
|
|
|
|
H3C |
|
|
CHOH |
|
|
CH2OH + 2HCl |
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
H3C |
|
|
CHOH |
|
CH2Cl + H2O |
|
|
|
|
H3C |
|
|
|
CHOH |
|
|
|
CH2OH + HCl |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
– Гидратация α-окисей в кислой среде: |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
H3C |
|
CH |
H |
CH2 + HOH |
|
|
|
|
H3C |
|
CHOH |
|
CH2OH |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
O
– Окисление олефинов перманганатом калия в разбавленном водном слабощелочном растворе (реакция Вагнера) или пероксидом водорода в присутствии катализаторов (CrO3):
104
3CH2 |
|
|
CH2 + 2KMnO4 + 4H2O |
|
|
|
3CH2 |
|
|
|
CH2 |
+ 2KOH + 2MnO2 |
||||
|
|
|
|
|
||||||||||||
|
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
OH |
|
|||||
|
|
|
CH2 |
|
CH2 + H2O2 |
|
|
СН2OH |
|
|
СН2OH |
|||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||
Физические свойства
Низшие гликоли хорошо растворимы в воде. Плотность их выше, чем у одноатомных спиртов. Соответственно выше и температуры кипения из-за значительной ассоциации молекул: например, этиленгликоль кипит при температуре 197,2 °C; пропиленгликоль – при температуре 189 °C и бутандиол-1,4 – при температуре 230 °C.
Химические свойства
Все сказанное ранее о свойствах соответствующих одноатомных спиртов приложимо и к гликолям. При этом следует помнить, что в реакцию может вступать как один гидроксил, так и сразу оба.
– Окисление двупервичных гликолей дает альдегиды:
HOH2C CH2OH
O
-H2O
O
HOH2C C 
OH
гликолевый
альдегид
O
-H2O
O  O
O
 C C
C C
H H
глиоксаль
– При окислении α-гликолей йодной кислотой происходит разрыв связи между углеродными атомами, несущими гидроксилы, и образование соответствующих альдегидов или кетонов:
R'
R HC C
R''
HO OH
HJO4
|
|
|
H |
|
|
R' |
R |
|
C |
O + O |
|
C |
R'' |
|
|
|||||
|
|
Метод имеет большое значение для установления строения α- гликолей.
– Результаты внутримолекулярного отщепления воды от гликолей в значительной мере зависят от типа гликоля.
Дегидратация α-гликолей протекает с образованием альдегидов или кетонов, γ-гликоли за счет атомов гидроксильных групп отщепляют воду с образованием гетероциклических соединений – тетрагидрофурана или его гомологов:
105
HOH2C CH2OH
-H2O
O
H3C C 
H
HOH2C CH2 CH2 CH2OH
-H2O
H2C CH2
H2C CH2
O
тетрагидрофуран
Первая реакция идѐт через образование карбониевого иона с последующим перемещением атома водорода с его электронной парой:
|
H2C |
CH2 |
+ |
|
H |
|
|
H+ |
|
|
|
|
H C C H |
+ H+ |
|
HO |
OH |
CH |
2 |
CH |
|||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
O |
O |
|
H
При парофазной дегидратации над Al2O3 α-двутретичных гликолей, называемых пинаконами, получаются диеновые углеводороды:
H3C CH3
H3C C C CH3
HO OH
Al |
O3 |
H3C |
|
CH3 |
|||||||
|
|
|
|
|
|
|
|
|
|||
|
2 |
|
H2C |
|
C |
|
C |
|
CH2 |
||
2H O |
|
|
|
||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
2,3-диметилбутадиен-1,3
– Межмолекулярная дегидратация приводит к образованию гидроксиэфиров или циклических простых эфиров:
HOH2C CH2OH + HOH2C CH2OH  HOH2C CH2 O CH2 CH2OH
HOH2C CH2 O CH2 CH2OH
диэтиленгликоль
Температура кипения диэтиленгликоля 245,5 °C. Его используют как растворитель для заполнения тормозных гидравлических систем, при отделке и крашении тканей.
Среди циклических простых эфиров наибольшее распространение как растворитель получил диоксан. Он получен впервые А.Е. Фаворским нагреванием этиленгликоля с серной кислотой:
106
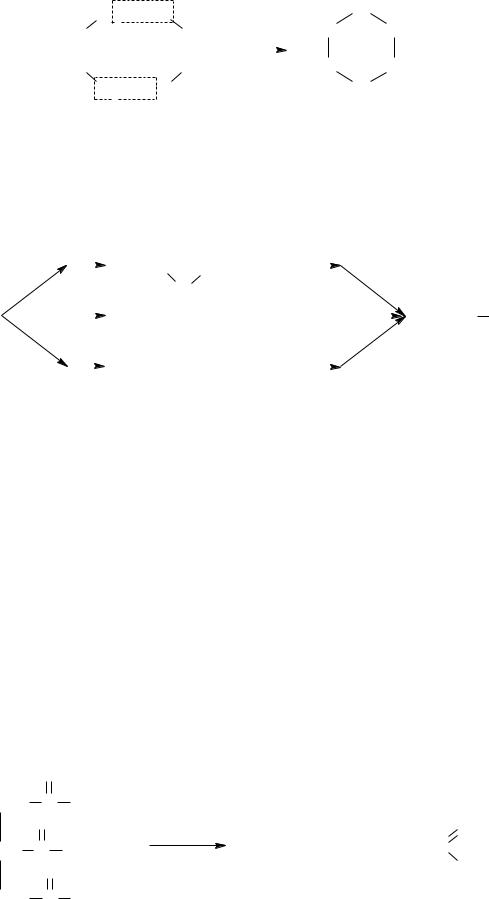
|
OH |
HO |
|
H2C |
|
CH2 |
|
|
|
|
|
H2C |
CH2 |
||
|
OH |
HO |
|
-2H |
2 |
O |
|
|
O
H2C CH2
H2C |
CH2 |
|
O |
диоксан
Этиленгликоль – это вязкая бесцветная жидкость, сладковатая на вкус, tкип = 197,2 °C. В промышленных масштабах получается из этилена по трем схемам.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+H O |
|||
. |
|
|
H2C |
|
|
|
CH2 |
2 |
|
|
|||||||
|
|
|
окислен |
|
|
|
|
|
|
|
|
|
|||||
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
возд |
Cl |
|
O |
|
|
|
|
|
+2H |
O |
||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H2C |
|
CH2 |
|
2 |
|
ClH2C |
|
|
|
|
CH2Cl |
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
+H O |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
HOH2C |
|
|
|
CH2Cl |
2 |
|
|
||||
|
|
|
гипохлорид. |
|
|
|
|
|
|
|
|
||||||
|
|
|
HOCl (Cl |
+ H O) |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
этиленхлоргидрин |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
HOH2C CH2OH
В смеси с водой этиленгликоль сильно понижает температуру еѐ замерзания. Например, 60 %-ный водный раствор гликоля замерзает при температуре – 49 °C и с успехом применяется как антифриз.
Большая гигроскопичность этиленгликоля используется для приготовления печатных красок. Большое количество этиленгликоля идѐт на получение пленкообразующих материалов, лаков, красок, синтетических волокон (например, лавсана – полиэтилентерефталата), диоксана, диэтиленгликоля и других продуктов.
2.1.2.2 Глицерин
Из ряда трѐхатомных спиртов, алкантриолов, практически важное применение находит лишь глицерин (пропантриол-1,2,3). Получают глицерин почти исключительно омылением жиров или синтезом из пропилена.
O
CH2 C C15H31 O
CH C C15H31
O
CH2 C C15H31
3NaOH
CH2 |
|
|
|
OH |
O |
||||
|
|
|
|||||||
|
|
|
|
OH + 3H31C15 |
|
C |
|||
|
CH |
|
|
ONa |
|||||
|
|
|
|||||||
|
|
|
|
|
|
OH |
|||
CH2 |
|
|
|
||||||
|
|
|
|
||||||
107
При обработке жиров щѐлочью получаются натриевые соли жирных кислот – мыла. Отсюда и название процесса щелочного гидролиза сложных эфиров – омыление.
Разработка процесса промышленного синтеза глицерина из пропилена позволила значительно сократить расход пищевых жиров на технические цели. Процесс протекает по следующей схеме:
H2C  CH CH3
CH CH3
Cl2 500 oC
H2C  CH CH2Cl
CH CH2Cl
Cl |
+H |
O |
||
2 |
2 |
|
||
|
HCl |
|
|
|
Cl OH Cl
H2C CH CH2
2H |
2 |
O |
|
|
HO OH OH H2C CH CH2
хлораллил 1,3-дихлорпропанол-2
Глицерин – вязкая, бесцветная, сладкая на вкус жидкость. Очень
гигроскопичен. tплав = 17,9 °C, tкип = 190 °C с разложением. Растворим в воде в любых соотношениях.
Химические свойства глицерина
– Из-за взаимного влияния гидроксильных групп кислотность их несколько повышается, и водородные атомы гидроксильных групп глицерина замещаются на металл при действии щелочных металлов, гидроксидов железа, меди, кальция, бария и других металлов. Получающиеся соединения называются глицератами.
2HOH2C |
|
CHOH |
|
CH2OH + 6Na |
|
|
2H2C |
|
|
CH |
|
CH2 + 3H2 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
NaO ONa ONa |
||||||
– В связи с повышенной |
кислотностью гидроксилов при |
||||||||||||
взаимодействии с HCl и HBr в реакцию вступают не все гидроксильные группы. Образуются только моно- и дигалогенгидрины глицерина.
HOH2C |
|
CHOH |
|
CH2OH |
HCl |
|
|
|
|
|
|||
|
|
|
|
ClH2C CHCl CH2OH
HCl
ClH2C CHOH CH2Cl
HOH2C CHCl CH2OH
ClH2C CHOH CH2OH
хлоргидрин
дихлоргидрин
Лишь с помощью галогенидов фосфора можно заместить все три гидроксила.
108

HOH2C CHOH CH2OH
PBr |
3 |
|
BrH2C CHBr CH2Br + P(OH)3
1, 2, 3-трибромпропан
– Взаимодействие глицерина с органическими и неорганическими кислотами даѐт полные и неполные сложные эфиры. Образующийся при обработке глицерина азотной кислотой полный эфир глицеринтринитрат под названием «нитроглицерин» идѐт на изготовление динамита.
|
CH2 |
|
|
OH |
|
|
CH2ONO2 |
|
|
|
|
|
|
||||||
|
|
|
|
OH + 3HNO3 |
|
|
|
|
|
|
CH |
|
|
|
|
CH2ONO2 |
+ 3H2O |
||
|
|
|
|||||||
|
|
|
|
|
|
||||
CH2 |
|
|
OH |
|
CH2ONO2 |
|
|||
|
|
|
|||||||
глицеринтринитрат
Аналогично получаются эфиры органических кислот.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|||
|
|
CH2 |
|
|
|
|
O |
|
|
CH2 |
|
|
|
|
C |
|
CH3 |
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
CH |
|
OH |
+ H3C |
|
C |
|
|
CH |
|
OH |
|||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
OH |
|
CH2 |
|
|
|
OH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
CH3COOH
. . . .
моноацетат
глицерина
Большое практическое значение имеют полиэфиры глицерина и фталевой кислоты – глифтали.
|
|
|
|
|
|
|
|
HC |
|
HC |
C |
|
C |
O |
|
H2C |
|
|
CH |
|
|
CH2 |
|
|
|
OH |
|||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
+ |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
|
HC |
C |
|
C |
||||
HO |
|
OH |
|
OH |
|
OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
Глифтали используются для изготовления лаков.
– Внутримолекулярная дегидратация глицерина приводит к образованию акролеина.
CH2  OH
OH 
 OH
OH C
C  H
H
H CH OH
CH OH
2H2O
|
|
|
|
|
|
|
CH2 |
|||||
CH2 |
изомеризация |
|||||||||||
|
|
|
|
|
|
|
|
|
||||
C |
CH |
|||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CHOH |
|
|
|
C |
|
O |
||||||
|
|
|
|
|||||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
H |
||
|
|
|
|
|
|
|
|
|
|
|||
акролеин
– Являясь одновременно первичным и вторичным спиртом, при
окислении глицерин даѐт смесь соответствующего гидроксиальдегида и гидроксикетона.
109

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
HOH2C |
|
|
|
CHOH |
|
C |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
глицериновый H |
||||||||||
HOH2C |
|
CHOH |
|
CH2OH |
|
|
альдегид |
||||||||||
|
|
|
|
HOH2C |
|
|
|
C |
|
CH2OH |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
O |
|||||||
диоксиацетон
Глицерин сильно гигроскопичен и поэтому широко употребляется как мягчительное средство в медицине и парфюмерии, в текстильной и полиграфической промышленности – для предохранения печатных красок от высыхания, в пищевой промышленности – для изготовления кондитерских изделий, ликѐров, прохладительных напитков. Большие количества глицерина идут на получение нитроглицерина, эпоксидных и глифталевых смол.
Спирты с четырьмя, пятью, шестью и т.д. гидроксильными группами встречаются в природе. Многие из них получены синтетически. Свойства и строение некоторых многоатомных спиртов будут рассмотрены в теме «Углеводы».
2.2 Фенолы и ароматические спирты
Ароматические гидроксисоединения делятся на две группы: фенолы и ароматические спирты. В фенолах гидроксильная группа непосредственно связана с ядром. Ароматические спирты содержат гидроксил в боковой цепи ароматического соединения.
2.2.1 Фенолы
В зависимости от числа гидроксильных групп различают одноатомные, двухатомные и т.д. фенолы. Называться фенолы могут по различным номенклатурам. Например:
H5C6 |
|
OH |
фенол |
|
H3C 
 OH п-крезол, 4-метилфенол
OH п-крезол, 4-метилфенол
HO
 OH резорцин, 1,3- дигидроксибензол, м-бензендиол
OH резорцин, 1,3- дигидроксибензол, м-бензендиол
110
