
МЕТОДИЧЕСКОЕ ПОСОБИЕ- Орг. химия-Часть 1
.pdf
– Образование полуацеталей и
действии на альдегиды спиртов.
O |
OH |
R C + HOR' |
R C OR' |
H |
H |
ацеталей происходит при
полуацетали (формально неполный эфир 1,1-гликоля)
Полуацетальный гидроксил обладает повышенной реакционной способностью.
При добавлении к смеси капли серной кислоты образуются ацетали.
|
|
OH |
|
|
|
OR |
|
|
|
|
|
H+ |
|||
R |
|
CH + ROH |
|
|
R |
|
CH + H2O |
|
|
||||||
|
|
||||||
|
|
|
|||||
|
|
OR |
|
|
|
OR |
|
Образование ацеталей кетонов протекает более сложно.
Реакции получения ацеталей обратимы. При гидролизе ацеталей выделяются свободные альдегиды.
– Полимеризация. Эта реакция характерна только для альдегидов и протекает в кислой среде (следы H2SO4).
Так, уксусный альдегид при внесении в него капли H2SO4 вскипает (экзотермическая реакция) и полимеризуется в шестичленное гетероциклическое соединение, называемое паральдегидом.
|
|
|
|
H3C |
|
|
O |
CH3 |
H3C |
|
|
O |
CH3 |
||
|
|
|
|
C |
C |
C |
C |
||||||||
|
|
O |
|
H |
H |
H |
H |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
3H3C |
|
C |
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
H3C |
O |
O |
CH3 |
||||||||
|
|
|
|
||||||||||||
|
|
H |
|
|
|
|
C |
|
|
|
|
|
|||
|
|
|
|
|
|
|
C |
C |
|||||||
|
|
|
|
|
|
|
|
H |
H |
||||||
|
|
|
|
|
|
H |
CH3 |
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
паральдегид |
|
метальдегид |
|
|||||||
При температуре 0 °C происходит тетрамеризация и образуется твѐрдый метальдегид, который используется как твѐрдое горючее «твердый спирт». Оба полимера легко деполимеризуются.
Реакции, обусловленные высокой подвижностью атомов водорода при -углеродах по отношению к карбонильной группе
– Галогенирование
|
|
|
|
O |
Cl2 |
|
|
|
|
|
O |
H3C |
|
CH2 |
|
C |
H3C |
|
|
CH |
|
C + HCl |
|
|
|
h |
|
|
|
||||||
|
|
|
|
|
|||||||
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
Cl |
|
|||
|
|
|
|
|
|
|
|
|
|
||
2-хлорпропаналь
131

Замещение идет исключительно у -углерода.
– Реакции альдольной и кротоновой конденсации
В процессе конденсации одновременно реализуются оба типа реакций альдегидов и кетонов: одна из молекул карбонильного соединения диссоциирует по активированной связи С Н -углерода и присоединяется по месту разрыва -связи карбонильной группы другой молекулы. Альдегиды конденсируются уже в слабоосновной среде (ацетат калия, К2СО3, K2SO3), кетоны реагируют труднее – в присутствии более сильных оснований, например, Ba(OH)2.
При конденсации уксусного альдегида образуется альдоль
(альдегидоалкоголь), процесс называется альдольной конденсацией.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||||
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H3C |
|
C |
+ H |
|
|
|
CH2 |
|
C |
|
H3C |
|
C |
|
CH2 |
|
C |
|
||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
альдоль (3-гидроксибутаналь, |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
-гидроксимасляный альдегид) |
|||||||||
Альдольная конденсация кетонов протекает по такой же схеме:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H3C |
|
C |
|
CH3 + H |
|
CH2 |
|
C |
|
CH3 |
|
H3C |
|
C |
|
CH2 |
|
C |
|
CH3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
OH |
|
O |
|
|
|||||||||
4-гидрокси-4-метилпентанон-2
Может протекать также конденсация альдегидов с кетонами:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
CH3 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
O |
||||||||||
H3C |
|
CH2 |
|
C |
CH3 + H3C |
|
|
CH |
|
C |
|
|
H3C |
|
CH2 |
|
C |
|
CH |
|
C |
|
|||||
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
H |
|||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
OH |
|||||||||||||
|
|
O |
|
|
|
|
|
|
|
|
|
||||||||||||||||
3-гидрокси-2,3-диметилпентаналь
Альдоль при нагревании отщепляет воду с образованием непредельного оксосоединения. Причѐм водород опять уходит от α-углерода по отношению к карбонильной группе. Из альдоля ацетальдегида при этом получается кротоновый альдегид, а альдоля ацетона – окись мезитила.
132

|
HO H |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H3C |
|
C |
|
CH |
|
|
C |
|
|
|
|
H3C |
|
CH |
|
|
CH |
|
C + H2O |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||
|
|
|
H |
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
кротоновый альдегид |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(бутен-2-аль) |
||||||||||||||||
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||||||||||||
H3C |
|
|
C |
|
|
|
CH |
|
|
C |
|
CH3 |
|
|
H3C |
|
C |
|
CH |
|
C |
|
CH3 + H2O |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
HO H O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4-метилпентен-3-он-2 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(окись мезитила) |
|||||||||||||||
Процесс альдольной конденсации совместно с последующей реакцией дегидратацией альдоля называется кротоновой конденсацией.
Конденсации типа альдольной и кротоновой могут происходить не только между одинаковыми, но и различными молекулами альдегидов и кетонов, а также между альдегидами и кетонами.
Все эти реакции имеют огромное значение в органическом синтезе.
Реакции окисления
Окисление альдегидов протекает значительно легче, чем кетонов, в присутствии как сильных (H2Cr2O7, KMnO4), так и слабых окислителей. При этом образуются кислоты с тем же числом атомов углерода.
– Альдегиды, но не кетоны, вступают в реакцию «серебряного зеркала», которая является качественной пробой на присутствие альдегидной группы.
|
|
O |
|
|
|
|
O |
H3C |
|
C + 2[Ag(NH3)2]OH |
|
H3C |
|
C |
+ 3NH3 + H2O + 2Ag |
|
|
|
|||||
|
|
H |
|
|
|
|
ONH4 |
Реакция с фелинговой жидкостью также характерна только для альдегидов. Фелингова жидкость – это водно-щелочной раствор комплексной соли гидроксида меди и натрийкалиевой соли винной кислоты.
COONa |
|
|
|
|
|
|
|
|
|
COONa |
||
|
|
|
|
|
O |
|
|
|
|
O |
|
|
COOH |
|
|
|
|
|
|
|
COOH |
||||
|
R |
|
C |
|
|
|
|
|
||||
|
+ Cu(OH)2 |
+ |
|
|
R |
|
C |
+ Cu2O + |
|
+ 2H2O |
||
|
|
|
|
|
||||||||
COOH |
|
|
|
H |
|
|
|
|
OH |
COOH |
||
|
|
|
|
|
|
|
|
|
|
|
||
COOK |
|
|
|
|
|
|
|
|
|
COOK |
||
Красно-коричневая Cu2O выпадает в осадок.
133

– Кетоны окисляются в жѐстких условиях с разрывом углеродной цепи по обе стороны от карбонильной группы с образованием смеси кислот и кетонов. По составу этой смеси можно судить о строении исходного кетона.
H3C CH2 CH2 |
C |
|
O |
|
|
|
|
CH |
CH3 |
|
|
|
|||
|
|
O |
CH3 |
|
|
|
|
O |
|
|
O |
O |
|
O |
|
2H3C CH2 |
C |
|
+ H3C CH C |
+ H3C CH2 CH2 C |
|
+ H3C C O |
|
|
|
|
|||||
|
|
|
OH |
OH |
|
OH |
CH3 |
|
|
|
|
CH3 |
|
|
|
|
пропионовая |
изомасляная |
масляная |
|
ацетон |
||
Получающиеся кетоны могут окислятся по такой же схеме далее.
Таким образом, наряду с общностью в химических свойствах
альдегидов и кетонов при изучении их свойств обнаруживаются и существенные различия: альдегиды легко окисляются без изменения углеродного скелета, кетоны окисляются трудно с разрывом углеродной цепи; альдегиды полимеризуются в присутствии кислот, образуют альдегидаммиаки, ацетали. Кетоны не вступают в эти реакции.
Отдельные представители
Муравьиный альдегид (формальдегид). Это бесцветный газ с резким специфическим запахом, tкип° = –21 °C . Формальдегид в виде 40 %-ного водного раствора, содержащего 5 %…8 % метанола, получают в значительных количествах каталитическим окислением метанола. Это так называемый формалин. Формалин используется как дезинфицирующее средство.
Всѐ большее значение приобретает способ получения формальдегида неполным окислением метана или углеводородов крекинга нефтяных фракций.
Из-за отсутствия в молекуле формальдегида алкильной группы ему присущи некоторые специфические свойства.
– Реакция Канниццаро. В щелочной среде часть молекул формальдегида восстанавливается до метанола, другая часть за счѐт кислорода воды окисляется до муравьиной кислоты.
|
|
O |
KOH |
|
|
O |
||
2H |
|
C + H O |
CH OH + H |
|
C |
|||
|
|
|
|
|
||||
2 |
|
|
|
3 |
|
OK |
||
|
|
H |
|
|
|
|
|
|
|
|
|
134 |
|
|
|
||

–Реакция с аммиаком, которая упоминалась ранее.
–Сухой газообразный формальдегид в присутствии катализаторов [Fe(CO)5] способен к полимеризации.
O
2nH C 
 ( H2C O C )n H
( H2C O C )n H
Полиформальдегид не растворим ни в одном растворителе и идѐт на изготовление синтетического волокна и различных изделий.
– При конденсации с фенолом получаются фенолформ-альдегидные смолы, с мочевиной – карбамидные смолы, имеющие широкое применение.
Уксусный альдегид (ацетальдегид)
Кипит при температуре 21 °C. Ацетальдегид получают гидратацией ацетилена, дегидрированием этилового спирта, изомеризацией окиси этилена, каталитическим окислением углеводородов. Он служит важным полупродуктом в промышленных синтезах этанола, уксусной кислоты, кротонового и масляного альдегидов, пентаэритрита, альдоля, ацеталей и других веществ.
Ацетон
Температура кипения 56,1 °C. Ацетон является многотоннажным растворителем. В промышленности он получается совместно с фенолом через гидроперекись изопропилбензола. Он является также исходным продуктом для синтеза метакриловой кислоты и метилметакрилата (мономер для получения «органического стекла» и других полимеров), кетена, СН2=С=О, из которого получают уксусный ангидрид, и других продуктов.
4.2 Ненасыщенные карбонильные соединения
Акролеин
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
H2C |
|
|
CH |
|
C |
|
(пропен-2-аль) |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||||||
|
|
Акролеин получают кротоновой конденсацией формальдегида с |
||||||||||||||||||||||||||||||
ацетальдегидом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
O |
-H2O |
|
|
|
|
O |
||||||||||||
H |
|
C |
+ H3C |
|
C |
|
|
|
|
|
|
HOH2C |
|
CH2 |
|
|
C |
H |
H2C |
|
CH |
|
C |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
H |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||||||||||
|
|
|
и каталитическим окислением пропилена. |
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+O2 |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
||||
|
|
|
H2C |
|
CH |
|
|
CH3 |
H2C |
|
|
CH |
|
C + H2O |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
H
135

Он получается также дегидратацией глицерина (смотри реакции многоатомных спиртов), образующегося гидролизом растительных масел при длительном нагревании их на открытом воздухе (приготовление чипсов, жарка и т. п.) и является вредным для здоровья человека компонентом пищи.
Акролеин проявляет свойства алкена и альдегида одновременно. Он имеет сопряжѐнную систему двойных связей.
|
|
|
|
|
H2C  CH CH
CH CH O
O
Присоединение HBr протекает по типу 1,4 в соответствии с распределением зарядов. Получающийся нестойкий енол благодаря таутомерному превращению переходит в устойчивую карбонильную форму. В результате HBr оказывается присоединенным по двойной связи вопреки правилу Марковникова.
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
H2C CH |
CH O + HBr |
BrH2C CH CH OH |
BrH2C CH2 C |
|||
|
|
|
|
|
|
H |
(неустойчив.) 3-бромпропаналь
Используется акролеин для получения пластмасс.
Кротоновый альдегид
O
H3C CH CH C
CH C
(2-бутеналь) H
Получается кротоновой конденсацией ацетальдегида. Используется в производстве масляного альдегида, масляной кислоты, малеинового ангидрида.
Метилвинилкетон (бутенон-2)
H3C C CH CH2 O
CH2 O
Используется в производстве полимеров.
4.3 Ароматические карбонильные соединения
Ароматические альдегиды и кетоны имеют карбонильную группу
>С=О, непосредственно связанную с углеродом ароматического цикла или находящуюся в боковой цепи. Соединения с карбонильной группой в боковой цепи проявляют свойства, аналогичные свойствам альдегидов и кетонов алифатического или алициклического рядов.
136
Названия альдегидов первого типа даются по названиям соответствующих им ароматических кислот, второго типа – называются как арилзамещѐнные альдегидов жирного ряда.
|
|
|
|
|
|
O |
|
||||||
H5C6 |
|
|
|
|
C |
бензойный альдегид |
|||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
H |
|
||||||
|
|
|
|
|
|
|
|
|
|
O |
|
||
H3C |
|
|
C6H4 |
|
|
|
C |
о-, м- или п-толуиловый альдегиды |
|||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
||
|
|
|
|
|
|
|
|
|
|
O |
|
||
H5C6 |
|
|
|
CH2 |
|
|
|
C |
фенилуксусный альдегид |
||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
H3C |
|
|
|
C6H4 |
|
CH2 |
|
C |
толилуксусный альдегид |
||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
Кетоны называют по радикалам или как «производные» кислот.
H5C6 C CH3
O
H5C6 C C2H5
O
H5C6 C C6H5
O
метилфенилкетон или ацетофенон (ацето остаток уксусной кислоты; фен радикал фенил;
он характерное окончание для кетонов).
фенилэтилкетон или пропиофенон (остаток пропионовой кислоты).
дифенилкетон или бензофенон (остаток бензойной кислоты).
Способы получения
Для получения ароматических альдегидов и кетонов в большинстве случаев могут использоваться обычные методы синтеза кетонов и альдегидов, рассмотренные ранее. Однако имеются и оригинальные методы получения этих соединений
– Окисление ароматических углеводородов с боковой цепью
(преимущественно для альдегидов).
Реакция в жидкой фазе идѐт в присутствии смеси MnO2 + 60 % H2SO4 , в газовой фазе окисление приводят кислородом воздуха в присутствии катализатора V2O5.
137
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
|
||||
H5C6 |
|
CH3 |
|
H5C6 |
|
C |
|||
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
H
– Гидролиз геминальных дигалогенпроизводных в присутствии
железа в качестве катализатора.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
H5C6 |
|
CHCl2 + 2H2O |
|
|
H5C6 |
|
HC |
OH |
+ 2HCl |
|||
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
H5C6 |
|
|
C |
+ H2O |
|||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
H |
|
|
|
– Прямое введение альдегидной группы в ядро (реакция Гаттермана-Коха). Реакция протекает при пропускании оксида углерода и хлористого водорода во взвесь углеводорода и AlCl3. Предполагается, что промежуточным продуктом является хлористый формил.
|
|
O |
CO + HCl |
|
Cl C |
|
|
H |
CH3 |
|
CH3 |
|
O |
|
+ Cl C |
|
+ HCl |
|
H |
AlCl3 |
|
|
|
|
|
O |
|
|
C |
|
|
H |
Таким образом из гваякола получают ванилин
OH |
|
OH |
O |
CH |
O CH3 |
|
3 |
|
C 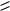 O H
O H
– Подобную реакцию используют и для получения кетонов. При этом на ароматический углеводород действуют галогенангидридами или ангидридами кислот в присутствии безводного хлористого алюминия
(реакция Фриделя-Крафтса)
138

H5C6 |
|
H + Cl |
|
C |
|
|
|
C6H5 |
|
AlCl3 |
H5C6 |
|
|
|
|
C |
|
C6H5 + HCl |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензофенон |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
C |
AlCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
H5C6 |
|
|
H + |
|
|
|
O |
3 |
|
H5C6 |
|
|
C |
|
|
|
CH3 + H3C |
|
C |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
H3C |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||
|
|
|
|
|
|
|
|
O |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
O |
ацетофенон |
|
Химические свойства
Ароматическим альдегидам и кетонам свойственно большинство реакций альдегидов и кетонов алифатического ряда.
Они присоединяют синильную кислоту, реагируют с гидразином и его производными. Оксидом серебра альдегиды окисляются до кислот. Однако они вступают и в специфические реакции, не характерные для карбонильных соединений алифатического ряда.
–При хранении ароматические альдегиды интенсивно самопроизвольно окисляются кислородом воздуха до кислот.
Реакция ускоряется светом и катализаторами – солями металлов. Фенол и амины ингибируют окисление.
–Реакция Канниццаро
Протекает в водных или спиртовых растворах щелочей. При этом одна молекула ароматических альдегидов окисляется до кислоты, другая
– восстанавливается до спирта.
|
|
O |
|
|
O |
|
|
|
|
O |
|
|
H |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H5C6 |
|
C |
+ KOH + H5C6 |
|
C |
|
H5C6 |
|
C |
|
+ H5C6 |
|
C |
|
OH |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
H |
|
|
H |
|
|
|
|
OK |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Большинство алифатических альдегидов в условиях реакции Канниццаро подвергаются осмолению (полимеризации).
– При электрофильном замещении альдегидная группа
ориетирует в мета-положение.
H |
|
O |
|
H |
O |
C |
|
C |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
+ |
||
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
139 |
|
–Ароматические альдегиды весьма реакционноспособные соединения и легко вступают в различные реакции конденсации с альдегидами, кетонами, эфирами и ангидридами кислот алифатического ряда и между собой.
–Ароматические кетоны менее реакционноспособны по
сравнению с алифатическими. Они, например, не |
присоединяют |
гидросульфит натрия. |
|
Отдельные представители
Бензойный альдегид – жидкость с запахом горького миндаля Кипит при температуре 179 °С. Легко окисляется на воздухе до бензойной кислоты. Используется в производстве красителей и душистых веществ.
Ацетофенон. tплав= 20 °С, tкип= 202 °С. Имеет запах цветов черѐмухи. Применяется в парфюмерии.
Бензофенон применяется в парфюмерной промышленности.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1 Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия : учебник для вузов / под редакцией Стадничука М.Д. – 5-е изд., перераб. и доп. – СПб. : «Иван Федоров», 2002. – 624 с.
2 Несмеянов А.Н., Несмеянов Н.А. Начала органической химии :
в 2 т. – М. : Химия, 1974.
3 Физер А., Физер М. Органическая химия : в 2 т. – М. : Химия,
1970.
4Моррисон Р., Бойд Р. Органическая химия. – М. : Мир, 1974. –
1134 с.
5Нечаев А.П., Еременко Т.В. Органическая химия. – М. : Высшая школа, 1985. – 464.
140
