
МЕТОДИЧЕСКОЕ ПОСОБИЕ- Орг. химия-Часть 2
.pdfМинистерство образования Республики Беларусь
Учреждение образования «Могилевский государственный университет продовольствия»
Кафедра химической технологии высокомолекулярных соединений
Г. Н. Роганов
ОРГАНИЧЕСКАЯ ХИМИЯ
Учебно-методическое пособие
Вдвух частях
Часть 2
Могилев 2013
2
УДК 547 ББК 24.2 Р59
Рецензенты: кандидат химических наук, доцент кафедры ХТВМС МГУП О. М. Баранов; кандидат химических наук, доцент кафедры химии Могилевского государственного университета им. А.А. Кулешова А. Я. Гузиков
Рекомендовано кафедрой химической технологии высокомолекулярных соединений МГУП
Утверждено научно-методическим советом МГУП
Роганов, Г. Н.
Р59 Органическая химия : учеб.-метод. пособие : в 2 ч. / Г. Н. Роганов. – Могилев : МГУП, 2013. – Ч. 2. – 128 с.
ISBN 978-985-6979-77-7 (Ч. 2). ISBN 978-985-6979-69-2.
В учебном пособии с позиций современной теории строения органических соединений систематически излагаются основы органической химии. Предназначается для студентов технологических специальностей пищевой промышленности.
|
УДК 547 |
|
ББК 24.2 |
ISBN 978-985-6979-77-7 (Ч. 2) |
© Роганов Г. Н., 2013 |
ISBN 978-985-6979-69-2 |
© Учреждение образования |
|
«Могилевский государственный |
|
университет продовольствия», 2013 |
Содержание
ЧАСТЬ 1
Предисловие
ВВЕДЕНИЕ
Предмет органической химии Строение и реакционная способность органических соединений
Определение строения органических соединений Классификация органических соединений Основные сырьевые источники органических соединений
1УГЛЕВОДОРОДЫ
1.1Алканы
1.2Алкены
1.3Диеновые углеводороды
1.4Алкины
1.5Алициклические углеводороды
1.6Ароматические углеводороды
2 ГИДРОКСИСОЕДИНЕНИЯ
2.1Спирты
2.1.1Одноатомные спирты
2.1.1.1Насыщенные одноатомные спирты
2.1.1.2Ненасыщенные одноатомные спирты
2.1.2Многоатомные спирты
2.1.2.1Гликоли
2.1.2.2Глицерин
2.2Фенолы и ароматические спирты
3 ПРОСТЫЕ ЭФИРЫ
3.1Алифатические простые эфиры
3.2Циклические простые эфиры (эпоксисоединения).
4 КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
4.1Насыщенные карбонильные соединения
4.2Ненасыщенные карбонильные соединения
4.3Ароматические карбонильные соединения
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ Приложение А. Учебно-методические материалы для самостоятельной работы студентов
Приложение Б. Модульно-рейтинговая система аттестации студентов по органической химии
4
ЧАСТЬ 2 |
|
|
5 КАРБОНОВЫЕ КИСЛОТЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
5 |
|
5.1 |
Алифатические карбоновые кислоты . . . . . . . . . . . . . . . . . . . . |
5 |
5.1.1 Одноосновные насыщенные кислоты . . . . . . . . . . . . . . . . |
5 |
|
5.1.2 Одноосновные ненасыщенные кислоты . . . . . . . . . . . . . . . |
16 |
|
5.1.3 Двухосновные насыщенные кислоты . . . . . . . . . . . . . . . . . |
18 |
|
5.1.4 Двухосновные ненасыщенные кислоты . . . . . . . . . . . . . . . |
21 |
|
5.2 |
Ароматические карбоновые кислоты . . . . . . . . . . . . . . . . . . . . |
22 |
6 ЖИРЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
27 |
|
7 АМИНЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
34 |
|
7.1 |
Алифатические амины . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
34 |
7.2 |
Ароматические амины . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
39 |
8АРОМАТИЧЕСКИЕ ДИАЗО- И АЗОСОЕДИНЕНИЯ,
КРАСИТЕЛИ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
44 |
|
9 ГИДРОКСИКИСЛОТЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
49 |
|
9.1 Алифатические гидроксикислоты . . . . . . . . . . . . . . . . . . . . . . . |
49 |
|
9.2 Оптическая изомерия органических соединений . . . . . . . . . . . |
53 |
|
9.3 Ароматические гидроксикислоты (фенолокислоты) . . . . . . . |
63 |
|
10 АМИНОКИСЛОТЫ, ПОЛИПЕПТИДЫ . . . . . . . . . . . . . . . . . . |
65 |
|
10.1 |
Аминокислоты . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
65 |
10.2 |
Полипептиды . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
69 |
11 АЛЬДЕГИДО- И КЕТОКИСЛОТЫ . . . . . . . . . . . . . . . . . . . . . |
72 |
|
12 УГЛЕВОДЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
74 |
|
12.1 |
Моносахариды . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
74 |
12.2 |
Дисахариды . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
93 |
12.3 |
Полисахариды . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
96 |
13 ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ . . . . . . . . . . . . . . . |
99 |
|
13.1 |
Пятичленные гетероциклические соединения . . . . . . . . . . . . |
100 |
13.2 |
Шестичленные гетероциклические соединения . . . . . . . . . . |
111 |
14 ТЕРПЕНЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
118 |
|
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ . . . . . . . . . . . . . |
122 |
|
Приложение А. Учебно-методические материалы для самостоя- |
|
|
тельной работы студентов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
123 |
|
Приложение Б. Модульно-рейтинговая система аттестации |
|
|
студентов по органической химии . . . . . . . . . . . . . . . . . . . . . . . . . . . |
126 |
|
5 КАРБОНОВЫЕ КИСЛОТЫ
В состав органических карбоновых кислот в качестве функциональной
5

входит карбоксильная группа
O
C
OH
В зависимости от числа этих групп различают одно-, двух-, трёх-… многоосновные кислоты. В зависимости от типа присоединенного к карбоксилу радикала они обычно подразделяются на алифатические (насыщенные и ненасыщенные), алициклические, ароматические и т.д.
5.1 Алифатические карбоновые кислоты
5.1.1 Одноосновные насыщенные кислоты
Гомологический ряд этих кислот начинается муравьиной кислотой
O
H C
OH
Изомерия кислот этого ряда определяется строением углеводородного радикала при карбоксильной группе и начинается с четвёртого члена ряда. Тривиальные названия карбоновых кислот привились очень прочно и широко используются наряду с названиями по номенклатуре ИЮПАК. Названия кислот по этой номенклатуре производятся от названия соответствующего углеводорода с добавлением суффикса -овая кислота. Иногда эти кислоты называют как производные уксусной кислоты.
H |
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
муравьиная, метановая |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
CH3 |
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
уксусная, этановая |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
CH3 |
|
|
|
CH2 |
|
|
|
|
|
COOH |
пропионовая, пропановая |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
CH3 |
|
|
|
|
CH2 |
|
|
|
|
|
CH2 |
|
|
|
COOH |
масляная, бутановая |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
COOH |
изомасляная, 2-метилпропановая |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
CH2 |
|
|
|
CH2 |
|
|
CH2 |
|
COOH |
валериановая, пентановая |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
CH3 |
|
|
|
|
|
CH |
|
|
|
CH2 |
|
|
COOH |
изовалериановая, 3-метилбутановая |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH3 |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
CH |
|
|
COOH |
метилэтилуксусная, 2-метилбутановая |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|||||||||
CH3 |
|
(CH2)4 |
|
|
|
|
|
COOH |
капроновая, гексановая |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
CH3 |
|
(CH2)5 |
|
|
|
COOH |
энантовая, гептановая |
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
CH3 |
|
|
|
|
|
|
|
|
|
(CH2)6 |
|
|
|
COOH |
каприловая, октановая |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
CH3 |
|
|
|
|
|
|
|
|
|
(CH2)7 |
|
COOH |
пеларгоновая, нонановая |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
6
CH3 |
|
(CH2)14 |
|
|
COOH |
пальмитиновая, гексадекановая |
||
|
|
|
||||||
CH3 |
|
|
(CH2)16 |
|
COOH |
стеариновая, октадекановая |
||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
и т.д. |
Способы получения
– Способы, основанные на окислении:
а) окисление первичных спиртов (см. тему «Гидроксисоединения»); б) окисление альдегидов (см. тему «Карбонильные соединения»); в) окисление предельных углеводородов кислородом воздуха на
катализаторе. При окислении синтина (см. тему «Алканы») этот способ даёт смесь кислот с разной длиной цепи и используется в промышленности при производстве моющих средств.
– Гидролиз нитрилов, которые получают действием цианида калия на галогеналкилы
R− Cl + KCN  R− CN + KCl
R− CN + KCl
R |
|
|
|
C |
|
|
N + 2H2O |
|
|
|
|
|
|
R |
|
|
COONH4 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
R |
|
|
|
COONH4 + HCl |
|
|
|
R |
|
|
COOH + NH4Cl |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
– Гидролиз геминальных тригалогеналканов |
|
||||||||||||||||||||||||||||||||||||
R− CCl + 3H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
R |
|
|
C |
|
|
|
|
|
|
|
|
|
|
R |
|
|
C |
|
|||||||||||||||
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
– Синтез через магнийорганические соединения |
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
HBr |
|
|
|
|
|
O |
|
|||||||
R− MgBr + CO2 |
|
|
|
|
|
R |
|
C |
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
C |
+ MgBr2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OMgBr |
OH |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– Оксосинтез – промышленный метод получения карбоновых кислот. Он заключается в действии на олефины оксида углерода (II) и водяного пара при 300…400 °С в присутствии катализаторов (например, Ni(CO)4)
O
H2C |
|
CH2 + CO + H2O |
|
CH3 |
|
CH2 |
|
C |
|
|
|||||||
|
|
|
|
|||||
|
|
OH
Физические свойства
Муравьиная, уксусная и пропионовая кислоты легкоподвижные бесцветные жидкости с характерным острым запахом. С водой
7

смешиваются во всех отношениях. Кислоты С4 – С9 – маслянистые жидкости. Растворимость их в воде сильно уменьшается с ростом молекулярной массы. Кислоты С10 и выше – твёрдые кристаллические вещества, нерастворимые в воде.
Температуры кипения их растут по мере увеличения молекулярной массы. Сравнительно со спиртами, имеющими то же число углеродных атомов, кислоты кипят выше. Например, этиловый спирт кипит при 78,3 °С, а уксусная кислота – при 118,5 °С. Это объясняется большей ассоциацией молекул кислоты и образованием ею более прочных ассоциатов. Физические измерения указывают в основном на димеризацию за счёт водородных связей.
|
|
|
δ − |
..... |
|
|
|
|
|
|
|
δ |
+ O |
H O δ |
+ |
|
|||||
|
|
|
|
|||||||
R |
|
C |
|
|
|
|
C |
|
R |
|
|
|
|
|
|||||||
|
|
|
|
|
||||||
|
|
|
O |
|
H .....Oδ − |
|
|
|||
|
|
|
|
|
|
|||||
Кислоты с чётным числом углеродных атомов плавятся при более высокой температуре, чем кислоты с нечётным числом.
Химические свойства
– Карбоновые кислоты – это протонные кислоты. При диссоциации они выделяют протон
карбоксилатный ион
O |
|
1/2e |
|
|
OH |
R C |
R HC |
+ H+ |
OH |
|
O1/2e |
H
Кислотные свойства объясняются перераспределением электронной плотности в карбоксильной группе в сторону кислорода.
δ −
 O
O
δ +C
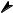 δ +
δ +
OH
Вследствие этого связь О – Н ослабляется и сравнительно легко разрывается. Величина константы диссоциации фактически зависит от
величины дробного положительного заряда на карбоксильном углероде. Чем он выше, тем сильнее кислота. Степень диссоциации или, другими словами, сила кислот зависит также от величины и характера радикала, соединённого с карбоксильной группой. Алкильные радика-
8
лы посредством индукционного эффекта повышают электронную плотность в карбоксиле (понижают положительный заряд на карбоксильном углероде), тем самым, понижая силу кислоты.
|
δ − |
|
δ + |
O |
|
CH3 CH2 C |
O |
δ + |
|
H |
С увеличением алкильного радикала константы диссоциации карбоновых кислот несколько уменьшается. Так, константа диссоциации муравьиной кислоты Н–СООН 2,17·10-4, уксусной СН3–СООН 1,76·10-5 и капроновой СН3–СН2–СН2–СН2–СН2–СООН 1,31·10-5.
Введение в радикал электрофильной, электронооттягивающей группы, напротив, увеличивает силу кислоты. К примеру, константа диссоциации хлоруксусной кислоты 1,40·10-3.
|
δ − |
|
|
|
O |
|
|
CH2 |
δ +C |
δ + |
|
Cl |
O |
||
H |
– Как всякие кислоты, карбоновые кислоты способны к
образованию солей с металлами, их оксидами и гидрооксидами
|
|
|
O |
|
|
|
|
O |
CH3 |
|
C |
+NaOH |
|
CH3 |
|
C |
+ H2O |
|
|
|
||||||
|
|
|
OH |
|
|
|
|
ONa |
ацетат натрия, этаноат натрия
Пиролизом кальциевых солей получают альдегиды и кетоны, пиролизом натриевых в присутствии NаОН – углеводороды.
– При действии на кислоты галогенидов фосфора или тионилгалогенида образуются галогенангидриды кислот
|
|
|
|
|
O |
|
|
|
|
|
|
O |
CH3 |
|
|
C |
+ PCl5 |
|
|
|
CH3 |
|
C |
+ POCl3 + HCl |
|
|
|
|
|
|
||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|
Cl |
|
|
|
|
O |
|
|
|
|
|
|
O |
|
CH |
|
|
C |
+ SOCl2 |
|
|
|
CH3 |
C |
+ SO2 + HCl |
||
|
|
|
|
|
||||||||
|
|
|
|
|||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
Галогенангидриды кислот называют по кислоте и галогену (хлорангидрид уксусной кислоты), а также по кислотному радикалу
ацилу
9

|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
C |
Ο Η |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
хлористый формил, хлористый метаноил |
|||||||||
H |
|
C |
|
|
Сl |
|
|||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
O |
|
хлористый ацетил, хлористый этаноил |
|||||
CH3 |
|
|
|
C |
|
||||||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|||
|
|
|
|
|
|
|
|
O |
|
Бромистый |
пропионил, |
бромистый |
|||
C2H5 |
|
|
|
|
C |
|
|||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
Br |
O |
пропаноил |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
хлористый изобутирил, |
|
||
CH3 |
|
|
|
|
|
CH |
|
C |
|
||||||
|
|
|
|
|
хлористый 2-метилпропаноил |
|
|||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
||
|
|
|
|
|
|
CH3 |
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||
В галоидангидридах кислот галоид чрезвычайно подвижен и легко вступает в реакции обмена. Причиной подвижности галоида является большой положительный заряд на углероде (δ+), который связан сразу с двумя электронооттягивающими атомами – кислородом и галогеном.
δ −
O
δ +C |
δ − |
Cl
Этот углерод легко подвергается атаке нуклеофильных реагентов. В реакциях галогенангидридов с соединениями, содержащими
металлы или активный атом водорода, происходит замена атомов металла или водорода на ацил. Реакция называется ацилированием. Например, в случае уксусной кислоты – это ацетилирование.
Ацилированием получают целый ряд производных кислот: соли, ангидриды, сложные эфиры, амиды, нитрилы и др. Например:
а) гидролиз хлорангидрида или ацетилирование воды
|
|
O |
|
|
|
O |
CH3 |
|
C + HOH |
|
HCl + CH3 |
|
C |
|
|
|
||||
|
|
Cl |
|
|
|
OH |
б) алкоголиз хлорангидрида или ацетилирование спиртов
10
