
МЕТОДИЧЕСКОЕ ПОСОБИЕ- Орг. химия-Часть 2
.pdf
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|||
|
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
OH |
|
|||||
|
|
|
|
|
C |
|
|
|
|
C17H35 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
+H2O |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 3C17H35COOH |
|
CH |
|
|
|
|
O |
|
|
C |
|
|
C17H35 |
|
CH |
|
|
|
|
OH |
||||||
|
|
|
|
|
|
|
[HЕ ] |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
стеариновая |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
O |
|
|
|
C |
|
|
|
C17H35 |
|
CH2 |
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
тристеарат |
|
глицерин |
|
|||||||||||||||||||
|
|
глицерина |
|
|
|
|
|
|
|
|
|
|||||||||||||
Гидролиз жиров может протекать и биохимическим путем под действием фермента пищеварительного тракта липазы.
Гидролиз жиров может медленно протекать при длительном хранении жиров в открытой упаковке или термической обработке жиров
вусловиях доступа паров воды из воздуха. Характеристикой накопления
вжире свободных кислот, придающих жиру горечь и даже токсичность является «кислотное число»: число мг КОН, пошедшее на титрование кислот в 1г жира.
– Омыление:
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
C |
|
|
C15H31 |
|
|
CH2 |
|
OH |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NaOH |
|
|
|
+ 3 C15H31 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
||
|
CH |
|
|
|
|
O |
|
|
|
|
C |
|
|
C15H31 |
CH |
|
|
|
OH |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
O |
|
|
|
O |
|
|
C15H31 |
H2O |
|
|
|
|
|
OH |
|
|
ONa |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
CH2 |
|
|
|
|
|
|
C |
|
|
|
|
CH |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||
мыло
Мылами называют соли щелочных металлов жирных кислот, содержащих 10…18 углеродных атомов. Они имеют длинную, препятствующую растворению в воде углеводородную цепь, связанную со способствующим растворению карбоксилатным ионом, и поэтому действуют как смачивающие, эмульгирующие агенты и детергенты (моющие средства). Натриевые и калиевые мыла растворимы в воде и хорошо «мылятся». Калиевые соли высших жирных кислот дают жидкое
мыло, натриевые − твердое. Соли магния, кальция, бария и некоторых других металлов очень плохо растворяются в воде; поэтому обычные мыла в жесткой воде переходят в нерастворимое состояние, не «мылятся», не пенятся, становятся липкими.
Наиболее интересными и полезными реакциями углеводородных радикалов являются реакции по двойным связям:
31

– Присоединение брома
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
C |
|
|
|
|
|
C17H35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ Br2 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
C17H35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
CH |
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
CH |
|
|
(CH2)7 |
|
CH3 |
|
|
|
||||||||||||
|
CH2 |
|
|
|
O |
|
C |
|
|
(CH2)7 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
1,2-дистеарат-3-олеат глицерина |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
C17H35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
C |
|
|
|
|
C17H35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
(CH |
) |
|
|
|
C |
|
C |
|
(CH |
) |
|
|
CH |
||||||||||||
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
7 |
|
7 |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
3 |
||||||||||||
Br Br
Степень ненасыщенности жира (важная технологическая характеристика) контролируется по «йодному числу»: число мг йода, пошедшее на титрование 100 г жира в процентах (анализ с бисульфитом натрия).
– Гидрогенизация жиров Жидкие растительные масла (подсолнечное, хлопковое, соевое и
другие) в присутствии катализаторов (например, губчатый никель) при температуре 175…190 °С и давлении 1,5…3,0 атм гидрируются по двойным С = С связям углеводородных радикалов кислот и
превращаются в твёрдый жир – саломас. При добавлении к нему так называемых отдушек для придания соответствующего запаха и яиц, молока, витаминов и других ингредиентов для улучшения питательных качеств получают маргарин. Саломас используется также в мыловарении, фармации (основы для мазей), косметике, для изготовления технических смазок и т.д.
Пример реакции гидрогенизации:
32
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH2 |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
(CH2)7 |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
(CH2)7 |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3Н2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)7 |
|
|
|
|
|
|
CH3 |
|||||||||||
|
|
CH |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
(CH2)7 |
|
|
|
|
|
CH |
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ni, t, p |
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH2 |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
(CH2)7 |
|
|
|
|
CH |
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
(CH2)7 |
|
|
|
|
|
CH3 |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
триолеат глицерина |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
CH2 |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)7 |
|
|
|
CH2 |
|
|
|
|
|
|
|
(CH2)7 |
|
|
|
|
|
|
|
CH3 |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)7 |
|
|
|
CH2 |
|
|
|
CH2 |
|
|
|
|
|
|
(CH2)7 |
|
|
|
|
CH3 |
|
|||||||||||||||||||||||||||||||
|
CH |
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
(CH2)7 |
|
|
|
|
|
CH |
|
|
|
|
|
CH |
|
|
|
|
|
(CH |
) |
|
|
|
|
|
|
|
|
CH |
|
||||||||||||||||||||||||
CH2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
7 |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
2 |
|
|
|
3 |
|
|||||||||||||||||||||||||
тристеарат глицерина
– Окисление
Окисление перманганатом калия в водном растворе приводит к образованию насыщенных остатков дигидроксикислот (реакция Вагнера)
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
C |
|
|
(CH2)7 |
|
CH |
|
|
|
CH |
|
(CH2)7 |
|
CH3 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
C |
|
|
C17H35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 2KMnO4 + 4H2O |
[OH]− |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
C |
|
C17H35 |
|
OH OH |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
||||||||||||||||||
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
C |
|
|
(CH2)7 |
|
|
CH |
|
|
CH |
|
(CH2)7 |
|
CH3 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH |
|
|
O |
|
|
|
|
|
|
C17H35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 2KOH + 2MnO2 |
|
||||||
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
C |
|
C17H35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
33

– Окислительное прогоркание жиров
Под действием влаги, света, повышенной температуры, а также следов железа, кобальта, меди, марганца в виде солей, содержащиеся в глицеридах остатки высших жирных кислот (прежде всего, ненасыщенных) медленно окисляются кислородом воздуха. Этот процесс протекает по цепному радикальному механизму и самоускоряется образующимися продуктами окисления. На первой стадии окисления кислород присоединяется по месту двойных связей, образуя пероксиды:
R1 |
|
CH2 |
|
CH |
|
CH |
|
CH2 |
|
R2 + O2 |
|
R1 |
|
CH2 |
|
|
CH |
|
|
CH |
|
CH2 |
|
R2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Кислород также |
может |
взаимодействовать |
|
с активированной |
|||||||||||||||||||||
α-ме-тиленовой группой при двойной связи с образованием
гидропероксидов:
R1 CH2 |
|
CH |
|
CH |
|
CH2 |
|
R2 + O2 |
|
R1 CH2 |
|
CH |
|
CH |
|
|
CH2 |
|
R2 |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O OH |
|||
Пероксиды и гидропероксиды как соединения нестойкие разлагаются с образованием низкомолекулярных летучих кислород-содержащих
соединений (спиртов, альдегидов и кетонов, кислот с углеродной цепочкой меньшей длины, чем в исходном жире, а также их разнообразных производных). В результате жир приобретает неприятный, «прогорклый» запах и вкус и становится непригодным для пищи.
Твердые, насыщенные жиры более устойчивы к прогорканию, хотя и в них могут образовываться гидропероксиды на базе α-углеродов в остатках кислот при сложноэфирной группировке жира. Для предотвращения окислительного прогоркания к жирам добавляют антиоксиданты.
При неправильном хранении жиры могут гидролизоваться с образованием свободных кислот и глицерина, что также изменяет их вкус и запах.
Хранить жиры необходимо в небольших темных склянках, доверху заполненных маслом, в сухом, прохладном, затемненном месте и в герметичной светонепроницаемой упаковке.
– «Высыхание» масел
Так называемые высыхающие масла состоят из глицеридов сильно ненасыщенных кислот (линолевой, линоленовой и др.) На свету под действием кислорода воздуха они окисляются и полимеризуются на поверхности в виде твёрдой эластичной плёнки. Процесс «высыхания» ускоряется катализаторами – сиккативами. Льняное масло, сваренное с оксидом или нафтенатами свинца (сиккатив) известно под названием
34
олифа. Она применяется для приготовления масляных красок, линолеума, клеёнки и т.д.
7 АМИНЫ
Aминами называют, продукты замещения атомов водорода в аммиаке на углеводородные радикалы.
7.1 Алифатические амины
В противоположность, например, спиртам, галогеналканам, первичными аминами называют продукты замещения одного атома водорода в аммиаке R–NH2. Причём первичность, вторичность или третичность углеводородного радикала в данном случае роли не играет. Замещение двух водородов аммиака на одинаковые или разные углеводородные радикалы дает вторичный, а трех – третичный амин. Изомерия аминов определяется положением аминогруппы в углеродной цепи и количеством и строением радикалов, связанных с азотом.
По радикально-функциональной номенклатуре амины обычно называют как производные аммиака, добавляя к названию радикалов слово «амин». При составлении названия по номенклатуре ИЮПАК
исходят из названия углеводорода с самой длинной цепью и вводят
названия замещающей |
|
|
группы в этой цепи в виде приставки: амино- |
|||||||||||||||||||||||||||||
(-NH2), |
|
|
|
|
|
|
|
метиламино- (-NHCH3), диметиламино- [-N(CH3)2] и т.д. |
||||||||||||||||||||||||
Цифрой указывают положение заместителя. |
||||||||||||||||||||||||||||||||
Вот названия некоторых изомерных аминов С4Н9NH2: |
||||||||||||||||||||||||||||||||
CH3 |
|
|
|
CH2 |
|
|
|
|
CH2 |
|
|
|
CH2 |
|
|
|
NH2 |
бутиламин, 1-аминобутан |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
CH3 |
|
|
|
CH2 |
|
|
|
|
|
|
CH |
|
|
|
|
|
|
CH3 |
|
|
|
|
втор-бутиламин, 2-аминобутан |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3 |
|
|
|
|
CH |
|
|
|
|
|
|
|
|
CH2 |
|
|
|
NH2 |
|
|
|
|
изобутиламин, 1-амино-2-метилпропан |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CH3 |
|
|
NH |
|
|
|
|
CH2 |
|
|
|
CH2 |
|
|
|
CH3 |
метилпропиламин, 1-метиламинопропан |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
CH3 |
|
|
CH2 |
|
NH |
|
|
CH2 |
|
|
CH3 |
диэтиламин, этиламиноэтан |
||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||
CH3 |
|
|
|
NH |
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
CH3 |
|
|
|
|
метилизопропиламин, |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-метиламинопропан |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH3 |
|
|
N |
|
|
CH2 |
|
|
CH3 |
|
|
|
|
диметилэтиламин, диметиламиноэтан |
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Способы получения
35

– Главный путь получения аминов – алкилирование аммиака или аминов галоидными алкилами – реакция Гофмана.
CH3I |
NH3 |
|
CH3 |
|
NH2 . HI |
NH3 |
CH3 |
|
NH2 + NH4I |
||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
соль метиламина |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
CH3 |
|
|
NH2 |
|
СH3I |
|
|
CH3 |
|
|
|
NH . HI |
NH3 |
|
|
CH3 |
|
|
NH + NH4I |
||||||||||
|
|
||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
CH3 |
||||
|
|
|
|
|
|
|
СH3I |
|
|
3 |
|
NH3 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
N . HI |
|
|
|
|
|
|
|
|
|
||||||||
CH3 |
|
|
NH |
|
|
|
CH |
|
|
|
|
NH4I + CH3 N |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|||||||||
|
3 |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
(CH3)3N СH3I  [(CH3)4N]+I-
[(CH3)4N]+I-
Таким образом, в зависимости от соотношения реагентов и условий реакции Гофмана получается смесь первичного, вторичного, третичного аминов и четвертичной соли аммония.
– Амиды кислот при расщеплении гипобромидом или гипохлоридом дают первичные амины
|
|
|
|
O |
KClO |
CH3 |
|
NH2 + KCl + CO2 |
CH |
|
|
C |
|
|
|||
3 |
|
|
|
|
||||
|
|
|
|
|||||
|
NH2 |
(Cl2+KOH) |
||||||
|
||||||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
– Восстановление нитросоединений, нитрилов и изонитрилов. Реакции протекают при действии водорода в присутствии
катализаторов Pt, Pd, Ni.
R NO2 + 3H2  R NH2 + 2H2O
R NH2 + 2H2O
RC N + 2H2
N + 2H2  R CH2 NH2
R CH2 NH2
RN C:+ 2H2
C:+ 2H2  R NH CH3
R NH CH3
Физические свойства
Простейшие амины – газы, хорошо растворимые в воде и обладающие сходным с аммиаком запахом, но с более сильным «рыбным» оттенком. По сравнению со спиртами амины менее диссоциированы. Поэтому температуры кипения их соответственно ниже. Среди изомеров ниже кипят третичные амины, выше – первичные.
36

Химические свойства
В химическом отношении амины сходны с аммиаком.
– Также как и аммиак они обнаруживают щелочную реакцию с
обычными индикаторами. Свойства аминов как оснований обусловлены способностью атома азота за счёт неподелённой пары электронов присоединять протон с образованием алкилзамещённого иона аммония
R |
|
..N |
|
|
|||
|
|
|
|
|
|
H |
|
H + H+ 
..R
..H
..N+
H..
+
H
С водой амины образуют алкилзамещённые гидроксиды аммония
R |
|
NH2 + HOH |
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|||
|
|
|
R |
|
NH |
OH− |
||||
|
|
|||||||||
|
||||||||||
|
|
|||||||||
|
|
|
||||||||
|
|
|
|
32 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
С минеральными кислотами они дают алкилзамещённые аммонийные соли
R |
|
NH2 + HCl |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
R |
|
NH |
− |
||||
|
|
|
|||||||||
|
|
|
|
||||||||
|
|
|
|
|
32 |
Cl |
|||||
|
|
|
|
|
|
хлористый алкиламмоний |
|||||
Реакции |
с кислотами |
свидетельствуют о том, что амины |
|||||||||
являются органическими основаниями. В большинстве случаев
алифатические амины более сильные основания, чем аммиак. Являясь донорами электронов, алкильные радикалы повышают электронную плотность на азоте, усиливая при этом его способность захватывать и удерживать протон, что и демонстрирует свойства аминов как оснований. Так, константы основности K (NH3). = 1,79·10-5,
K(CH3→NH2 ) = 4,38·10-4 и K (CH3→NH← CH3) = 5,2·10-4.
–Амины можно алкилировать (см. реакцию Гофмана).
–Амины подвергаются ацилированию, в том числе и
ацетилированию уксусным ангидридом или хлористым ацетилом:
|
|
|
|
O |
|
|
|
O |
|
||
C2H5 |
|
NH2 + CH3 |
|
C |
|
CH3 |
|
C |
+ HCl |
||
|
|
|
|
||||||||
|
|
|
|
Cl |
|
|
|
NH |
|
C2H5 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
этилацетиламин |
|
||||
|
|
|
|
|
|
этилацетамид |
|
||||
– Реакции с азотистой кислотой. Первичные, вторичные и третичные амины дают разные продукты.
37

При обработке первичных аминов азотистой кислотой выделяется свободный азот, и образуются спирты
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||||||||
CH3 |
|
|
N |
+ O |
|
|
|
N |
|
|
OH |
|
|
|
N2+ CH3OH + H2O |
||||||
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
||||||||||||||||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||||||||
Вторичные амины дают нитрозоамины |
|||||||||||||||||||||
(CH3)2N |
|
H + HO |
|
N |
|
O |
|
|
|
(CH3)2N |
|
N |
|
O + H2O |
|||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N-нитрозодиметиламин |
|||||||
Третичные амины устойчивы к действию азотистой кислоты и
образуют с ней соли.
– Соли четырёхзамещённого аммония. При нагревании третичных аминов с галоидными алкилами образуются соли четырёхзамещённого аммония
(CH3)3N + СH3I  [(CH3)4N]+I-
[(CH3)4N]+I-
При действии на четвертичные соли аммония гидроксида серебра образуются четвертичные аммонийные основания – такие же сильные основания как едкий натр или едкое кали.
[(CH3)4N]+I- + AgOH  [(CH3)4N]+OH−
[(CH3)4N]+OH−
Амины нашли применение как органические основания и растворители, в синтезах некоторых поверхностно активных веществ, добавок при флотационном разделении солей, при получении целого ряда других ценных продуктов.
Диамины
Две первичные аминогруппы лишь в редких случаях удерживаются у одного атома углерода. Простейший первичный диамин, этилендиамин или 1,2-диаминоэтан, получают аммонолизом 1,2-дихлорэтана
|
|
CH2Cl |
|
CH2Cl + 4NH3 |
|
CH2NH2 |
|
CH2NH2 + 2NH4Cl |
||||||||||
|
|
|
|
|||||||||||||||
Примеры названий: |
|
|
|
|
||||||||||||||
NH2 |
|
CH2 |
|
|
CH2 |
|
|
NH2 |
этилендиамин, 1,2-диаминоэтан; |
|||||||||
|
|
|
|
|
||||||||||||||
NH2 |
|
CH2 |
|
CH2 |
|
CH2 |
|
NH2 |
триметилендиами, 1,3-диаминопропан |
|||||||||
|
|
|
|
|||||||||||||||
38

NH2 |
|
CH2 |
|
|
|
CH |
|
NH2 |
пропилендиамин, 1,2-диаминопропан |
||||
|
|
|
|||||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
CH3 |
|
||||||
NH2 |
|
CH2 |
|
|
(CH2)4 |
|
CH2 |
|
NH2 |
гексаметилендиамин, |
|||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1,6-диаминогексан; |
Химические свойства диаминов повторяют свойства моноаминов; реагировать могут уже две аминогруппы.
В химической промышленности большое значение имеет гексаметилендиамин. Его получают из адипиновой кислоты.
|
|
|
|
|
|
|
|
C |
|
O |
|
|
|
|
|
|||
COOH |
|
|
|
|
|
|
|
ONH4 − 2H2O |
||||||||||
(CH2)4 |
+ 2 NH3 |
|
|
(CH2)4 |
||||||||||||||
|
|
|||||||||||||||||
|
|
ONH4 |
|
|
|
|||||||||||||
COOH |
|
|
|
|
|
|
C |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
O |
|
|
|
|
O |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
C |
NH2 − 2H O |
|
|
|
C |
|
|
N |
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
(CH2)4 |
|
(CH2)4 |
|
|
4H |
|
|
||||||||||
|
NH2 |
|
2 |
|
|
|
|
2 |
|
|||||||||
|
|
C |
|
|
|
|
|
|
C |
|
|
|
N |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
O |
|
|
|
динитрил |
|
|
||||||||||
|
|
|
|
|
|
|
|
адипиновой |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
кислоты |
|
|
||||||
CH2 NH2  (CH2)4
(CH2)4
CH2 NH2
Поликонденсацией адипиновой кислоты и гексаметилендиамина получают высокомолекулярный полиамид с довольно высокой температурой плавления. Из расплава этого полимера формуют синтетическое волокно найлон, весьма близкое по своим свойствам к натуральному шёлку.
nHO C (CH2)4 C OH + nNH2 (CH2)6 NH2 O O
nHO |
|
|
C (CH2)4 |
|
C |
|
NH (CH2)6 |
|
NH |
|
CH |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
O |
|
O |
|
|
|
|
|
|
|
|
n |
||||||
7.2 Ароматические амины
39
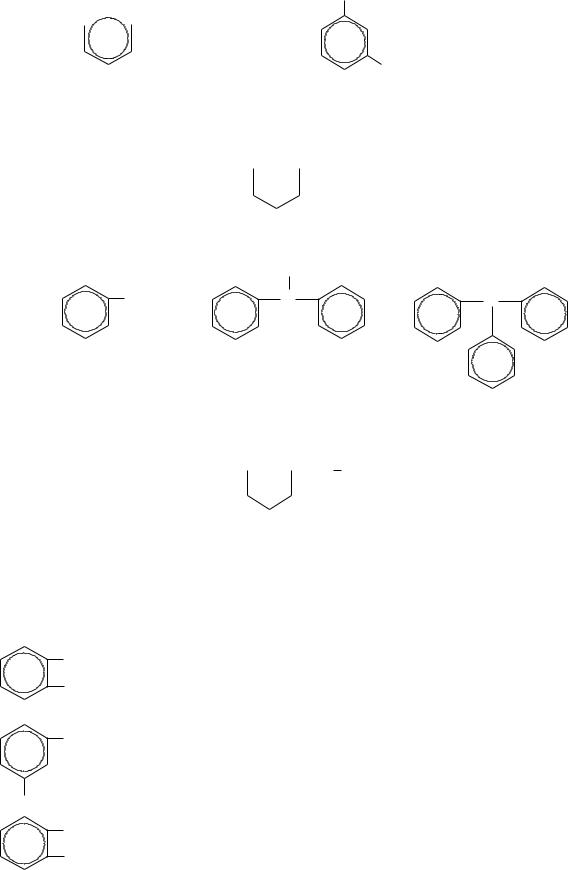
Ароматические амины, также как и амины жирного ряда, являются производными аммиака. Аминогруппа может быть соединена непосредственно с ароматическим ядром.
NH2

 NH2
NH2
анилин |
CH3 |
м - толуидин |
|
Амины с аминогруппой в боковой цепи, например бензиламин, похожи по своим свойствам на алифатические амины.

 СH2NH2
СH2NH2
Ароматические амины могут быть первичными, вторичными и третичными
|
H |
|
NH2 |
NH |
NH |
|
|
2 |
анилин |
дифениламин |
трифениламин |
N-Метиланилин относится к жирноароматическим аминам
 NH CH3
NH CH3
N-метиланилин
Названия аминов даются по тривиальной и ИЮПАК номенклатурам:
С6H5NH2 |
Анилин, аминобензол |
NH2 |
о-Толуидин или 1,2-толуидин, |
CH3 |
2-метиланилин |
|
|
NH2 |
м-Хлоранилин, 3-хлоранилин |
|
|
Cl |
о-Фенилендиамин, |
NH2 |
|
NH2 |
1,2-диаминобензол |
|
40
