
МЕТОДИЧЕСКОЕ ПОСОБИЕ- Орг. химия-Часть 1
.pdf
Формула Кекуле используется условно, в основном для написания уравнений реакций присоединения.
Физические свойства
Ароматические углеводороды бензольного ряда – это жидкие и твердые вещества, обладающие сильным запахом. Температура кипения бензола (C6H6), 80,1 °C, выше температуры кипения гексана (C6H14), 68,8 °C. Температуры кипения изомерных соединений различаются мало. Бензольные углеводороды практически не растворимы в воде.
Химические свойства
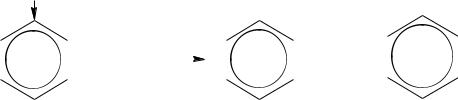
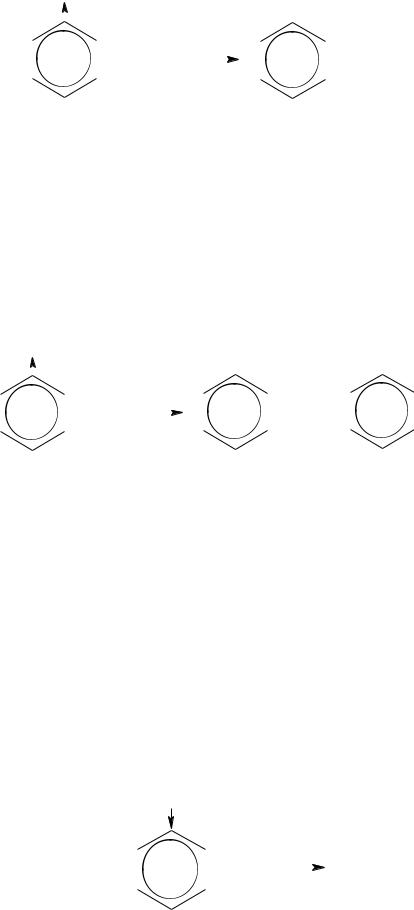
Для ароматических углеводородов характерны реакции присоединения и замещения. Причем наибольшая склонность к реакциям замещения.
Реакции присоединения, характеризующие бензол как ненасыщенное соединение:
–водород присоединяется к ароматическим углеводородам только
вприсутствии катализатора и при повышенной температуре.
CH
HC  CH
CH
HC  CH
CH
CH
|
H2C |
|
+ 3H2 |
H2C |
CH2 |
Pt |
H2C |
CH2 |
|
||
|
|
CH2 |
циклогексан
– под влиянием жесткого ультрафиолетового облучения бензол присоединяет хлор и бром с образованием гексагалогенциклогексана, который при нагревании переходит в тригалогенбензол.
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
Cl |
|||
|
|
|
|
|
Cl |
|
|
|
|
Cl |
|
|
|
|
|
||
|
|
HC |
|
|
|
CH |
|
|
|
|
C |
||||||
HC |
CH |
+ 3Cl2 |
h |
CH |
CH |
-3HCl |
HC |
|
CH |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
CH CH |
|
Cl |
CH |
CH CH Cl |
|
Cl C |
CH C Cl |
|||||||||
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|||||||||||
Cl
– подобно другим ненасыщенным углеводородам бензол озонируется с образованием сильного взрывчатого вещества – триозонида бензола.
81
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
O |
CH |
|
|
|
|
|
C |
|
|
|
|
|
|
|
O |
H |
H |
C |
O |
|||
|
CH |
O |
|
|
|
|
||||||
|
HC |
CH |
|
|
|
|
|
|||||
HC |
CH |
|
O |
|
|
C |
|
|
H |
|
||
3O3 |
|
O |
H2O |
|
+ |
|
|
|||||
|
|
|
|
O |
|
|
|
|
O |
|
||
HC |
CH |
HC |
|
CH |
|
|
C |
|
|
|
||
|
|
|
|
|
|
|
|
|||||
|
CH |
O |
|
|
|
|
|
|
|
|
||
|
O |
CH |
|
|
O |
H O |
|
C H |
||||
|
|
|
|
|
|
C |
||||||
|
|
O |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
Под действием воды триозонид даѐт три молекулы глиоксаля. Эта реакция используется для установления строения соединений бензольного ряда.
Все эти превращения характеризуют бензол как ненасыщенное соединение.
Реакции замещения в ароматическом ядре
Правила замещения в бензольном цикле
Если в бензоле электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и место вступления нового заместителя. Поскольку атакующая ядро группа прежде всего взаимодействует с отрицательно заряженной электронной системой сопряжения бензольного ядра, реакции замещения в ароматическом цикле должны протекать по ионному механизму с участие заряженных атакующих частиц.
Реакционная способность того или иного атома углерода в кольце определяется следующими факторами:
–положением и природой уже имеющихся заместителей;
–природой новой замещающей (атакующей) группы;
–условиями проведения реакции.
Первые два фактора наиболее значимы.
Заместители в бензольном кольце делятся на две группы
Заместители CH3, CH2R, CHR2, CR3, OH, OR, NH2, NHR, NR2, F, Cl, Br, I и другие называются заместителями первого рода. Они способны отдавать электроны – это электронодонорные заместители.
Заместители второго рода способны оттягивать на себя,
принимать электроны. Это – электроноакцепторные заместители. К
ним относятся SO3H, NO2, COOH, COOR, CHO, COR, CN, NH3+ и
другие.
82
В свою очередь, атакующие (замещающие) группы могут быть электрофильными или нуклеофильными. Электрофильные реагенты в реакции служат акцепторами электронов. В частном случае – это катионы. Нуклеофильные реагенты в реакции являются донорами электронов. В частном случае – это анионы.
Если реагент действует на ядро с одним заместителем, то можно выделить несколько вариантов их взаимодействия:
– заместитель первого рода; реагент электрофильный.
В качестве примера рассмотрим реакцию нитрования толуола нитрующей смесью (смесь азотной и серной кислот).
|
|
CH3 |
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
HNO (NO |
+) |
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
+ |
|
|
|
+ H2O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
орто-нитро- |
|
пара-нитро- |
|||||||
|
|
|
|
|
|
|
толуол |
|
|
толуол |
|||||
Метильная группа в толуоле является ориентантом первого рода. Это электронодонорная частица. Поэтому ядро в целом из-за смещения электронной плотности от метильной группы получает дробный отрицательный заряд. Ближайшие к заместителю атомы углерода цикла заряжаются также отрицательно. Последующие
углероды цикла приобретают чередующиеся заряды
(альтернирующий эффект). Реакция между азотной и серной кислотами нитрующей смеси дает несколько частиц, среди которых присутствует электрофильная частица NO2+ (на схеме показана над стрелкой в скобках), которая атакует отрицательно заряженные атомы цикла. Происходит замещение водородных атомов на нитрогруппу в орто- и пара-положениях относительно метильной группы. Поскольку ядро
имеет отрицательный заряд, а атакующая частица электрофильна
(заряжена положительно), реакция облегчается и может протекать в более мягких условиях по сравнению с нитрованием бензола.
– Заместитель второго рода; реагент электрофильный.
83
|
|
|
SO3H |
|
|
SO3H |
||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
H2SO4 (SO3H+) |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
||
|
|
|
|
|
||||||
|
|
|
|
|
|
SO3H |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
бензол- |
|
мета-бензол- |
|||||||
сульфокислота |
дисульфокислота |
|||||||||
Сульфогруппа (ориентант второго рода, электроноакцепторный) благодаря смещению электронной плотности к себе заряжает ядро в целом и ближайшие углероды ядра положительно. Атакующая частица электрофильна. Ориентация в мета-положение. Заместитель затрудняет действие реагента. Сульфирование следует проводить концентрированной серной кислотой при повышенной температуре.
– Заместитель второго рода; реагент нуклеофильный.
|
|
|
NO2 |
|
|
|
NO |
2 |
|
|
|
|
NO |
2 |
|
|||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
OK |
|
|
|
|
|
|
||||
|
|
|
|
KOH (OK ) |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
+ H2 |
||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OK |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
орто-нитро- |
|
пара-нитро- |
|||||||||
|
|
|
|
|
|
фенолят калия |
фенолят калия |
|||||||||||
В соответствии с зарядами нуклеофильная частица OK– атакует орто- и пара-положения и заместитель облегчает действие реагента. Тем не менее, реакции нуклеофильного замещения приходится проводить в довольно жестких условиях. Это объясняется энергетической невыгодностью переходного состояния в реакции и тем, что π- электронное облако молекулы отталкивает атакующую нуклеофильную частицу.
– Заместитель первого рода; реагент нуклеофильный.
Заместитель затрудняет действие реагента. Ориентация в мета- положение. Такие реакции практически не реализуются.
X
|
|
|
|
|
|
|
|
|
|
|
YH (Y ) |
|
|
||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
84 |
|
|
Если в ядре имеется несколько различных заместителей, то преимущественное направляющее действие оказывает тот из них, который обладает наибольшим ориентирующим действием. Например, в реакциях электрофильного замещения по силе ориентационного
действия заместители можно расположить в следующий ряд:
OH > NH2 > ОR > Cl > I > Br > CH3; Ориентирующая способность ориентантов второго рода убывает в следующей последовательности: NO2 > COOH > SO3H. В качестве примера приведена реакция хлорирования орто-крезола (1-гидрокси-2-метилбензола):
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
OH |
|
+ |
|
|
|
OH |
|
|
|
OH |
||
|
|
|
|
|
|
|
|
Cl2 (Cl ) |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
FeCl |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Cl |
Cl |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Оба заместителя – ориентанты первого рода, электроно-донорные. Судя по зарядам на атомах углерода (в скобках – от группы –ОН),
ориентация не совпадает. Поскольку фенольный гидроксил является более сильным ориентантом, в основном получаются продукты, соответствующие ориентации этой группы. Оба заместителя облегчают протекание реакции. Реакция электрофильная благодаря взаимодействию катализатора с молекулярным хлором.
FeCl |
+ Cl |
[FeCl ] Cl |
3 |
2 |
4 |
На практике правила замещения чаще всего выполняются не строго. При замещении получаются все возможные продукты. Но продуктов, которые должны получаться по правилам, всегда больше. Например, при нитровании толуола образуется 62 % орто-, 33,5 % пара- и 4,5 % мета-нитротолуолов.
Изменение внешней среды (температура, давление, катализатор, растворитель и т. д.) обычно слабо влияет на ориентацию.
Ряд реакций замещения показан при объяснении правил ориентации. Рассмотрим еще несколько реакций.
– При действии на бензол хлора или брома в присутствии
катализаторов – переносчиков галоидов, например, FeCl3, AlCl3, SnCl4 и других происходит последовательное замещение атомов водорода при циклических углеродах на галоген.
85

|
FeCl3 |
|
|
Cl |
|
|
+ Cl2 |
|
|
+ HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
+ |
Cl |
Cl |
|
FeCl3 |
(Cl ) |
|||
|
+ Cl2 |
+ |
+ HCl |
||
|
|
|
|||
|
|
|
|
Cl |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
В последней электрофильной реакции хлор как ориентант
первого рода направляет второй атом хлора в орто- и пара-
положения (преимущественно – в пара-). Однако в отличие от других ориентантов первого рода он затрудняет реакцию из-за своих сильно выраженных электороноакцепторных свойств, заряжая ядро положительно. В момент атаки электрофильной частицы галоген исходного соединения возвращает часть электронной плотности ядру, создавая заряды на его углеродах, соответствующие действию ориентанта первого рода (динамический эффект ориентации).
– Галогенирование алкилзамещенных бензола на свету
протекает по радикальному механизму, и замещение происходит у
α-углеродного атома боковой цепи:
|
|
|
|
H2C CH3 Cl2 |
CH CH3 |
+ HCl |
|
h |
Cl |
|
|
|
|
||
– При нитровании по Коновалову (разбавленный водный раствор азотной кислоты, ~140 °C), протекающему по радикальному механизму, также приводит к замещению в боковой цепи:
|
NO2 |
|
HC CH3 HNO |
C CH3 |
|
3 |
+ H2O |
|
CH3 |
||
CH3 |
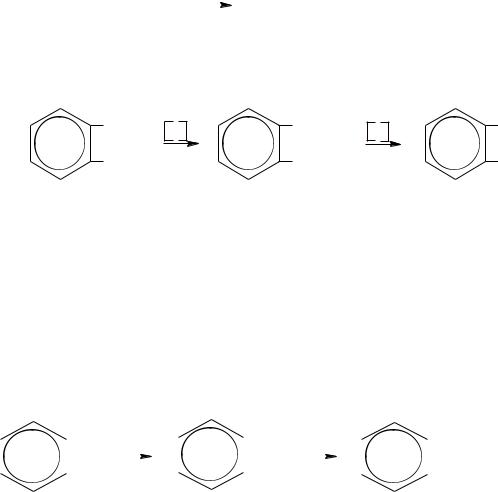
– Окисление бензола и его гомологов
Бензольное кольцо окисляется очень трудно. Однако в присутствии катализатора V2O5 при температуре 400 °C…500 °C бензол образует малеиновую кислоту:
86
|
V2O5 |
H |
|
C |
|
COOH |
||||
|
|
|
||||||||
2C6H6 + 9O2 |
2 |
|
|
|
|
|
|
+ 4CO2 + 2H2O |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|||||||
|
|
|
H |
|
C |
|
COOH |
|||
|
|
|
|
|
||||||
Гомологи бензола при окислении дают ароматические кислоты.
Причѐм боковая цепь даѐт карбоксильную группу при ароматическом кольце, независимо от своей длины.
CH3 O |
COOH O |
COOH |
C2H5 |
C2H5 |
COOH |
|
орто-этилбензойная |
фталевая |
|
кислота |
кислота |
Подбором окислителей можно добиться последовательного окисления боковых цепей.
В присутствии катализаторов из алкилбензолов образуются гидроперекиси, разложением которых получают фенол и соответствующие кетоны.
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
O |
|
OH |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
H3C |
|
|
|
|
|
CH3 |
|
|
|
|
|||||||||||||||||
H C |
|
C |
|
CH |
|
C |
|
|
|
OH |
|||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
3 |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
кислая |
|
|
|
+ H3C |
|
C |
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
катал. |
|
|
|
|
|
|
|
|
|
|
среда |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O
Отдельные представители
Бензол – жидкость, tплав.= 5,4 °С, tкип= 80,1 °С, с водой образует азеотропную смесь, поэтому при перегонке легко обезвоживается. В
промышленности имеет чрезвычайно широкое применение: как растворитель, для получения производных бензола и других соединений (хлорпроизводных, анилина, фенола, красителей, взрывчатых веществ, лечебных препаратов, капрона, нейлона, ацетона, полистирола и т.д.).
Толуол – жидкость, tплав.= –93 °С, tкип= 110,6 °С. Главное применение – производство взрывчатых веществ (тротил: тринитро-
толуол), бензойного альдегида, хлористого бензила, которые служат сырьем для анилинокрасочной, парфюмерной, пищевой и других отраслей промышленности. Используется как растворитель.
Ксилолы. Смесь ксилолов используется как растворитель и для повышения октанового числа моторных топлив (ОЧ ≥ 120). Большое количество пара-ксилола идет на производство синтетического волокона лавсан. Получают ксилолы, главным образом, риформингом узких нефтяных фракций с пределами выкипания близкими к температуре кипения ксилолов.
87
Этилбензол. Получают алкилированием бензола этиленом в присутствии AlCl3. Используется в основном для получения стирола (винилбензола).
Стирол. Ароматические углеводороды с двойными связями в боковой цепи в настоящее время используются очень широко. Стирол является простейшим представителем этого вида углеводородов. Это – жидкость с tкип = 146°С. Важнейший способ получения состоит в следующем:
|
|
AlCl3 |
CH2 |
CH3 |
ZnO |
CH |
CH |
+ H2C CH2 |
|
|
|
2 |
|||
|
|
|
|
|
|
||
O |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
CO |
CH3 |
H |
CH |
CH3 |
- H2O |
CH |
CH |
|
|
|
|
|
2 |
||
ацетофенон |
|
|
метилфенилкарбинол |
|
|
|
|
Под действием катализаторов стирол полимеризуется в твѐрдую полупрозрачную массу – полистирол.
n H2C CH |
H2C CH CH2 |
CH |
n |
|
C6H5 |
C6H5 |
C6H5 |
||
2 |
||||
|
|
|
(n ≤ 5000)
Полистирол имеет высокое электросопротивление и влагостойкость. Полимеризацией стирола и дивинила получают синтетический каучук, пригодный для изготовления шинной резины.
Многоядерные ароматические углеводороды
Ароматические соединения с несколькими кольцами можно разделить на 2 группы: соединения с неконденсированными ядрами и
соединения с конденсированными ядрами.
К первой группе относятся дифенил и трифенилметан.
Дифенил образуется при пиролизе бензола, содержится в каменноугольной смоле.
2C6H6 C6H5–C6H5 + H2
В лаборатории чаще всего получается синтезом по Вюрцу-Фиттигу.
2C6H5Br + 2Na C6H5–C6Н5 + 2NaBr
88
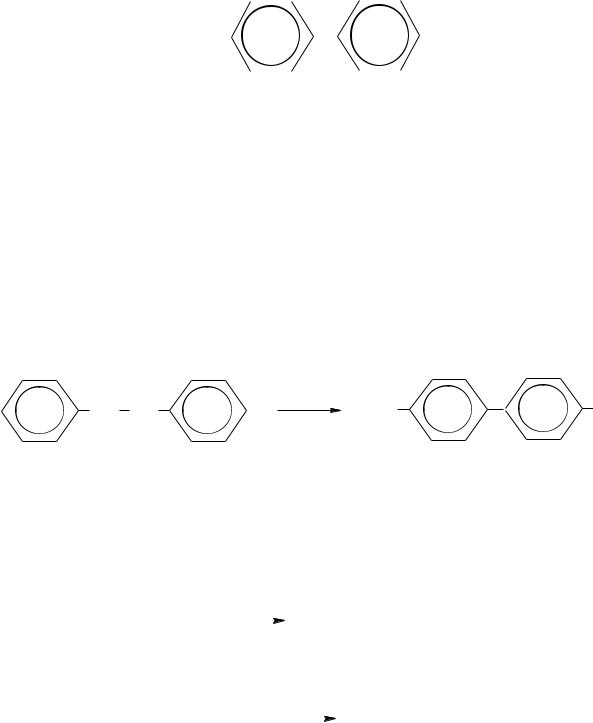
Дифенил – кристаллическое вещество с tплав.= 70 °С, tкип = 254 °С. Дифенил – типичное ароматическое соединение и в отношении химических свойств ведѐт себя как бензол. В реакциях замещения
бензольные кольца осуществляют взаимную ориентацию в пара-
положение. Места заместителей обозначаются цифрами или приставками.
3' |
2' |
2 |
3 |
||||
(n' ) 4' |
|
|
1' 1H H |
|
|
|
4 (n) |
|
|
|
|
|
|
|
|
5' |
6' |
6 |
5 |
||||
(м' ) |
(o') |
(o) |
(м) |
||||
Вокруг простой связи, соединяющей кольца в дифениле, возможно внутреннее вращение с небольшой затратой энергии. Однако при введении заместителей в орто- и орто'-положения из-за пространственных затруднений вращение может прекратиться. При этом возникает два пространственных изомера, которые из-за их устойчивости можно выделить.
Наиболее важным производным дифенила является бензидин (п, n'-диаминодифенил). Его получают в технике бензидиновой перегруппировкой, открытой Зининым. Реакция заключается в изомеризации гидразобензола, получаемого восстановлением нитробензола.
NH NH |
кислота |
H2N |
NH2 |
нагрев. |
Бензидин в больших количествах используется в анилинокрасочной промышленности.
Трифенилметан и его производные могут быть получены, например, алкилированием бензола и его производных и другими методами.
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||
CHCl3 + 3C6H6 |
|
|
3HCl + H5C6 |
|
|
|
|
|
|
|
||||||
|
|
|
|
C |
|
C6H5 |
||||||||||
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
C6H5 |
||||
|
|
|
|
|
|
|
|
H |
||||||||
|
|
CHCl2 + 2C6H6 |
|
|
|
|
|
|
|
|
C6H5 + 2HCl |
|||||
H5C6 |
|
|
|
H5C6 |
|
C |
|
|
||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
C6H5 |
||||||||
Трифенилметан и его производные обладают чрезвычайно подвижным водородным атомом или группами у центрального углерода.
89

Объясняется это большой устойчивостью трифенилметильных радикалов или ионов благодаря стабилизирующему действию бензольных циклов.
Трифенилметан легко окисляется до трифенилкарбинола. Последний при действии HCl легко образует трифенилхлорметан. В свою очередь, это соединение восстанавливается до трифенилметана и гидролизуется до трифенилкарбинола.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
HCl |
||||
(H5C6)3C H |
|
|
|
|
|
|
|
(H5C6)3C OH |
|
|
(H5C6)3C Cl |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
|
|
|
H |
|
|
|
|
HOH |
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Водородный атом трифенилметана легко замещается также на металлы и галогены.
(H5C6)3C H + NaNH2  (H5C6)3C Na + NH3
(H5C6)3C Na + NH3
Многие производные трифенилметана с аминоили гидроксигруппами в бензольных ядрах являются красителями.
Первым промышленным красителем трифенилметанового ряда был фуксин. Его можно получить при окислении смеси толуидинов и анилина.
Фенол и фталевый ангидрид при нагревании с серной кислотой образуют фенолфталеин. Он используется в химии как индикатор и в медицине как слабительное (пурген).
К трифенилметановым относятся такие красители, как метиловый фиолетовый (чернила), кристаллический фиолетовый, анилиновый синий, аурин, эозин, малахитовый зеленый и целый ряд других.
Простейшим соединением, принадлежащим к группе многоядер-
ных ароматических углеводородов с конденсированными ядрами, является нафталин.
Нафталин содержится в каменноугольной смоле ( 5 %), которая является почти единственным его источником.
8 |
|
1 |
|
|
|
9 |
2 |
|
|
7 |
|
|||
6 |
|
3 |
|
|
|
10 |
|
|
|
5 |
|
4 |
|
|
|
|
|
В соответствии с его структурной формулой может существовать два однозамещѐнных нафталина и десять дизамещѐнных.
90
