
МЕТОДИЧЕСКОЕ ПОСОБИЕ- Орг. химия-Часть 1
.pdf
Одноатомные фенолы
Источники и методы получения
Важным источником фенола и крезолов является каменноугольная смола. Причѐм выход фенолов тем выше, чем ниже температура коксования. Дополнительное количество фенола получают из бензола несколькими методами.
– Щелочное плавление солей бензолсульфокислот. Это старый метод и в промышленности используется всѐ реже.
C6H5SO3Na + 2NaOH |
320 oC |
C6H5ONa |
+ Na2SO3 |
+ H2O |
||
|
|
|||||
2C6H5ONa + H2SO4 |
|
|
|
2C6H5OH + Na2SO4 |
|
|
|
|
|
|
|||
Выход фенола 60 %…70 %.
– Некоторое количество фенола получают гидролизом хлорбензола, перегретым до температуры 450 °C…500 °C паром.
Катализатор – силикагель, промотированный ионами Cu+2.
C6H5Cl + H2O |
силикагель |
C6H5OH + HCl |
|
||
+2 |
||
|
Cu |
|
– Кумольный метод (разложение гидроперекиси изопропилбензола (кумола)).
Процесс состоит в следующем:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
H3C |
|
|
|
|
CH3 H3C |
|
|
|
|
|
CH3 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
CH |
|
|
C |
|
|
|
OH |
||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||
H3C |
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H3C |
|
C |
|
CH3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
H+(AlCl3) |
|
|
|
|
|
|
катал. |
|
|
|
|
|
|
|
|
слабо |
|
|
|||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислая |
|
|
|
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
среда |
|
|
|
|
|
|
|
|
|
|
– Замещение диазогруппы. Этот метод неэкономичен для получения фенола, но с успехом используется для синтеза индивидуальных о-, м- и п-крезолов.
N+ N |
OH |
+ H2O |
+ N2 + H+ |
CH3 |
CH3 |
– Гомологи фенола получают его алкилированием.
OH |
OH |
C2H5OH
ZnCl2
H5C2
111
Физические свойства
Фенолы – обычно кристаллические вещества, плохо растворимые в воде. Имеют характерный запах. Являются антисептиками, ядовиты, вызывают ожоги при попадании на кожу.
Фенол: |
tплав. |
= 41 °C; |
tкип = 182 °C; |
d420 = 1,072; |
Крезолы: |
о- |
30 °C; |
191,5 °C; |
1,0465; |
|
м- |
11 °C; |
202,8 °C; |
1,034; |
|
п- |
36 °C; |
202,5 °C; |
1,035. |
Химические свойства
Фенолы обладают весьма реакционноспособной гидроксильной группой и ароматическим ядром.
– Фенолы – слабые кислоты. Кислотность их выше, чем у спиртов и воды, но как кислоты они слабее угольной кислоты и карбоновых кислот. Так, константы диссоциации уксусной кислоты 1,8∙10-5, угольной кислоты 4,9∙10-7, фенола 1,3∙10-10 и воды 1,8∙10-16. Кислотные свойства фенольного гидроксила вызваны мезомерным взаимодействием с ароматическим ядром. Валентные электроны атома кислорода вступают в систему сопряжения бензольного кольца, а водородный атом гидроксила протонизируется и становится активным.
H
O
Кислотность фенола можно проиллюстрировать, например, следующими фактами. Фенолы хорошо растворяются в щелочах с образованием фенолятов (одноатомные насыщенные спирты со щелочами не реагируют).
C6H5OH + NaOH  [C6H5O] Na+ + H2O
[C6H5O] Na+ + H2O
Однако они не вытесняют CO2 из карбоната натрия (Na2CO3). Более того, фенолы выделяют из растворов фенолятов обработкой CO2.
[C6H5O] Na+ + CO2 + H2O  C6H5OH + NaHCO3
C6H5OH + NaHCO3
Две эти реакции используются для выделения фенолов из смесей их со спиртами или карбоновыми кислотами.
Кислотность фенольного гидроксила может быть значительно повышена при введении в ядро сильных электроноакцепторных групп (под формулами указаны величины констант диссоциации):
112
OH |
OH |
OH |
OH |
||
|
NO2 |
NO2 |
O2N |
NO2 |
|
|
|
NO2 |
NO2 |
||
1,3 10-10 |
6,8 10-8 |
8,3 10-5 |
4,2 |
10-1 |
|
фенол |
2-нитрофенол |
2,4-динитрофенол |
2,4,6-тринитрофенол |
||
(пикриновая кислота) |
|||||
|
|
|
|||
– Образование простых эфиров фенолов алкилированием
фенолятов.
C6H5ONa + C2H5I  NaI + H5C6 O C2H5
NaI + H5C6 O C2H5
фенетол (этилфениловый эфир)
– Сложные эфиры при действии на фенолы карбоновых кислот не образуются. Они получаются в реакции фенолятов с ангидридами или галоидангидридами кислот.
|
|
|
|
|
|
O |
|
|
|
O |
|
|
|
||
C6H5ONa + H3C |
|
|
|
C |
|
H3C |
|
C |
|
|
|
||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
Cl |
|
|
|
O |
|
C6H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
фениловый эфир |
|
|
|
||||
|
|
|
|
|
|
|
|
уксусной кислоты |
|
|
|
||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
C |
|
|
|
O |
|
|
O |
|||
|
|
|
|
|
|
||||||||||
C6H5ONa + |
|
|
O |
|
H3C |
|
C |
+ H3C |
|
C |
|||||
|
|
|
|
|
|||||||||||
H3C |
|
|
|
C |
|
|
|
O |
|
C6H5 |
|
|
ONa |
||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
–Обычные реакции замещения гидроксила на галоген из-за кислотности фенольного гидроксила даже при действии PCl5 не идут.
–При перегонке с цинковой пылью фенолы восстанавли-
ваются до углеводородов.
C6H5OH + Zn 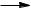 C6H6 + ZnO
C6H6 + ZnO
– Гидроксил – один из сильнейших, а в щелочной среде сильнейший орто-пара-ориентант. Поэтому фенолы легко вступают в реакции электрофильного замещения в ядре. Нужно ещѐ учесть, что гидроксил повышает электронную плотность в ядре и облегчает электрофильную атаку.
113
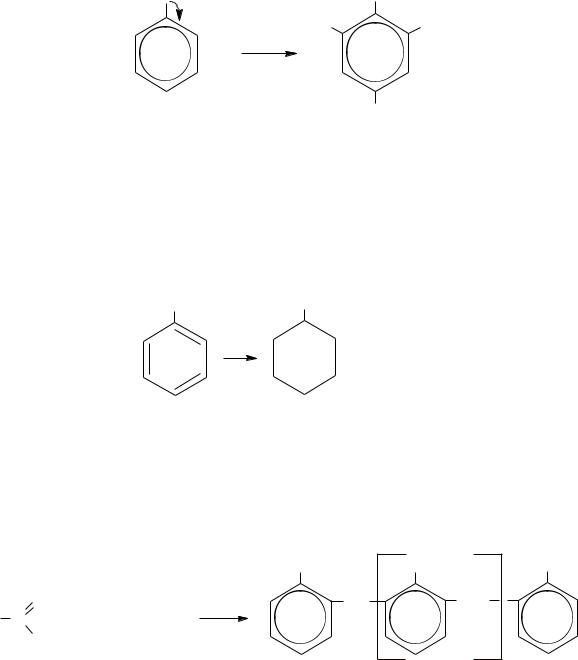
Галоидирование фенолов действием растворов галогенидов или галогенирующих средств (например, SOCl2, PCl5) идѐт с большой скоростью до образования тригалогенфенолов.
|
OH |
|
|
|
|
OH |
|
|
|
|
|
Cl |
Cl |
|
|
|
Cl2 |
+ |
) |
|
|
|
(Cl |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
Нитрование фенолов. Мононитрофенолы получают нитрова-нием фенолов на холоду ~30 %-ной азотной кислотой. В согласии с правилами ориентации получается смесь о- и п-нитрофенолов. При дальнейшем нитровании концентрированной азотной кислотой получается 2,4,6-тринитрофенол (пикриновая кислота).
– Гидрирование водородом в присутствии катализаторов (Pt,
Pd, Ni) даѐт циклогексановые спирты.
CH3 |
CH3 |
H2
|
|
|
|
OH |
OH |
||
п-крезол |
1,4-метилциклогексанол |
||
– Реакция конденсации
При нагревании фенола с муравьиным альдегидом в присутствии серной кислоты образуется растворимый в спиртах, ацетоне и т.д. полимер линейного строения, так называемый «новолак».
|
|
OH |
OH |
OH |
O |
кислая |
CH2 |
|
CH2 |
nH C + (n+1)C6H5OH |
|
|||
среда |
|
|
|
|
H |
|
|
|
n 1 |
|
|
|
|
В щелочной среде получаются фенолоспирты, а из них – легкоплавкий низкомолекулярный полимер «резол», хорошо растворимый в органических растворителях.
114
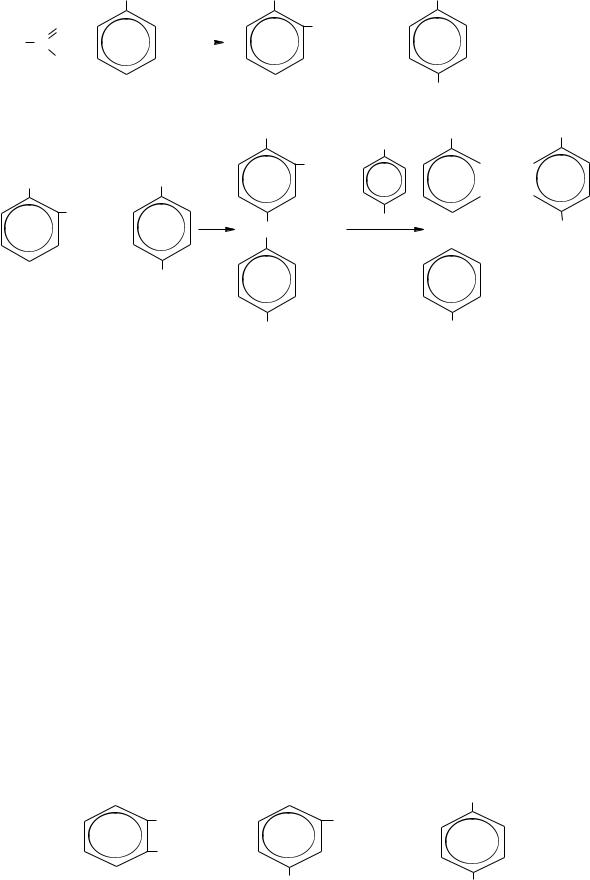
|
OH |
|
OH |
|
|
O |
щелочная |
|
CH2OH |
H C |
+ |
|
||
среда |
|
и |
||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
фенолоспирты |
|
|
|
OH |
|
|
|
|
|
OH |
OH |
|
OH |
|
CH2OH |
|
|
+ |
||
|
CH2OH |
|
|
CH2OH |
|
+ |
H2O |
CH2 |
H2O |
|
|
|
CH2OH
OH
OH
CH2OH
OH |
OH |
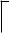 CH2
CH2 
|
|
CH2OH |
|
CH2 |
|
|
|
|
и т. д.
OH резол
При дальнейшей конденсации резола (нагрев) образуется трѐхмерный, сетчатый (пространственный) нерастворимый полимер – резит, бакелит (с наполнителем). Резит – неплавкий, нерастворимый, химически устойчивый полимер, который можно нагревать до температуры ~ 300 °C. Фенол-формальдегидные полимеры имеют очень широкое применение в народном хозяйстве.
Фенол – кристаллическое вещество с tплав. = 43 °C и tкип = 181 °C. Плохо растворим в воде и даѐт с ней гидрат, называемый карболовой кислотой. Фенол вызывает ожоги кожи. Антисептик. Фенол широко используется промышленностью для получения фенолформ-альдегидных пластических масс, лекарственных препаратов (например, салициловая кислота и еѐ производные), красителей, взрывчатых веществ (пикриновая кислота – меленит).
Метиловый эфир фенола – анизол – используется для получения пахучих веществ и красителей.
Крезолы. Крезолы применяются в производствах пластических масс, красителей, дезинфицирующих средств.
Двухатомные фенолы
|
|
OH |
OH |
OH |
|
OH |
|
|
|
OH |
OH |
|
|
|
о-диоксибензол, |
м-диоксибензол, п-диоксибензол, |
|
пирокатехин |
резорцин |
гидрохинон |
115
Химические свойства одно- и двухатомных фенолов сходны. Однако в реакциях диоксибензолов имеются некоторые особенности. Двухатомные фенолы проявляют более сильные кислотные свойства, реакции замещения водорода бензольного ядра протекают ещѐ легче, двухатомные фенолы очень легко окисляются с образованием соответствующих хинонов и поэтому являются сильными восстановителями.
OH |
|
O |
OH |
O |
OH |
O |
|
O |
O |
|
|
; |
||
|
|
|
|
|
|
|
|
OH |
O |
Пирокатехин (1,2-дигидроксибензол с хлорным железом даѐт зеленое окрашивание). Встречается во многих растениях, в основном в виде его метилового эфира – гваякола, который находит фармацевтическое и пищевое применение.
OCH3 |
OCH3 |
OH |
OH |
O |
C |
H |
|
гваякол |
ванилин |
Резорцин (1,3-дигидроксибензол), tплав = 118 °C, tкип = 276 °C. С
хлорным железом даѐт фиолетовую окраску. Применяется для получения красителей и как дезинфицирующее средство.
Гидрохинон (1,4-дигидроксибензол), tплав = 170 °C, tкип = 286 °C.
Гидрохинон очень легко окисляется до хинона. Гидрохинон используется в фотографии как проявитель. Из его производных получают термостойкие поликонденсационные смолы.
2.2.2 Ароматические спирты
Ароматические спирты и их производные широко распространены
врастительном мире, они имеют приятный запах и поэтому применяются
впарфюмерной промышленности.
По способам получения и химическим свойствам они походят на алифатические спирты.
Бензиловый спирт – жидкость, tкип = 206 °C. В природе встречается в эфирных маслах и бальзамах. Применяется в виде эфиров уксусной, бензойной, коричной и других кислот в парфюмерии.
116

β-Фенилэтиловый спирт,

 CH2 CH2OH
CH2 CH2OH
Содержится в розовом и неролиновом маслах. Используется в парфюмерии как стабилизатор запахов под названием «искусственное розовое масло».
3 ПРОСТЫЕ ЭФИРЫ
Простые эфиры можно представить как производные спиртов, в которых гидроксильный водород замещѐн на углеводородный радикал. Общая формула простых эфиров R–O–R`. Причѐм радикалы могут быть одинаковыми и разными. Они могут быть с открытой цепочкой атомов и циклическими, когда эфирный кислород входит в состав цикла.
3.1 Алифатические простые эфиры
По общей формуле CnH2n+2O насыщенные простые эфиры являются изомерами спиртов.
Изомерия и номенклатура простых эфиров определяется характером радикалов:
H3C |
|
|
|
|
|
O |
|
|
|
|
|
CH3 |
диметиловый, метиловый, метоксиметан |
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
H3C |
|
|
|
|
O |
|
|
|
|
C2H5 |
метилэтиловый, метоксиэтан |
|||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||
H5C2 |
|
|
|
O |
|
|
|
C2H5 |
диэтиловый, этиловый, этоксиэтан |
|||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||
H3C |
|
|
|
O |
|
|
CH2 |
|
|
CH2 |
|
CH3 |
метилпропиловый, 1-метоксипропан |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
H3C |
|
O |
|
|
CH |
|
CH3 |
метилизопропиловый, 2-метоксипропан |
||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
||||||||
Способы получения
Обычными способами получения простых эфиров являются следующие:
– Дегидратация спиртов в присутствии кислот.
2C2H5OH  H5C2 O C2H5 + H2O
H5C2 O C2H5 + H2O
117

В присутствии серной кислоты реакция протекает через образование алкилсерной кислоты.
|
|
C2H5O |
C2H5OH + HOSO3H |
|
SO2 + H2O |
|
||
|
|
HO |
|
|
этилсерная |
|
|
кислота |
C2H5O
HO SO2 + C2H5OH  H5C2 O C2H5 + H2SO4
H5C2 O C2H5 + H2SO4
– Реакция Вильямсона – взаимодействие галоидных алкилов с
алкоголятами.
C2H5Cl + C2H5ONa  H5C2 O C2H5 + NaCl
H5C2 O C2H5 + NaCl
Физические свойства
Метиловый и метилэтиловый эфиры при обычных условиях – газы.
Остальные эфиры – жидкости. Температуры кипения простых эфиров значительно ниже, чем у изомерных им спиртов. Так, диметиловый эфир кипит при температуре –23,7 °C, а этиловый спирт – при температуре 78,4 °C, диэтиловый эфир кипит при температуре 35,6 °C, а бутиловый спирт – при температуре 117,5 °C.
Это обстоятельство объясняется отсутствием в эфирах гидроксильного водорода, способного к образованию водородной связи.
Эфиры плохо растворимы в воде, плотности их ниже единицы.
Химические свойства
Простые эфиры – устойчивые малоактивные соединения. Они не реагируют на холоду с разбавленными минеральными кислотами, щелочами, металлическим натрием, пятихлористым фосфором.
– С галогеноводородными кислотами простые эфиры образуют комплексы. При этом протон кислоты присоединяется к кислороду эфира за счѐт его неподелѐнной пары электронов.
H5C2 |
|
|
+ |
|
|
H5C2 |
|
|
|
|
|
|
O + H |
Cl |
O H Cl |
H5C2 |
|
|
H5C2 |
По аналогии с солями аммония эти соединения называют солями оксония.
– Иодистоводородная кислота разлагает эфиры уже на холоде
H5C2 |
|
O |
|
C2H5 + HI |
|
|
C2H5OH + C2H5I |
|
|
118 |
|||||
|
|
|
|
|
|
||

– Металлический натрий также расщепляет эфиры при нагревании
H5C2 O C2H5 + 2Na  H5C2 ONa + C2H5Na
H5C2 ONa + C2H5Na
Диэтиловый эфир
Из всех простых эфиров наибольшее значение имеет диэтиловый эфир. Получают его дегидратацией этанола.
tкип.= 35,6 °С, d420 =0,7135 г∙см-3, растворимость в воде – 6,5 г на 100 г воды при температуре 20 °С, в 100 г эфира растворяется 1,25 г
воды.
Этиловый эфир широко применяется в лабораториях как растворитель, для экстракции из водных растворов, как среда, например, в синтезе магнийорганических соединений. В технике он используется меньше вследствие своей крайней огнеопасности. В медицине эфир употребляется для общего наркоза и местного охлаждения.
При хранении эфира происходит его окисление с образованием взрывчатых перекисных соединений.
H
H5C2 |
|
O |
|
C2H5 + O2 |
|
H3C |
|
C |
|
O |
|
C2H5 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||
O OH
Проба на наличие перекисей проводится встряхиванием эфира с подкисленным раствором KI. Побурение раствора указывает на присутствие перекисных соединений. Удаление перекисей производится добавлением к эфиру водного раствора сульфата железа.
3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
Органические окиси можно рассматривать как продукты внутримолекулярной дегидратации гликолей. Различают α, β, γ и т.д. окиси.
H2C |
|
CH2 |
H2C |
|
CH2 |
|
CH2 |
H2C |
|
CH2 |
|||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
O |
|
O |
|
|
|
|
|
|
H2C |
|
CH2 |
|||
|
|
|
окись |
|
|||||||||
окись |
|
|
тетрагидро- |
||||||||||
этилена ( ) |
триметилена ( ) |
фуран ( ) |
|||||||||||
эпоксиэтан |
1,3-эпоксипропан |
1,4-эпоксибутан |
|||||||||||
Наибольшее практическое значение имеет окись этилена. В промышленных масштабах еѐ получают из этилена через этиленхлоргидрин
119
Cl2 + H2C CH2 + H2O  ClH2C CH2OH + HCl
ClH2C CH2OH + HCl
2ClH2C |
|
CH2OH + Ca(OH)2 |
|
2 H2C |
|
CH2 + CaCl2 + H2O |
|
|
|
O
или прямым окислением этилена кислородом воздуха при температуре ~ 250 °С на серебряном катализаторе.
2H2C |
|
CH2 + O2 |
|
2 H2C |
|
CH2 |
|
|
|
||||
|
O
Окись этилена кипит при температуре 10,7 °С, с водой смешивается в любых отношениях. По химическим свойствам она мало похожа на простые эфиры. Это химически активное вещество, для которого характерно размыкание трѐхчленного цикла. При этом активный атом водорода атакующего реагента неизменно идѐт к кислороду, а остальная часть – к углероду окисного кольца.
H2C CH2 + H X |
H2C CH2 |
O |
HO X |
Неустойчивость окиси этилена обусловлена значительным отклонением величины угла С–О–С от нормальной, что приводит к сильному напряжению цикла.
C
Диоксан же
90 |
|
C |
o |
C |
|
|
|
|
O |
|
|
|
CH2 |
CH2 |
O |
|
O |
60o
O
C
CH2 CH2 ,
имеющий нормальные валентные углы, по устойчивости не отличается от простых эфиров с открытой цепью. Окись этилена может присоединять воду с образованием этиленгликоля, аммиак с образованием этаноламина, амины, спирты и другие соединения с активным водородом.
На основе окиси этилена в промышленности органического синтеза получают в больших масштабах уксусную кислоту, этанол, диоксан (растворитель), этиленгликоль, эфиры этиленгликоля, этаноламин, акрилонитрил, моющие средства и целый ряд других продуктов.
120
