
- •ВВЕДЕНИЕ
- •ЛАБОРАТОРНАЯ РАБОТА № 1
- •ЛАБОРАТОРНАЯ РАБОТА № 2
- •ЛАБОРАТОРНАЯ РАБОТА № 3
- •ЛАБОРАТОРНАЯ РАБОТА №4
- •ЛАБОРАТОРНАЯ РАБОТА №5
- •ЛАБОРАТОРНАЯ РАБОТА № 6
- •ЛАБОРАТОРНАЯ РАБОТА №7
- •ЛАБОРАТОРНАЯ РАБОТА № 8
- •ЛАБОРАТОРНАЯ РАБОТА №9
- •ЛАБОРАТОРНЫЕ РАБОТЫ № 10–12
- •ЛАБОРАТОРНАЯ РАБОТА № 10
- •ЛАБОРАТОРНАЯ РАБОТА № 11
- •ЛАБОРАТОРНАЯ РАБОТА № 12
- •ЛАБОРАТОРНАЯ РАБОТА №13
- •ЛАБОРАТОРНАЯ РАБОТА № 14
- •ЛАБОРАТОРНАЯ РАБОТА № 15
- •ЛАБОРАТОРНАЯ РАБОТА №16
- •ЛАБОРАТОРНАЯ РАБОТА № 17
2.Записать уравнение динамики вращательного движения твёрдого тела относительно неподвижной оси, теорему Штейнера
изакон сохранения момента импульса.
3.Сформулировать коротко суть метода, применяющегося в лабораторной работе, для определения момента инерции крутильного маятника и модуля кручения нити. От каких величин зависит модуль кручения?
Вопросы и задания к защите лабораторной работы
1.Записать законы сохранения для абсолютно упругого соударения в системе «математический–крутильный маятники».
2.Доказать, что решением уравнения 02 0 является
выражение 0 cos( 0t ) .
3. Могут ли синусы углов, входящие в формулу (9.8), быть заменены самими углами? Как это сказалось бы на точности расчёта момента инерции крутильного маятника.
Библиогр.: [1]; [2, § 36, 38, 39, 43, 54]; [3, § 33-36, 46, 79]; [5, § 4.1-4.3, 27.1, 27.2].
ЛАБОРАТОРНЫЕ РАБОТЫ № 10–12
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ИДЕАЛЬНОГО ГАЗА ПРИ ПОСТОЯННЫХ ДАВЛЕНИИ
И ОБЪЁМЕ C p  CV РАЗЛИЧНЫМИ МЕТОДАМИ
CV РАЗЛИЧНЫМИ МЕТОДАМИ
Краткие сведения из теории
Законом сохранения энергии для систем, в которых существенное значение имеют тепловые процессы, является первое начало термодинамики: теплота, сообщённая системе, расходуется на изменение её внутренней энергии U и на совершение этой сис-
77

темой работы A против внешних сил: Q U A . Более важной является дифференциальная форма этого закона:
|
Q dU A , |
(I) |
где |
dU – бесконечно малое изменение внутренней энергии систе- |
|
мы, |
A– элементарная работа, Q – бесконечно малое количество |
|
теплоты. Различие дифференциалов ( d – полный |
дифференциал, |
|
– неполный дифференциал) обусловлено различием смысла функций: внутренняя энергия является функцией состояния ( dU 0 ),
а теплота и работа – функциями процесса ( Q 0; A 0 ).
Теплоёмкостью называется величина, равная отношению количества теплоты δQ, сообщаемого телу при бесконечно малом изменении его состояния в каком-либо процессе, к соответствую-
щему изменению dТ температуры этого тела: Cтела Q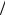 dT . Если эта величина рассчитывается на единицу массы, теплоёмкость называется удельной (обозначается «c» и измеряется в Дж/кг·К). Если же расчёт ведётся на 1 моль вещества, теплоёмкость называется молярной (обозначается « C » и измеряется в Дж/моль·К).
dT . Если эта величина рассчитывается на единицу массы, теплоёмкость называется удельной (обозначается «c» и измеряется в Дж/кг·К). Если же расчёт ведётся на 1 моль вещества, теплоёмкость называется молярной (обозначается « C » и измеряется в Дж/моль·К).
Из определения теплоёмкости видно, что она, так же как иQ , является функцией процесса и, следовательно, понятие тепло-
ёмкости не имеет смысла, пока не задан путь, на котором система получает бесконечно малое количество теплоты. Таких путей, а значит, и теплоёмкостей существует бесчисленное множество. Наиболее часто применяемые из них (но не единственно возмож-
ные) – теплоёмкости при постоянном объёме CV и постоянном давлении C p . Однако, как только тот или иной путь подвода тепла
фиксирован, теплоёмкость превращается из функции процесса в функцию состояния, что позволяет вычислять её с помощью част-
ных производных: |
|
Q |
8 |
, где «x» – параметр, постоянство |
Cx |
|
|
||
|
|
T x |
|
|
которого определяет путь подвода тепла, в частности, им может быть объём V или давление p.
8 Читается: dQ по dT при постоянном x.
78

Внутренняя энергия одного моля идеального газа может быть представлена в виде U 2i RT , где i – число степеней свободы мо-
лекул этого газа; R 8,31 Дж/моль·К – универсальная газовая постоянная. Если учесть, что в изохорическом процессе (V=const) газ работы не совершает ( A pdV 0 ), то, исходя из уравнения (I),
получим C |
|
Q |
|
U |
. Но так как внутренняя энергия |
|
|
|
|
||
V |
|
T |
|
T |
|
|
|
V |
|
V |
|
идеального газа зависит только от температуры, то последнюю частную производную можно заменить на обычную, и тогда молярная теплоёмкость при постоянном объёме определится как
C dU |
|
i |
R . |
(II) |
|
|
|||||
V |
dT |
2 |
|
|
|
|
|
|
|||
Для того чтобы отыскать молярную теплоёмкость идеального газа для изобарического процесса (p=const), нужно использовать кроме первого начала термодинамики, уравнение состояния, которое в этом случае, как известно, имеет вид
pV |
m |
RT , |
(III) |
|
M |
||||
|
|
|
где m и M – масса и молярная масса газа соответственно. Тогда для одного моля
|
|
|
Q |
|
U |
|
V |
|
dU |
|
R |
|
C |
p |
|
|
|
|
p |
|
|
|
p |
|
|
|
|
|||||||||||
|
|
|
T p |
T p |
T p |
|
dT |
|
p |
|||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cp CV R . |
|
|
|
|
(IV) |
|||
Это уравнение впервые было получено Ю. Майером, немецким врачом и естествоиспытателем, и носит его имя. Майеру также принадлежит заслуга открытия первого начала термодинамики. Обратим внимание на то, что соотношение (IV) справедливо в таком виде только для молярных теплоёмкостей. С учётом (II) формулу (IV) можно также представить через число степеней свободы молекулы газа:
79

Cp |
i 2 |
R . |
(V) |
|
|||
2 |
|
|
|
Одним из важнейших соотношений между теплоёмкостями C p и CV (не обязательно молярными) является их отношение, на-
зываемое коэффициентом Пуассона (γ):
|
Cp |
|
i 2 |
. |
(VI) |
|
C |
i |
|||||
|
|
|
|
|||
|
V |
|
|
|
|
|
Как видно, в случае идеального газа |
зависит только от числа |
|||||
степеней свободы молекулы, которое можно определить как число её возможных независимых движений. Поскольку материальная точка может совершать только поступательное движение вдоль трёх пространственных осей, присущее ей, а значит, и одноатомной молекуле число степеней свободы равно трём ( i = 3, = 5/3).
Для двухатомной молекулы добавляются ещё вращения вокруг двух взаимно перпендикулярных осей, проходящих через её центр инерции, но не совпадающих с линией, соединяющей центры атомов ( i = 5, = 1,4). Наконец, при трёх и более атомах в молекуле
все |
ограничения на |
возможные движения снимаются ( i = 6, |
= |
4/3). Подчеркнём |
тот факт, что всё сказанное справедливо |
только для жёстких, движущихся как целое, молекул, т.е. молекул, атомы которых не совершают колебаний.
Рассмотрим изменение состояния идеального газа при его адиабатическом расширении. Адиабатическим процессом называется процесс, протекающий без теплообмена с окружающей средой ( Q = 0). При этом первое начало термодинамики примет вид
pdV Mm 2i RdT .
Газ при адиабатическом расширении и сжатии совершает работу только за счёт своей внутренней энергии. Следовательно, при расширении он охлаждается, а при сжатии нагревается. Соотношение между давлением и объёмом идеального газа при адиабатическом процессе представляет уравнение Пуассона, или уравнение адиабаты:
pV const . |
(VII) |
80
