
Uchebnik
.pdf
УФ-спектры антрахинонов можно рассматривать как комбинацию поглощений, обусловленных ацетофеноновым и бензохиноновым хромофорами. Интенсивная полоса около 250 нм, среднее или слабое поглощение при 320-322 нм, сильные полосы в области 260 и 270 нм, поглощение около 400 нм, являются характеристичными, и модель спектра в ультрафиолетовой области не претерпевает принципиальных изменений под влиянием заместителей.
Большинство природных антрахинонов содержат, по крайней мере, четыре заместителя, которые видоизменяют спектры поглощения, и поэтому могут быть исключены из изложенных выше правил.
В качестве примера можно привести вещества, выделенные из семян и коры стеблей Cassia renigera с одной, двумя и более, чем двумя α- оксигруппами, в электронном спектре которых длинноволновый максимум находится при 410, 430 и 510 нм соответственно:
λmax=410 нм |
λmax=430 нм |
λmax=510 нм |
Дополнительную информацию о количестве и расположении α-оксигрупп можно получить измеряя батохромный сдвиг длинноволнового поглощения при ионизации оксиантрахинонов в растворах щелочей, который составляет от 70 до 100 нм. Указанный эффект дает возможность судить о наличии свободного фенольного гидроксила в соединении или о характере гидроксила, к которому присоединен сахарный остаток.
Максимум антрахинонов, находящийся в интервале от 220 до 230 нм, для антронов и диантронов сдвигается в коротковолновую область и на обычных спектрофотометрах не замеряется. Максимум между 250 и 270 нм сдвигается батохромно при переходе от антрахинона к антрону до 9 нм, от антрона к диантрону – от 3 до 15 нм, а от антрахинона к диантрону – от 3 до 21 нм, максимум для антрахинонов от 285 до 310 нм для диантронов не найден.
Влияние электронодонорных заместителей приводит к значительным изменениям УФ-спектров, влияние акцепторных заместителей сказывается в меньшей степени. Существенное влияние на характер спектра оказывают стерические факторы и природа растворителей.
Спектры поглощения в ИК-области позволяют идентифицировать функциональные группы, внутри- и межмолекулярную водородную связь, не прибегая к качественным реакциям и микроанализу. Две орто-ОН-группы образуют пятичленный гетероцикл, который обнаруживается в концентрированных растворах. α- и β-ОН-группы отличаются характеристической областью поглощения, причем число полос в каждой области соответствует числу ОН-групп. По положению полос поглощения С=О группы можно сделать заключение о степени ее электроотрицательности, а число и интенсивность этих полос определяются положением других заместителей. Другая важнейшая характеристика ИК-спектров - интегральная интенсивность полос - мало
531
используется в структурных исследованиях антрахинонов, однако показано, что последняя, например, может быть использована для различия окисленных и восстановленных форм.
β-оксигруппы в ИК-спектрах можно определить по узкой полосе в области 3600-3150 см-1. Если имеется более, чем одна такая полоса, это указывает, что две или больше β-оксигрупп находятся в различном окружении. Производные антрахинона без α-оксигрупп имеют одну сильную карбонильную полосу в области 1678-1653 см-1, вещества с одной α-окси-группой имеют две карбонильные частоты в области 1675-1647 см-1 и 1637 и 1624 см-1 .
Две α-оксигруппы в 1,4- и 1,5-положениях дают спектры с одной карбонильной полосой между 1645 и 1608 см-1, а в 1,8-положениях две полосы, между 1678 и 1661 см-1 и 1626 и 1616 см–1, α-оксигруппы, в 1,4,5-положениях отличает единственная карбонильная полоса между 1616 и 1592 см-1.
Сравнение ИКспектров антрахинонов, антронов и диантронов показывает большое различие между ними в интервале 1695 и 1429 см-1. Например: хризофанол - 1673, 1630 см–1, хризофанол-9-антрон – 1636 см-1, хризофанолдиантрон – 1625 см–1.
В ИК-спектрах некоторых антронов иногда прописывается два максимума поглощения в указанном интервале, что свидетельствует о наличии диастереоизомеров этих веществ, например, барбалоин, алоин А и алоин В.
Общей особенностью масс-спектров всех хинонов являются пики,
обусловленные потерей одной или двух молекул окиси углерода, а бензо- и нафтохиноны элиминируют также ацетиленовый фрагмент их хинонового кольца и, если последнее оксилировано, распад сопровождается характерной водородной перегруппировкой. В ряду антрахинонов почти неизменно молекулярный ион образует основной пик. Незамещенный антрахинон претерпевает элиминирование двух молекул окиси углерода, что дает интенсивный пик при m/z 180 (М+-СО) и 152 (М+-28) и интенсивные двухзарядные ионы при m/z 90 и 76, которые соответствуют молекулярным ионам флуоренона и бифенилена. Спектры производных антрахинонов обладают добавочными пиками, соответствующими заместителям в α-или β- положении, например, в спектре 2-оксиантрахинона появляются пики (М+-СО)
и(М+-НО), и пик при m/z 140 соответствует потере трех молекул окиси
углерода, из которых третья получается из фенильной группы. Диоксиантрахиноны ведут себя подобным образом, а пик при m/z 128 (М+-4СО) может быть молекулярным ионом нафталина. Пери-метоксигруппа дает пики (М+-ОН)
и(М+-Н2О), которые не наблюдаются для β-метоксипроизводных, причем 1,8- диметоксиантрахинон можно отличить от 1,5-изомера по интенсив-ному (М+- СН3) иону, а α-,и β-метоксисоединения отличает формильный радикал (М+- СОН). Спектры полиоксиантрахинонов характеризуются наличием интенсивного пика молекулярного иона (М+), пиков фрагментов (М+-ОН), (М+-СО), (М+- НСО), (М+-2СО), а также пиков, обусловленных альтернативным элиминированием указанных групп. Так для молекул фисциона, хризофанола, эмодина и алое-эмодина, заместителями в которых являются метильная, окси- и оксиметильная группы, характерно наличие указанных выше пиков и пиков,
532
обусловленных последовательным элиминированием указанных групп: в массспектрах хризофанола и эмодина имеются диагностические пики ионов (М+- 15), а фисциона и алое-эмодина (М+-31).
Успешное использование ПМР-спектроскопии для структурного анализа антрахинонов и особенно антрагликозидов затрудняется перекрыванием и наложением некоторых сигналов из-за небольших различий химических сдвигов, а также усложненным спин-спиновым взаимодействием.
В связи с тем, что многие природные антрахиноны имеют фенольные оксигруппы, различают сигналы протонов, относительно ОН-групп: сигналы α- протонов антрахинонов резонируют в области 8.32-8.23 м.д. в случае отсутствия заместителей в кольце, а при наличии последних – в интервале от 7.99 до 6.72 м.д. Сигналы β-протонов при отсутствии заместителей резонируют в области от 7.33 до 6.13 м.д., константа взаимодействия протонов в метаположении, как правило - 2.4-2.6 Гц. Иногда возможно различить периводородные атомы по соседству с которыми находится гидроксил (7.44-7.30 м.д.) или метил (7.25-6.95 м.д.), хотя в этой области могут быть сигналы водорода, расположенного между СН3 и ОН группами (7.20-6.97 м.д.).
При изучении строения природных антрахинонов часто возникает проблема определения положения О-метильных и О-гликозильных заместителей, особенно для 1,8-диоксизамещенных, если одна из этих групп этерифицирована или гликозидирована. Гликозидирование какой-либо одной из окси-групп 1,8- диоксиантра-хиноновой системы сдвигает сигналы орто-протона в область более высокого поля на 0.3-0.5 и пара-протона на 0.1-0.2 м.д. в то время как сигналы остальных бензоидных протонов остаются неизмененными.
При исследовании структур новых соединений широко применяется сравнение химических сдвигов в ПМР-спектрах антрахинонов, антрагликозидов и их перацетатов. В качестве примера можно привести использование ПМР-спектра при установлении строения фисцион-О-β-генциобиозида. В ПМРспектре его перацетата имеются сигналы ацетокси- и ароматической СН3-групп (2.45 м.д.), шести спиртовых ацетокси- (2.00 м.д.) и спиртовой ацетокси-группы (1.80 м.д.), указывающие на присутствие дисахаридного остатка, присоединенного к оксигруппе в положениях С-1 и С-8 или агликона. В ароматической области имеются два мета взаимодействующих дублета (7.50 и 6.88 м.д., J=2.5 Гц каждый) и 2 уширенных синглета (7.92 и 7.18 м.д.), приписываемых двум протоном другого кольца. В ПМР-спектре перацетата эмодин-1-О-глюкозида дублет Н-5 находится в более низком поле, чем синглет Н-4, и учитывая соответствующие сигналы перацетата изомерного 8-О-глюкозида эмодина, возможен вывод, что соединение является фисцион-8-О-β-генциобиозидом.
Таким образом, информация о структуре антрахинонов, получаемая из ПМР-спектров, касается числа и положения ароматических протонов, а также положения и строения водородсодержащих заместителей.
Так, сигналы алкокси-групп прописываются в области до 4.6 м.д., метильной группы - в ароматическом кольце - около 2.12-2.65 м.д., в боковой цепи – 0.92-1.12, в ацетильной группе β-положений – 2.45-2.52, α-положений –
1.93-2.24 м.д. и т.д.
533
Метод 13С-ЯМР в комплексе с другими, используется для доказательства строения углеродного скелета с наибольшим сдвигом углеродных атомов С=О групп. Например, в растворе СDCl3 сигналы прописываются следующим
образом: С9,10 – 181.1, С1,4,5,8 – 134.1, С2,3,6,7 – 127.3, узловые С – 133.7 м.д.
Введение донорных заместителей приводит к смещению сигнала соединенного с ним углеродного атома в слабое поле.
Тонкую структуру молекул устанавливают комплексом физикохимических свойств и встречным синтезом. Изомерные лакцины (эритро-, дезокси-, изоэритро-), гомонаталоин, эмодин-наталоэ, большая группа димеров, отличающихся типом связи между мономерами, наличием и характером замещения в них, типом мономеров, степенью их окисленности, идентифицируются комплексом хроматографических, спектральных свойств, химическими превращениями и встречным синтезом.
Тип связи в димерах надежно определяется по характеру поглощения С=О групп в ИК-спектрах, по количеству и положению сигналов α- и β-протонов ароматической системы в ПМР-спектрах с интегральной кривой и по М+ и характеру фрагментации в масс-спектрах. Однако следует учитывать возможность наложения сигналов ароматических протонов, что приводит к усложнению спектра в этой области, и различную устойчивость С-С связей между мономерами к действию электронного удара.
Для идентификации наиболее распространенных соединений достаточным является ПМР-спектр, в котором, например, хризофанол, алое-эмодин и реин четко различаются в области 2.40-2.50 м.д. (СН3, СН2ОН, СООН), а от франгула-эмодина и фисциона их отличает наличие триплетного сигнала Н7. Характерной особенностью фисциона является наличие синглетного сигнала протонов ОСН3-группы.
При нагревании эмодина и хризофанола в растворе третичного бутилового спирта в присутствии Zn-пыли получены димерные структуры, аналогичные природным и идентифицированные сравнением всех спектров с последними.
Следует отметить, что для димеров наиболее информативны масс-спектры, однако по ним и ПМР-спектрам нельзя получить однозначной информации о типе(ах) связи между мономерами, поэтому тип связи и число связей определяют комплексом методов по отсутствию или смещению сигналов тех или иных протонов, по ИК-спектрам (тип связи) по интенсивности и батохромному сдвигу полос и в сравнении со спектрами соответствующих мономерных молекул и их ацетатов.
Тип и число связей в димерах можно установить сравнением при встречном синтезе. Например, структуры с 1,1’-, 8,8’- и 1,1’,8,8’- получены синтезом из мономеров по реакции отщепления HBr либо ZnBr2, или по реакции хризофанола с 1,8-дибромхризофанолом в 50% растворе КОН в кварцевой ампуле при облучении УФ-светом. Так получен новый димер хризофанола с гиперициновым типом связи, структура которого была доказана сравнением с гиперицином химическими и спектральными данными.
Различия одинаковых гликозидированных форм эмодина и фисциона наглядны при сопоставлении их спектров:
534

Химические сдвиги атомов углерода в 13С – ЯМР спектрах природных 9,10-антрахинонов
|
|
|
|
|
|
Вещества |
|
|
|
|
|
|
|
|
№ атома |
Хри- |
Хризо |
Эмодин |
Фисцион |
Эмодина |
Фисцион |
Кни- |
Вис- |
Эмодин |
Эмодин |
Эмодин |
Фисцион- |
|
углерода |
зазин |
фанол |
|
|
тримети- |
диацетат |
фолон |
миа- |
три- |
8-О- |
8-О-β- |
8-О-β- |
|
|
|
|
|
|
ловый |
|
|
хинон |
ацетат |
генцио- |
прим- |
прим- |
|
|
|
|
|
|
эфир |
|
|
|
|
биозидо- |
верозид |
верозид |
|
|
|
|
|
|
|
|
|
|
|
ацетат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
161.27 |
162.4 |
161.19 |
162.5 |
163.67 |
150.2 |
161.7 |
162.6 |
150.73 |
149.99 |
161.16 |
164.7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
124.29 |
124.5 |
123.88 |
124.5 |
119.56 |
130.8 |
124.6 |
124.2 |
131.19 |
130.45 |
124.2 |
119.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
137.33 |
149.3 |
148.04 |
148.6 |
144.58 |
145.8 |
151.6 |
148.1 |
146.57 |
145.41 |
146.96 |
147.0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
119.22 |
121.4 |
120.22 |
121.3 |
118.97 |
125.9 |
128.5 |
121.0 |
126.28 |
125.25 |
119.30 |
124.1 |
|
5 |
119.22 |
119.9 |
108.66 |
106.8 |
101.87 |
109.3 |
119.0 |
|
118.46 |
114.75 |
108.78 |
108.3 |
536 |
|
|
|
|
|
|
|
165.8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
137.32 |
136.9 |
165.40 |
166.6 |
161.67 |
164.0 |
137.4 |
|
155.11 |
154.78 |
164.60 |
160.5 |
|
|
|
|
|
|
|
|
162.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
124.29 |
124.3 |
107.71 |
108.2 |
105.26 |
116.3 |
123.3 |
|
123.61 |
116.09 |
108.70 |
107.0 |
|
|
|
|
|
|
|
|
163.7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
161.27 |
162.7 |
164.32 |
165.2 |
159.76 |
152.3 |
161.1 |
|
151.90 |
157.96 |
161.90 |
161.6 |
|
9 |
191.83 |
192.5 |
189.44 |
190.8 |
181.70 |
179.5 |
192.5 |
190.9 |
180.20 |
179.27 |
186.59 |
186.3 |
|
10 |
181.21 |
181.9 |
180.92 |
181.0 |
184.34 |
182.2 |
181.9 |
182.4 |
181.84 |
181.69 |
182.36 |
181.7 |
|
11 |
133.13 |
133.6 |
134.77 |
135.3 |
136.39 |
136.0 |
134.4 |
|
136.08 |
135.55 |
136.65 |
136.3 |
|
12 |
115.77 |
115.8 |
108.66 |
110.3 |
118.39 |
119.2 |
115.5 |
|
123.24 |
121.12 |
114.05 |
106.9 |
|
13 |
115.77 |
113.7 |
112.99 |
113.7 |
121.52 |
123.0 |
114.7 |
113.5 |
123.00 |
123.90 |
114.63 |
114.4 |
|
14 |
133.13 |
133.2 |
132.51 |
133.2 |
134.40 |
134.2 |
131.6 |
133.0 |
134.52 |
133.68 |
132.28 |
131.9 |
|
ОСН3-3 |
|
22.3 |
21.44 |
22.2 |
22.04 |
21.5 |
20.4 |
22.1 |
21.68 |
|
21.22 |
21.2 |
|
|
|
|
|
|
|
|
127 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОСН3-6 |
|
|
|
56.1 |
|
56.1 |
|
56.1 |
|
|
|
56.0 |
Химические сдвиги атомов углерода в 13С – ЯМР спектрах природных 9,10-антрахинонов
|
|
|
|
|
Вещества |
|
|
|
|
|
|
|
№ атома |
Ализарин |
Руберит |
Луцидин |
Луцидин- |
Иберицин |
2-метил- |
Гл-1 |
Гл-2 |
Гемеро- |
Карми- |
|
углерода |
|
риновая |
|
примверозид |
|
1,3,6- три- |
|
|
каль |
новая |
|
|
|
кислота |
|
|
|
оксиантра- |
|
|
|
кислота |
|
|
|
|
|
|
|
хинон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
150.66 |
150.95 |
163.4 |
161.78; 161.9 |
163.63 |
162.01 |
163.63 |
163.57 |
148.7 |
157.9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
152.56 |
151.53 |
120.1 |
123.50; 123.5 |
117.05 |
117.10 |
120.56 |
120.56 |
141.15 |
121.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
120.91d |
120.68d |
163.0 |
161.67; 161.7 |
164.03 |
162.71 |
159.94 |
160.17 |
129.54 |
154.0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
120.62d |
120.21d |
107.7 |
106.21d; |
107.65d |
106.78d |
105.22d |
105.05d |
120.31d |
147.6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
126.44d |
126.56d |
126.5 |
126.73d; |
126.62d |
112.20d |
112.60d |
112.72d |
118.74d |
111.4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
134.74d |
134.98d |
134.3d |
134.51d; |
134.46d |
161.67d |
161.27 |
161.32 |
133.24d |
159.8 |
|
|
|
|
|
|
|
|
|
|
|
|
537 |
7 |
133.65d |
134.11d |
133.1d |
134.51d; |
134.23d |
120.85d |
121.48d |
121.43d |
115.00d |
131.9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
126.16d |
126.39d |
126.2d |
126.33d; |
126.21d |
128.98d |
129.56d |
129.62d |
158.16 |
140.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
183.34 |
188.20 |
185.9 |
186.81; 186.9 |
185.89 |
185.25 |
186.18 |
186.23d |
185.13 |
186.0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
180.06 |
180.64 |
181.5 |
181.21; 181.3 |
181.44 |
181.56 |
181.56 |
181.56 |
177.76 |
186.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
132.50 |
132.73 |
132.7 |
132.67; 132.7 |
132.84 |
131.46 |
131.86 |
131.92 |
134.19 |
135.6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
133.31 |
133.13 |
131.7 |
132.55; 131.5 |
132.67 |
124.54 |
124.31 |
124.43 |
121.10 |
123.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
13 |
115.89 |
116.11 |
110.6 |
111.22; 112.3 |
108.86 |
108.34 |
110.59 |
110.58 |
113.30 |
105.0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
14 |
123.50 |
125.69 |
133.9 |
133.54; 133.7 |
136.59 |
131.46 |
135.21 |
135.27 |
134.19 |
111.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН2ОН-2 |
СН2ОН-2 |
СН2ОСН2С |
СН2О-2 |
СН3-2 |
СН2-2 |
СН2ОН- |
СН3-8 |
|
|
|
|
51.2t |
50.19t |
65.21t |
7.90q |
8.76q |
8.76q |
58.03t |
19.8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50.9t |
59.21t |
|
|
|
ОСН3-1 |
COOH-7 |
|
|
|
|
|
|
15.28q |
|
|
|
54.6q |
167.9 |
|
|
|
|
|
|
|
|
|
|
|
|
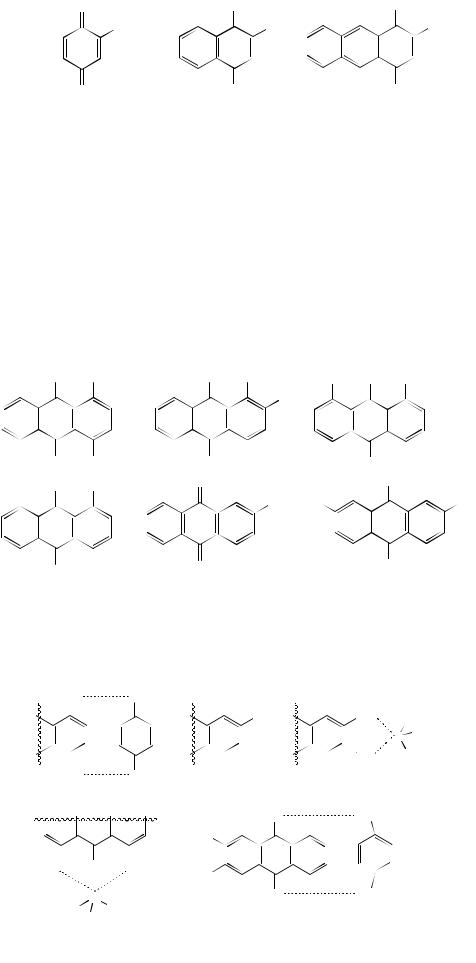
Примеры установления структур
Как видно, общим для трех структур является оксихиноновый фрагмент; отличие – число ароматических колец. Это можно увидеть в ИК-спектре в области «отпечатков пальцев» (вещество 2 – одно; вещество 3 – два кольца). Чем больше ароматичность, тем больше полос в указанной области.
ВПМР-спектрах также будут отличия в числе и характере сигналов протонов ароматических колец: 2 – два двухпротонных; 3 – три двухпротонных сигнала (попарная эквивалентность).
Вспектрах 13С-ЯМР все три структуры будут четко отличаться числом сигналов, соответствующих числу углеродных атомов.
Масс-спектры по характеру фрагментации будут иметь много общего, но молекулярная масса, М+ всех трех структур будет различной.
Приведенные структуры – изомеры; общее – скелет молекулы – различие – расположение двух ОН-групп (диоксиантрахиноны).
Из качественных реакций информативными будут: для вещества 1 – хингидронная проба; для 2 и 5 – с борной кислотой; для 3 – образование комплекса с алюминия хлоридом; для вещества 5 – с гидрохиноном:
538
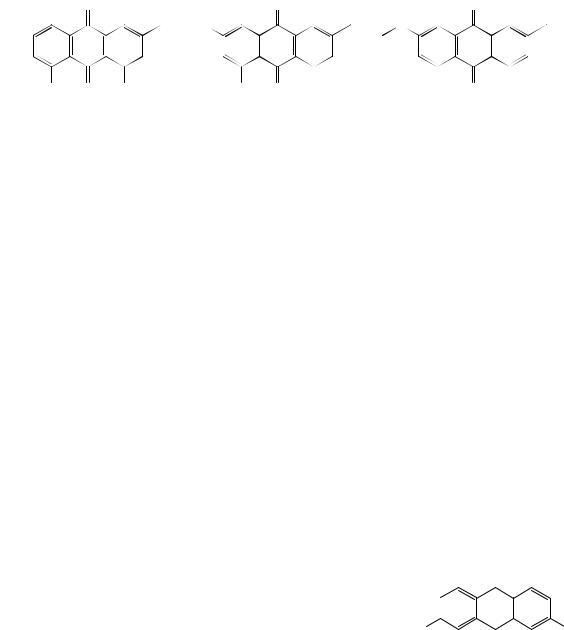
ИК-, масс- и 13С-ЯМР-спектры будут иметь больше общих признаков, чем отличий, т.к. М+, число С=О и ОН одинаковы.
Хроматографическая подвижность (Rf) и удерживание на колонках будут различными, но для идентификации каждой молекулы необходимо будет сравнение со стандартными образцами таких молекул.
Наиболее информативным будет ПМР-спектр каждого соединения + качественные реакции:
1 – два двухпротонных сигнала одного кольца и дублет (2Н) другого кольца;
2– 2do (2Н) одного кольца и 2d (1Н) с орто-КССВ другого кольца;
3– 2do (2Н) – попарная эквивалентность и 1dodo (2Н);
4– 2do (2Н) и 1dodo (2Н) с разными КССВ;
5– 2do (2Н) и dп (2Н);
6– 3 двух протонных сигнала: dмdп + dodм + dodп.
Общее:
скелет молекул;
СН3 в ароматическом кольце;
2 ОН с одинаковым расположением.
Отличие – во 2 структуре дополнительная ОН; в 3 – метокси-группы.
Эту разницу можно однозначно получить из сравнения их ПМР-спектров в ароматической области:
2 – дополнительно s (1Н) β-ОН – группы >10 м.д.;
3 – дополнительно s (3Н) β-ОСН3, 3-4 м.д.
Вещество 1 отнесено к 1,3,6-триоксипроизводным антрахинона на основании образования оранжево-красного окрашивания с 3% спиртовым раствором магния ацетата и красно-коричневого - в условиях реакции Борнтрегера.
Антрахиноновый скелет молекулы подтверждается наличием характеристичных максимумов (265, 284, 425, 432 нм) в УФ-спектре вещества в метаноле, а также двух полос карбонильных групп при 1665 (хелатная С=О) и 1630 см-1.
ПМР-спектр вещества содержит 4 дублетных однопротонных сигнала в области: 7.56, 7.16, 7.06 и 6.60 м.д. с константой мета-расщепления, что может соответствовать 1,3,6,8- типу замещения исследуемой молекулы.
Наличие -метильной группы в молекуле подтверждается трехпротонным
синглетным сигналом при 2.75 м.д. в отличие от –СН3 |
|
|
CH3 |
O OH |
|||
в области 2.05 м.д. |
|
|
|||||
|
|
|
|
|
|
|
|
На основании анализа экспериментальных данных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
для вещества 1 предложена структура - 8-метил-1,3,6- |
|
|
|
|
|
|
|
HO |
|
|
|
OH |
|||
|
|
||||||
триоксиантрахинон: |
|
|
|
|
|
|
|
|
|
|
O |
||||
539 |
|
|
|
|
|
|
|

Вещество 2 отнесено к гликозидированным окисленным формам антрахинонов на основании Rf на хроматограммах, а также наличия в продуктах кислотного гидролиза D-глюкозы.
Максимум (245 нм), в УФ-спектре вещества является характеристичным для окисленных форм антрахинонов.
Из данных ПМР-спектра следует, что вещество 4 содержит незамещенное кольцо А (8.25, 8.17, 7.83 и 7.81 м.д.), протоны кольца В прописываются в виде двух однопротонных дублетных сигналов с КССВ 0.90, при 7.22 и 6.51 м.д. ПМР-спектр также содержит типичный двухпротонный дублетный сигнал оксиметильной группы при 4.62 м.д., расположение которой у С-2 атома было установлено из анализа 13С-ЯМР-спектра вещества (сигнал С-2 – 50.9 м.д.). Отсутствие -гидроксильных групп установлено по сдвигу сигналов С-1 в высокочастотную область (109.1 и 107.8 м.д.) и сигналам 186.5 и 184.3 в 13С- ЯМР-спектре соответствующим двум карбонильным группам в структуре
исследуемого вещества. -конформация аномерного |
O |
|
|
|
||
|
|
|
|
|
||
центра в углеводном заместителе установлена по |
|
|
|
CH2OH |
||
|
|
|
||||
величине КССВ аномерного протона глюкозы (7.5 Гц) и |
|
|
|
|
|
|
характеристичному поглощению в ИК-спектре (890, |
|
|
|
O |
||
|
|
|
||||
|
|
|
|
|
||
-1 |
O |
O |
|
|
||
|
|
|||||
1010-1100 см |
). |
|
|
OH |
||
Исходя из анализа экспериментальных данных для |
|
|
|
|||
|
|
|
|
|
||
вещества 2 |
предложена структура 2-оксиметил- |
HO |
|
|
|
|
|
|
|
|
|
||
антрахинон-3-О- -D-глюкопиранозид: |
|
|
HO |
|
|
|
|
|
|
|
OH |
|
|
ВОПРОСЫ И ОТВЕТЫ ДЛЯ ЗАКРЕПЛЕНИЯ МАТЕРИАЛА
1Опишите классификацию хинонов.
2Перечислите структурные элементы молекул бензохинонов и опишите их химические свойства
3Покажите разнообразие, основные структурные элементы и химические свойства молекул нафтохинонов.
4Опишите классификацию антрахинонов.
5Покажите основные структурные элементы молекул антрахинонов и опишите их химические свойства.
6Сравните возможности анализа близких структурных аналогов в ряду бензо-, нафто- и антрахинонов.
1 Все природные хиноны классифицируют:
По количеству колец (бензо-, нафто-, антра-), характеру их конденсации (бензантрен-, фенантрен- и др.).
По расположению С=О групп (1,2-; 1,4-; 9,10-; амфи-; пери-).
По наличию, характеру и расположению других заместителей.
540
