
Uchebnik
.pdf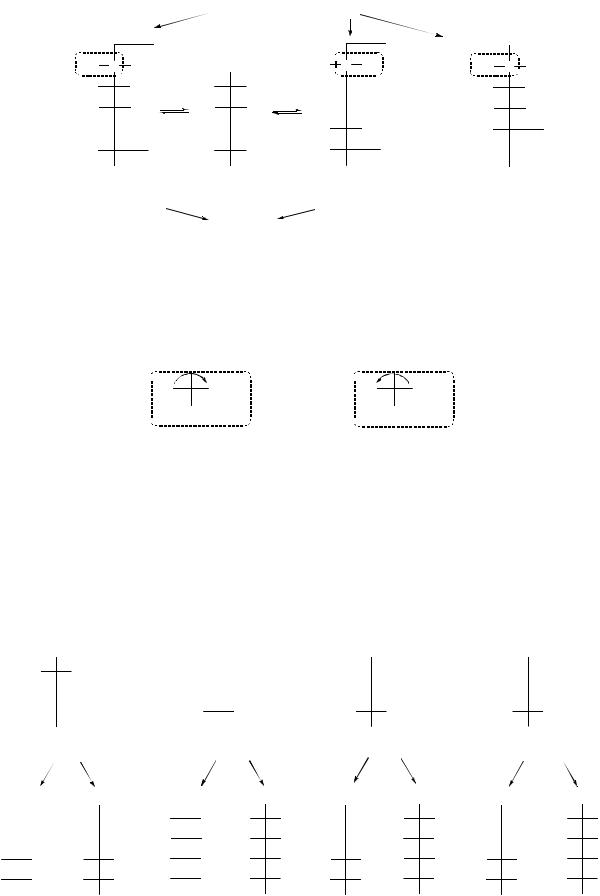
Расположение групп у каждого антипода - предмет изучения абсолютной конфигурации.
Сравнение аналогично построенных стереоизомеров – определение относительной конфигурации.
Для сравнения используют антиподы глицеринового альдегида (альдотриозы):
по часовой стрелке |
против часовой |
(+) |
стрелки (-) |
Расположение оксигруппы у последнего асимметрического атома углевода указывает на принадлежность углеводов к D- или L-ряду (справа (D) или слева (L)). Знак вращения (+) – вправо, (-) - влево - зависит от расположения заместителей у всех асимметрических атомов углерода.
Углеводы, отличающиеся конфигурацией (расположением заместителей) только у соседнего с С=О группой углеродного атома, называют эпимерами.
Наиболее распространены в природе пентозы и гексозы D-ряда:
|
CHO |
|
CHO |
|
CHO |
|
CHO |
H |
OH |
HO |
H |
H |
OH |
HO |
H |
H |
OH |
H |
OH |
HO |
H |
HO |
H |
H |
OH |
H |
OH |
H |
OH |
H |
OH |
|
CH2OH |
|
|
CH2OH |
|
|
CH2OH |
|
|
CH2OH |
|
||||
|
D-рибоза |
|
D-арабиноза |
|
D-ксилоза |
|
|
D-ликсоза |
|
||||||
|
CHO |
|
CHO |
|
CHO |
|
CHO |
|
CHO |
|
CHO |
|
CHO |
|
CHO |
H |
OH |
HO |
H |
H |
OH |
HO |
H |
H |
OH HO |
H |
H |
OH |
HO |
H |
|
H |
OH |
H |
OH |
HO |
H |
HO |
H |
H |
OH |
H |
OH |
HO |
H |
HO |
H |
H |
OH |
H |
OH |
H |
OH |
H |
OH |
HO |
H HO |
H |
HO |
H |
HO |
H |
|
H |
OH |
H |
OH |
H |
OH |
H |
OH |
H |
OH |
H |
OH |
H |
OH |
H |
OH |
|
CH2OH |
|
CH2OH |
|
CH2OH |
|
CH2OH |
|
CH2OH |
|
CH2OH |
|
CH2OH |
|
CH2OH |
D-аллоза |
D-альтроза |
D-глюкоза |
D-манноза |
D-гулоза |
D-идоза |
D-галактоза D-талоза |
|||||||||
391
Если в процессе окисления в организме группа СН2ОН СООН, возникает подкласс моносахаров – уроновые кислоты. В присутствии азота в организме возможна замена одной или нескольких ОН-групп на аминогруппу с образованием аминосахаров.
Встречаются и моносахара с разветвлением в углеродном скелете, поэтому природные углеводы нередко отличаются по составу от классической общей формулы Сn(H2O)n .
Позже было отмечено, что углеводы, как альдегиды, не дают реакции с фуксинсернистой кислотой и очень медленно взаимодействуют с бисульфитом натрия. В свежеприготовленных растворах углеводов меняется угол вращения.
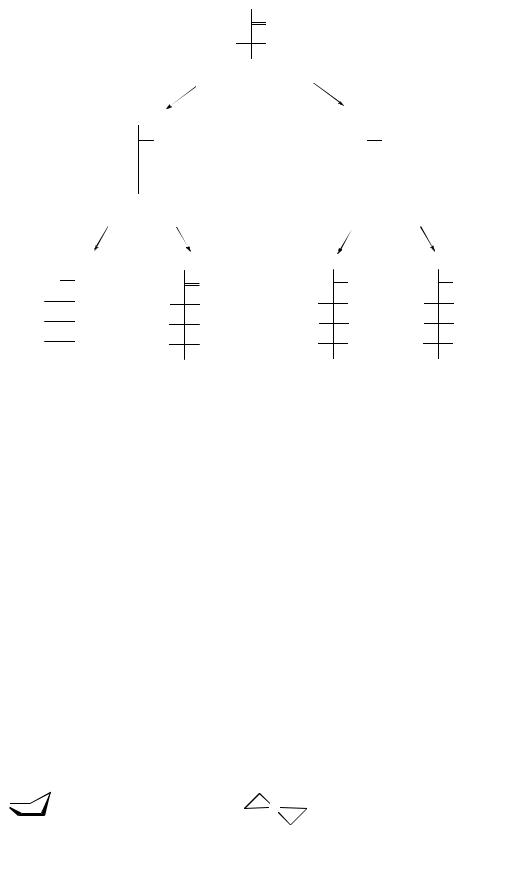
Толленс установил, что, в зависимости от условий, углеводы могут реагировать как оксиальдегиды и оксикетоны и как полуацетали, что возможно для равновесного состава открытых и циклических форм, причем, за счет образования полуацеталей, появляется новый асимметрический центр и количество изомеров удваивается.
По данным рентгеноструктурного анализа установлено, что фуранозный цикл имеет устойчивую конформацию «конверта» с выступающим из плоскости С2 или С3:
Изомеры, различающиеся пространственным расположением первого (гликозидного) гидроксила относительно «кислородного мостика», называют α- и β-аномерами.
Для шестичленных циклов наиболее устойчивы форма «кресла» и «ванны»:
392
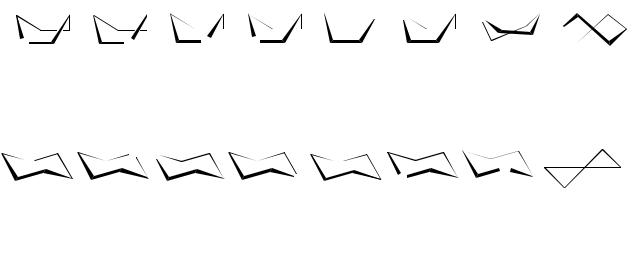
При этом все, что в формуле Фишера располагается слева – в формуле Хеуорзса направлено вверх, все что справа – вниз.
Во многих реакциях моносахара ведут себя как смесь α- и β-форм. В таких случаях структурную формулу принято писать с неопределенной конфигурацией аномерного центра, например: α-глюкоза имеет [α]D +109.60, β - +20.50 равновесное состояние характеризуется [α]D +52.30.
ведут себя как смесь α- и β-форм. В таких случаях структурную формулу принято писать с неопределенной конфигурацией аномерного центра, например: α-глюкоза имеет [α]D +109.60, β - +20.50 равновесное состояние характеризуется [α]D +52.30.
Ниже приведены альтернативные качественные реакции различных углеводов, которые используют для отнесения углеводов к одной из групп:
реактивы |
|
|
|
|
|
|
углеводы |
|
|
|
|
|
|
цвет |
||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
||
AgNO3 |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
- |
|
+ |
- |
- |
+ |
+ |
- |
+ |
черн. |
Хлористый |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
- |
|
+ |
- |
- |
- |
- |
- |
+ |
кр |
трифенил- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
диазоний |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Периодат- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
+ |
+ |
+ |
+ |
+ |
+ |
+ |
бел |
бензидин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Резорцин |
син |
- |
+ |
кр |
ж |
кр |
- |
- |
- |
|
+ |
- |
- |
- |
+ |
- |
- |
|
Перйодат - |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
+ |
+ |
+ |
+ |
+ |
+ |
+ |
син |
КMnO4 - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензидин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Антрон |
- |
- |
- |
+ |
- |
+ |
+ |
- |
- |
|
- |
- |
- |
- |
- |
+ |
- |
желт |
Кислый |
кр |
кор |
- |
- |
кор |
- |
+ |
- |
- |
|
+ |
- |
- |
+ |
+ |
+ |
+ |
|
фталат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
анилина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Анилин- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
|
+ |
- |
- |
- |
- |
+ |
+ |
разн |
дифениламин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нингидрин |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
- |
- |
- |
- |
- |
- |
+ |
фиол |
о-толуидин |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
- |
|
- |
- |
- |
+ |
+ |
+ |
+ |
разн |
Мочевина |
- |
+ |
+ |
+ |
- |
- |
- |
+ |
- |
|
+ |
- |
- |
+ |
+ |
+ |
+ |
разн |
Реакция |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
+ |
+ |
+ |
+ |
+ |
- |
+ |
фиол |
Молиша |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакция |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
+ |
|
+ |
+ |
син |
+ |
+ |
+ |
+ |
разн |
Келлер- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Килиани |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Раствор |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
- |
|
+ |
- |
+ |
+ |
+ |
- |
+ |
разн |
Фелинга, t0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1=альдопентозы |
; 2=альдогексозы; 3=кетопентозы; |
4=кетогексозы; |
5=метилпентозы; |
|||||||||||||||
6=невосстанавливающие дисахариды; 7=восстанавливающие дисахариды; 8=сахароспирты; 9=невосстанавливающие кислоты; 10=уроновые и кетокислоты; 11=лактоны; 12=дезоксисахара; 13=метилированные альдозы; 14=метилированные кетозы; 15=фосфорные эфиры; 16=аминосахара.
393
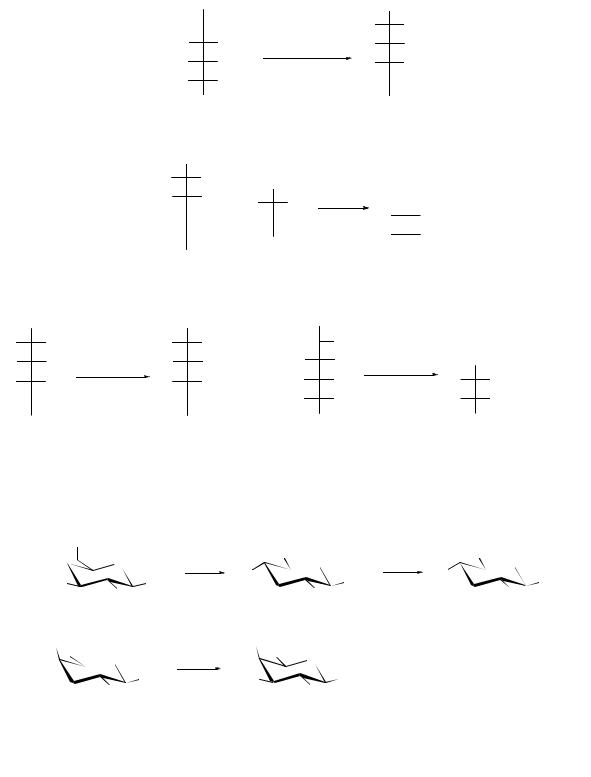
Химические свойства углеводов
По химическим свойствам углеводы, как альдотак и кетоспирты повторяют основные свойства соответствующих функциональных групп – альдегидов, кетонов, первичных и вторичных спиртов, аминопроизводных (аминосахара), но необходимо обращать внимание на условия проведения всех реакций, например:
При осторожном окислении альдоз бромной водой или аммиачным раствором гидроксида серебра альдегидная группа окисляется до кислотной с образованием альдоновых кислот:
кетозы в этих условиях не окисляются.
При взаимодействии с фелинговой жидкостью выделяется закись меди:
При более сильном окислении, например концентрированной HNO3 образуются двухосновные оксикислоты – сахарные (гликаровые):
*- альдоновые и сахарные кислоты, из-за отсутствия карбонильной группы, не способны к цикло-цепной таутомерии.
В циклической форме, при окислении кислородом воздуха в присутствии платинового катализатора или по реакции с бромноватистой кислотой образуются уроновые кислоты:
кетозы в этих условиях не окисляются. 394
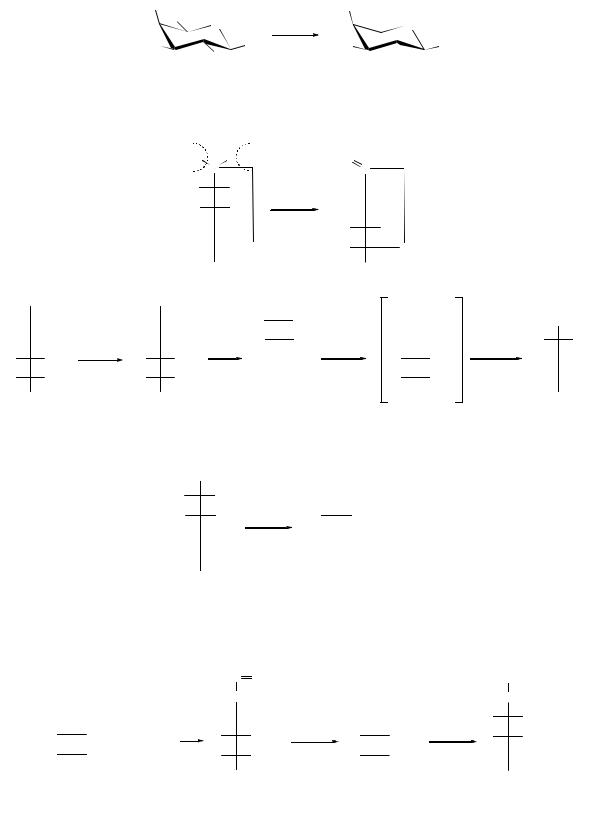
Из особых свойств уроновых кислот наиболее интересна склонность к декарбоксилированию, что дает возможность перехода к низшим сахарам, под влиянием солей некоторых металлов (магния, цинка, алюминия) или микроорганизмов. Так, например, из D-галактуроновой кислоты образуется L- арабиноза:
В циклической форме оновые кислоты также образуют лактоны за счет реакции дегидрирования:
Расщепление по Веерману проходит под действием гипобромита натрия:
По реакции кальциевых солей альдоновых кислот с перекисью водорода
альдоновых кислот с перекисью водорода
вприсутствии солей Fe3+ проходит укорачивание цепи альдоз:
*Различные виды брожения также приводят к укорачиванию углеродной
цепи.
Удлинение цепи альдоз возможно по реакции с синильной кислотой с последующим гидролизом и восстановлением (реакция Килиани):
*Реакции укорачивания и удлинения цепи помогают в определении стереохимической конфигурации моносахаров.
395
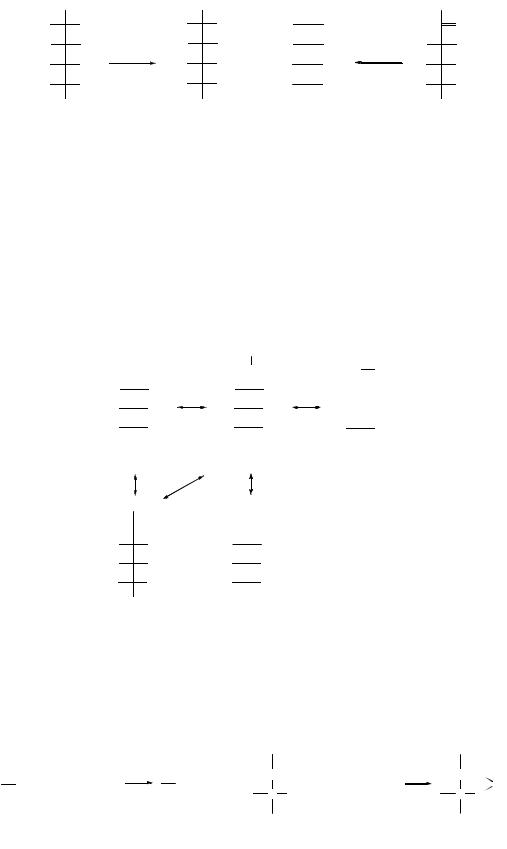
Реакции восстановления проводят в присутствии палладиевых, рениевых, никелевых и платиновых катализаторов:
Эта реакция имеет промышленное значение для получения сорбита, который используется в медицине в качестве заменителя сахарозы для больных сахарным диабетом и как исходный продукт в синтезе аскорбиновой кислоты, а гексанитроманнит – сосудорасширяющее средство.
Под действием разбавленных щелочей (оснований) и температуры проходит изомеризация (эпимеризация).
Процесс взаимопревращений углеводов (например, глюкоза манноза, различия у С2) называют α-инверсией:
Под действием концентрированных растворов щелочей моносахара разлагаются и растворы меняют цвет на бурый.
При действии алкоголятов щелочных, щелочноземельных металлов, меди, бора и др. атомы водорода ОН-групп обмениваются на ионы металлов с образованием сахаратов:
Реакции метилирования в различных условиях и последующего гидролиза позволили подтвердить не только размер циклов, но и особые свойства одного, гликозидного – ОН:
396
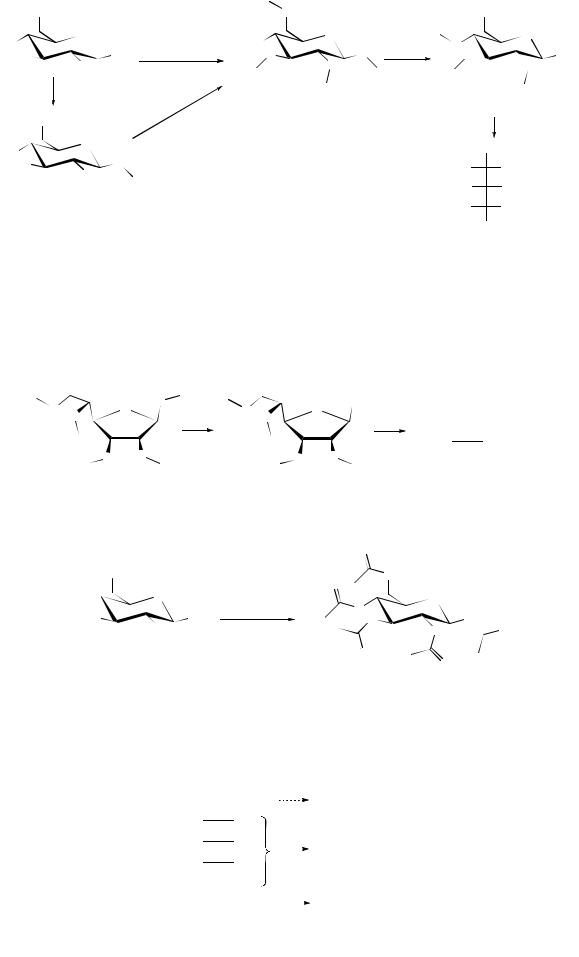
Образование 2,3,4-триметоксиглутаровой кислоты свидетельствует о том, что второй, третий и четвертый атомы углерода не участвовали в образовании
цикла, а это значит, что кислородный мостик был между С1 С5 углеродными атомами, т.е. цикл был шестичленным (пираноза).
Образование 2,3-диметоксиянтарной кислоты свидетельствует о том, что кислородный мостик был С1 С4 , т.е. цикл был пятичленным (фураноза):
При взаимодействии моносахаров или сахаратов с ацилирующими агентами образуются сложные эфиры - пентаацетоксипроизводные:
Метод периодатного окисления. Установлено, что при окислении
многоатомных спиртов йодной (HIO4) кислотой, разрываются связи между каждой парой соседних углеродных атомов, содержащих ОН, а каждая
концевая СН2ОН превращается в Н2СО, тогда как каждая СНОН переходит в НСООН:
при этом HIO4 восстанавливается до HIO3 и по расходу йодной кислоты можно установить число ОН-групп.
397
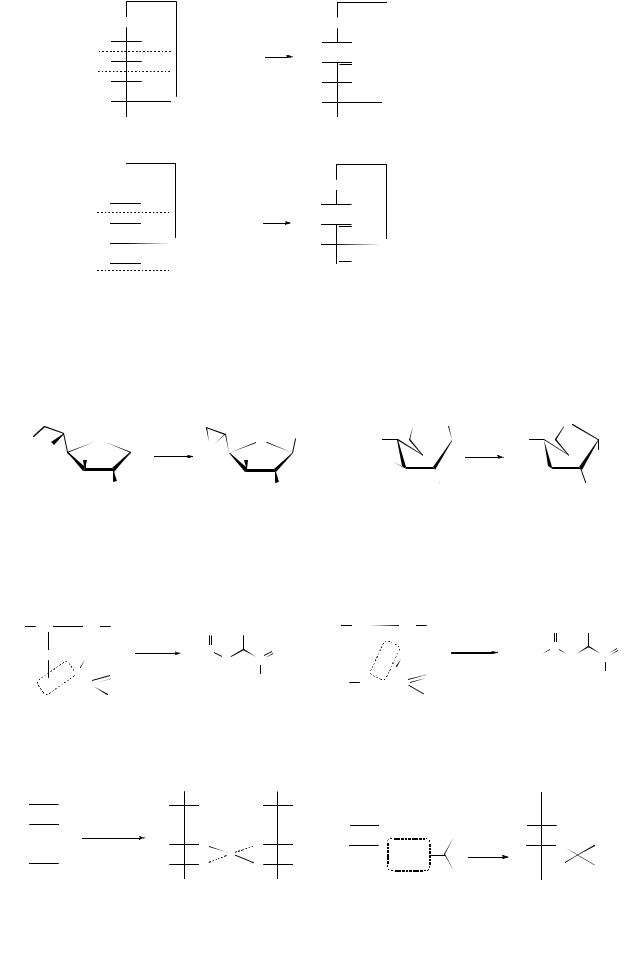
Джексон и Гедсон (1937 г.) показали различия этой реакции, связанные с размерами цикла:
т.е. при одинаковом расходе периодата (2HIO4) в случае пиранозида образуется 1 моль муравьиной кислоты, а в случае фуранозида – 1 моль муравьиного альдегида.
Образование ангидридросахаров проходит в присутствии водоотнимающих средств:
Ангидриды сахаров, гликозаны образуются при нагревании сахаров без добавления спирта, при этом 1,6-ангидриды более устойчивы, чем 1,2- и 1,3- ангидриды.
Отличить все пентозы от всех гексоз можно по реакции дегидратации с образованием циклов:
Для определения расположения ОН-групп у асимметрических атомов углерода проводят реакции с борной кислотой или с гидроксидом меди, а также
сальдегидами и кетонами:
398
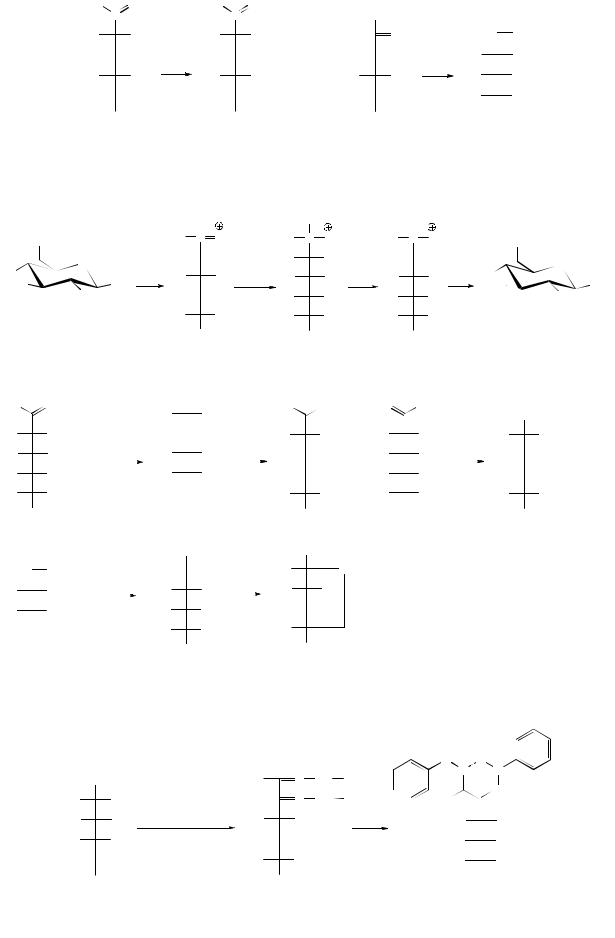
Нуклеофильный обмен кислорода С=О группы возможен при комнатной температуре:
Образование иминов (С=N-) сопровождается появлением окрашивания. Эти реакции используются как качественные в растворе и на хроматограммах.
Реакция с аммиаком и аминами (образование N-гликозиламинов):
Перегруппировка Амадори:
H |
O |
|
|
|
|
|
OH |
|
|
|
H |
NR |
RN |
H |
|
|
|
||
|
|
|
|
H |
NHR |
|
|
|
|
|
CH2-NHR |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H |
OH |
|
1. R-NH2 |
H |
OH |
|
|
|
H |
OH |
H |
OH |
HCl |
H |
OH |
||||
HO |
H |
|
2. Ar-NH2 |
HO |
H |
|
|
|
HO |
H |
+ HO |
H |
HO |
H |
|||||
H |
OH |
|
|
|
|
H |
OH |
-H2O |
|
H |
OH |
H |
OH |
|
H |
OH |
|||
H |
OH |
|
|
|
|
H |
OH |
|
|
|
H |
OH |
H |
OH |
|
H |
OH |
||
|
CH OH |
|
|
|
|
|
CH2OH |
|
|
|
|
CH OH |
|
CH OH |
|
|
CH OH |
||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
2 |
D-глюкоза |
|
|
|
|
|
|
|
|
|
|
|
син- |
|
анти- |
1-алкил(арил)амино- |
||||
|
CH2OH |
|
|
|
|
|
CH2OH |
|
|
|
|
CHO |
|
|
1-дезокси-D-фруктоза |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
O |
|
|
|
Ar-HN |
OH |
|
Ar-HN |
|
O |
|
|
|
|
|||||
HO |
H |
|
Ar-NH2 |
|
HO |
H |
|
HCl |
HO |
H |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||||||||||
H |
OH |
|
|
|
|
H |
OH |
|
|
|
H |
OH |
|
|
|
|
|
||
H |
OH |
|
|
|
|
H |
OH |
|
|
|
H |
|
|
|
|
|
|
||
|
CH OH |
|
|
|
|
|
CH OH |
|
|
|
|
CH2OH |
|
|
|
|
|||
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
2-ариламино- |
|
|
|
|
||
D-фруктоза |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
2-дезокси-D-глюкоза |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Реакция с фенилгидразином сопровождается образованием окрашенных озазонов:
399
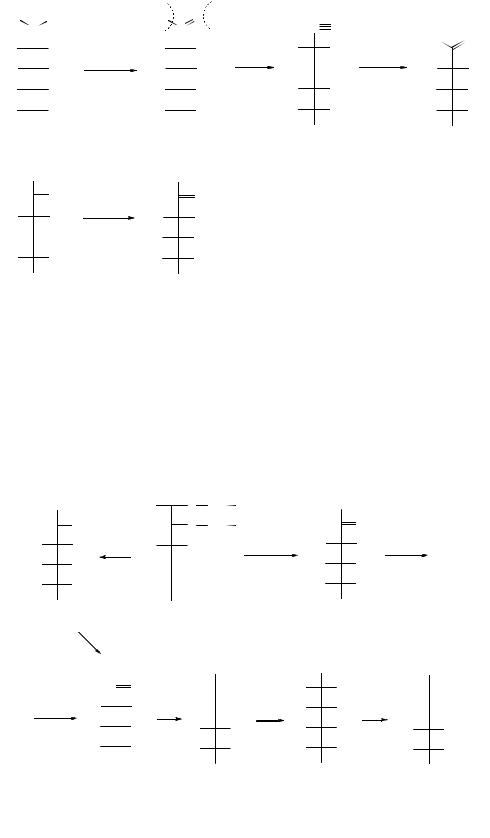
Реакция с гидроксиламином проходит в две стадии с образованием альд(кет)оксимов с возможным последующим укорачиванием углеродной цепи моносахаров:
Эти реакции часто используют при стандартизации и сертификации углеводов, но следует отметить, что D-глюкоза, D-манноза и D-фруктоза дают одинаковый фенилозазон, отсюда вытекает вывод – если 3 гексозы дают один и тот же озазон, то С3-С6 у них одинаковы, и отличаются они только по С2- замещению. На второй стадии реакции два остатка фенилгидразина образуют хелатное шестичленное кольцо, при этом второй С-атом перестает быть асимметрическим.
При восстановлении озазонов цинковой пылью в уксусной кислоте, а затем реакцией с азотистой кислотой из кетоз можно получить альдозы:
таким образом, возможен переход альдозы↔кетозы.
Реакция с тиолами (меркаптанами) проходит в растворе RSН / HClконц. с образованием циклических ацеталей:
400
