
Uchebnik
.pdf
Реакция дезаминирования возможна и в живых клетках под действием оксидаз через стадию образования иминокислот:
Реакция переаминирования:


Названные реакции протекают в животных организмах и в растениях в очень мягких условиях под действием специфических ферментов, как собственных, так и внесенных извне.
С нингидрином аминокислоты дают окрашенные соединения, что используется для обнаружения их на хроматограммах и электрофореграммах; эта реакция дает оттенки фиолетового цвета продуктов взаимодействия с первичной аминогруппой и другие оттенки для вторичного и третичного азота:
Различие в характере аминогруппы проверяют и реакцией с азотистой кислотой:
характере аминогруппы проверяют и реакцией с азотистой кислотой:
Подобно обычным карбоновым кислотам, аминокислоты образуют соли, эфиры, амиды, галогенангидриды, но реагируют труднее алифатических кислот, так как реакции идут по неионизированной карбокси-группе.
С другой стороны, аминокислоты вступают во все реакции, свойственные аминам: образуют соли с минеральными кислотами, в реакции алкилирования и ацилирования, с азотистой кислотой.
С карбонилсодержащими соединениями, например, при рН=9 с хорошим выходом проходит реакция:
291

α-аминокислоты с альдегидами образуют основания Шиффа:
эта реакция используется для количественного  определения аминокислот и белков.
определения аминокислот и белков.
Особенным является отношение разных аминокислот к нагреванию:
Аминокислоты могут давать соли с участием амино- и карбоксигрупп:
Для идентификации аминокислот (свободных и концевых в составе белков проводят реакцию с 1-фтор-2,4-динитробензолом с образованием желтых динитрофенил-аминокислот и выделением НF:
Образование эфиров и ангидридов возможно после предварительной защиты аминогрупп:
При окислительном расщеплении выделяется аммиак, углекислый газ и альдегид соответствующего строения:
Реакция поликонденсации приводит к образованию пептидных связей:
292

возможно образование циклических пептидных связей:
В реакции могут участвовать одинаковые или разные по составу и структуре аминокислоты. Полимеры пептидов α-аминокислот являются белковыми веществами.
Характерным свойством аминокислот является их взаимодействие с металлами с образованием комплексов, которые также имеют биохимическое значение, а темно синие комплексы с ионами меди могут служить для характеристики аминокислот:
Аналогично построены комплексы Zn2+, которые подобно гормону поджелудочной железы, способны повышать содержание сахара в крови.
Аминокислоты расщепляются некоторыми грибами и дрожжами (р.Эрлиха); так, в ходе «аминокислотного» брожения из лейцина получается неактивный амиловый спирт, из изолейцина – оптически активный; из валина – изобутиловый, из глутаминовой – янтарная кислота, например:
В животном организме аминокислоты расщепляются под влиянием
кишечной флоры, например, тирозин превращается в фенол и крезол, триптофан – в скатол или индоксил, причем расщепление протекает через промежуточные стадии:
293

Аминокислоты могут рассматриваться и как детоксиканты, поскольку способны связывать избыточные или ядовитые вещества, например, орнитин связывает бензойную и гиппуровую кислоты и выделяется в виде орнитуровой кислоты:
Диникотиноилорнитин является продуктом связывания орнитина и никотиновой кислоты, хлорбензол связывается с цистеином и выводится из организма, в виде:
HN O
O
S
COOH
Cl

Реакция Курциуса приводит к образованию диазосоединений:
При мягком восстановлении в щелочной среде (закись железа) алифатические диазосоединения превращаются в гидразоны, а в кислой среде выделяется азот, по объему которого во времени судят о силе кислоты:
|
|
N |
|
|
COOC2H5 |
[H] |
|
|
H2N |
|
|
|
|
[H] H N |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
N |
COOC2H5 |
|
|
2 |
N |
|
COOC H |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOR |
+ |
|
|
N |
|
COOC2H5 |
|
|
|
|
|
|
COOC2H5 |
|
||
ROOC |
|
|
|
|
N |
|
|
|
|
ROOC |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
производное |
|||||||||
|
|
эфир фумаровой |
|
|
|
|
|
|
|
|
|
ROOC |
N |
N |
|||||||
|
|
|
|
|
кислоты |
|
|
|
|
|
|
|
|
|
|
|
пиразолина |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
Глицин в виде эфира реагирует с цианатом калия с выделением в осадок гедантоина:
Более тонкими по выполнению являются взаимопревращения аминокислот без вовлечения асимметрического центра:
294
Качественный анализ и идентификация аминокислот возможны методом ИК-спектроскопии. При этом однозначно идентифицировать углеродную цепь не удается, но в спектрах легко идентифицируется форма азота (N, NH, NH2, NH3), С=О, другие функциональные группы и наличие ароматического кольца.
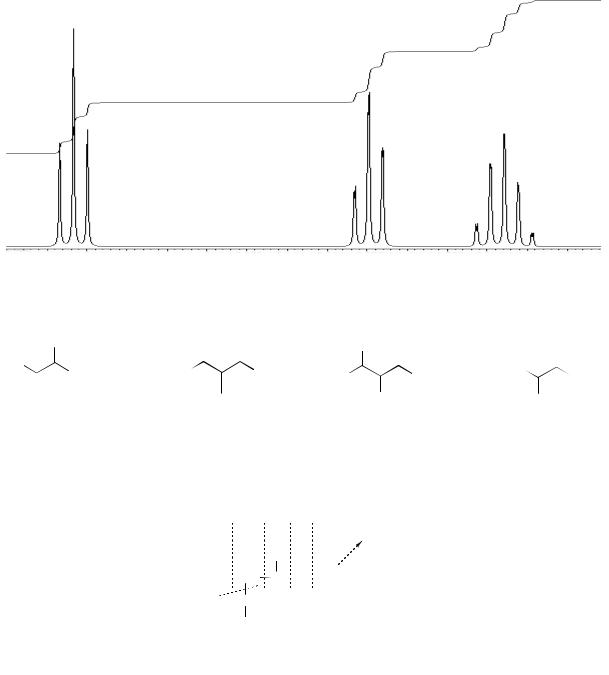
Взаимное расположение амино- и карбоксигруппы легко доказывается спектром ПМР в D2О либо для свободных аминокислот, либо для их эфиров или ацилпроизводных, например, в спектре β-аланина присутствует 2 триплета метиленовых групп, подтверждающих β-расположение функциональных групп:
Следует отметить, что оптические изомеры имеют идентичные спектры, а различия фиксируются на величине КССВ:
Кольцевые фрагменты аминокислот идентифицируют в спектрах 13С-ЯМР. Этиловые эфиры аминокислот имеют характеристические масс-спектры,
например:
Разрыв по связи С-С(1) приводит к появлению интенсивного пика, указывающего на размер R, а осколки по связи С-С(2) на размер R и замещающей группы.
На рисунке представлен масс-спектр сложной аминокислоты из коричневых галлов многих растений:
295

100 |
|
|
|
|
|
|
|
|
84 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
50 |
|
30 |
|
|
58 |
72 |
|
|
|
|
|
|
156 |
|
|
184 |
|
201 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
44 |
|
|
|
110 |
|
|
|
|
|
|
|
|
|
|
|
337 |
|
|
|
||||||||||
|
|
|
|
|
98 |
126 |
|
|
|
|
|
|
227 |
255 |
|
|
|
||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
274 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M/Z |
30 |
50 |
|
70 |
90 |
110 |
130 |
150 |
170 |
190 |
210 |
230 |
250 |
270 |
290 |
|
|||||||||||||||
Строение аминокислот может быть установлено окислительным расщеплением, в результате которого, как было указано выше, углеродный радикал вместе с α-углеродным атомом превращается в соответствующий альдегид, при этом количество выделившегося СО2 указывает на основность, а аммиака - на число аминогрупп исходной молекулы.
Бетаины, белки, качественный и хроматографический анализ, методы идентификации
Бетаины - внутренние соли N-триалкизамещенных аминокислот, являются спутниками амино- и оксосоединений, хорошо растворимы в воде и водно-спиртовых растворах.
Также как аминокислоты, они существуют в виде биполярных ионов, растворимы в растворах щелочей и кислот:
Превращение многих аминокислот в бетаины - процесс, характерный для азотистого обмена многих видов растений, особенно много бетаинов в видах эхинацеи. В растениях обнаружены бетаин гликокола - бетаин, пролина - стахидрин, триптофана - гипофорин, орнитина - миокинин, никотиновой кислоты - триогонемин и др.
Для разделения и анализа бетаин-содержащих субстанций чаще всего используется метод ВЭЖХ на колонках Supelcosil LC-SCX (5мкм) или подобных, используя в качестве подвижной фазы 22 mM раствор холина в 900 мл ацетонитрила и 100 мл воды (УФ детектор, 254 нм).
Метод количественного определения бетаинов, например, в таблетках сухого экстракта травы эхинацеи, включает хроматографирование на жидкостном хроматографе с УФ-детектором по 20 мкл испытуемого раствора и раствора СО бетаина в следующих условиях:
колонка 250х4.0 мм, заполненная сорбентом «Lichrospher-100 RP18», (5мкм), или аналогичная;
подвижная фаза: дегазированная любым удобным способом;
скорость подвижной фазы 1.0 мл/мин;
детектирование при длине волны 192 нм;
296

температура колонки - 400С;
время хроматографирования - 45 мин.
Препараты высокоочищенных бетаинов, белков и пептидов находят разнообразное применение в научных исследованиях, медицине и биотехнологии. Так как многие из этих веществ высоколабильны, их выделение проводят с помощью предельно мягких методов и при пониженной температуре (0-50С). К таким методам относятся диализ, высаливание, гельфильтрация и ионообменная хроматография. Для выделения, разделения и анализа бетаинов, белков и пептидов используется капиллярный электрофорез - СЕ, СЕ/MS, который выполняется на кварцевых капиллярных колонках длиной от 40 см до 1 м в пустотелом капилляре, к стенкам которого приложен отрицательный потенциал, а к его концам накладывается разность потенциалов. Под действием электрического поля начинается движение молекул электролита от анода к катоду, вызывающего общее течение жидкости. При введении в
такую систему анализируемого образца положительно заряженные молекулы анализируемых соединений движутся к катоду быстрее потока жидкости в капилляре, незаряженные молекулы «текут» с потоком, а отрицательно заряженные, удерживаясь положительным зарядом, текут к катоду. Происходит эффективное разделение молекул по зарядам, а идентификация осуществляется по УФ-спектрам или другим подходящим способом (масс-спектрометр-СЕ/MS).
Покрытые изнутри поливиниловым спиртом капилляры минимизируют гидрофобные и электростатические взаимодействия анализируемых соединений со стенками и, кроме того, снижают электроосмотический поток. Покрытие стабильно в растворах с рН от 2.5 до 9.5. Капилляры для капиллярной электрохроматографии (СЕС) обычно заполняются СЕС-Hupersil сорбентом для ВЭЖХ – (силикагелевые частицы размером 3 мкм с привитой фазой, в качестве которой применяются (С8, С18 и фенил) углеводородные цепи). Капиллярная электрохроматография сочетает разделительную способность ВЭЖХ и эффективность капиллярного электрофореза.
Полипептидами условно считают биополимеры, включающие до 100 α- аминокислотных фрагментов, которые делят на:
пептиды, подобные белкам - линейные структуры с α-амидной связью α- аминокислот, преимущественно животного происхождения с гормональной активностью. К пептидным гормонам относятся инсулин (51 аминокислота), секретин (21 аминокислота), адренокортикотропин (34 аминокислоты), пролактин (198 аминокислот), вазопрессин (9 аминокислот) и т.д.
пептиды с нетипичной для белков структурой - содержат амидную связь
вбоковой цепи и состоят из α-аминокислот D-ряда, иногда с фрагментами оксикислот, циклических структур и т.д.
линейные минипептиды - трипептид глутатион (аминогруппа цистеина
соединена с -карбоксигруппой глутаминовой кислоты), селеноцистеин (1 остаток на 1 полипептид):
297

Фрагмент β-аланина входит в состав дипептидов анзерина (антидиуретика, при несахарном диабете) и карнозина, стимулирующего образование АТР и увеличивающего эффект катионного (К, Са, Nа) транспорта:
Циклопептиды - содержат α-аминокислоты D-ряда и модифицированные L-α-аминокислоты грибов и микроорганизмов (антибиотики, токсины, регуляторы транспорта ионов). Из 2-х аминокислот - дикетопиперазины, из 3-х
вприроде не описаны, из 4-х - циклотетрапептиды (фитотоксин грибов), хламодоцин (цитотоксический агент), из 5-ти - пентациклопептиды (молоформин, виомицин, туберактиномицин, капреомин), используемые в лечении туберкулеза.
Циклополипептиды – одна или несколько аминокислот заменены на оксикислоты и имеют в структуре пептидные и сложноэфирные связи (депсипептиды).
Мурамилпептиды впервые описаны в 1974 г и, в настоящие время, стали предметом многочисленных исследований. Это природные пептиды, продуцируемые бактериями, они обладают высокой иммуностимулирующей и противоопухолевой активностью.
По химической природе они представляют собой пептидогликаны из β-
(1 4)- связанной гликановой цепи чередующихся N-ацетилглюкозамина и N- ацетилмурамовой кислоты, поперечно связанной пептидными цепями.
Образованная, таким образом, пептидогликановая сетка и ее фрагменты содержат минимальный структурный компонент N-ацетилмурамил-L-аланил- D-изоглутамин:
В настоящее время разработано несколько путей встречного синтеза мурамил-дипептида и более 800 аналогов с широким спектром терапевтической активности.
Углеводной компонентой в мурамилдипептидах являются производные мурамовой кислоты с изопропилиденовой защитой ОН-групп:
298
Вместо аланинового фрагмента в микобактериях присутствует L-серин, α,ε- диаминопимелиновая кислота, глутамин и D-изоглутамин. Синтезом получены эти и другие молекулы - аналоги мурамилдипептидов.
Белки в высших растениях присутствуют в разном сочетании и количестве. 20 генетически кодируемых аминокислот включаются в состав природных белков в процессе биосинтеза в рибосомах под контролем РНК. Каждый белок в организме уникален и выполняет свои специфические функции. Не являясь взаимозаменяемыми, они синтезируются в организме из аминокислот, которые образуются из других белков в процессе их превращений или распада, расщепления пищевых продуктов, витаминов, БАДов и т.д.
Для белков различают 4 основных типа структур: первичная,
вторичная, третичная и четвертичная. Белки, как и аминокислоты, входят в состав всех живых организмов. Растения синтезируют белки и аминокислоты из углекислого газа и воды в процессе фотосинтеза. Животные, в основном, получают аминокислоты с пищей, а затем синтезируют белки, специфические для своего организма.
Имея большую молекулярную массу, многие из них, тем не менее, растворимы в воде с образованием коллоидных растворов. При нагревании (денатурация), добавлении солей тяжелых металлов, неорганических солей, органических растворителей белки выпадают в осадок.
Для их выделения и очистки используют диализ, электрофорез, ионообменнуюгель- и аффинную хроматографию, лиофилизацию, молекулярные сита и т.д.
Если пептиды чаще всего разделяют в виде их производных, то приступая к разделению белков, необходимо подбирать рН, ионную силу, температуру, электролит и носитель, поскольку от перечисленных условий зависят физикохимические и биологические свойства каждого отдельного белка.
Наиболее распространены отдельные виды белков:
Простые белки:
Альбумины - растворимы в воде, высаливаются 70-100% растворами солей; регулируют содержание воды в плазме, клетках; транспортируют гидрофобные соединения в плазме (жирные кислоты, липиды, гормоны, витамины, билирубин, микроэлементы). Альбумин крови состоит из 550 остатков аминокислот, альбумин молока - из 153, альбумин яйца имеет массу
45000.
Глобулины - спутники альбуминов, нерастворимы в воде, растворимы в слабых кислотах, щелочах, разбавленных солевых растворах. α-глобулины (церулоплазмин) переносят ионы меди в плазме, β-глобулины (трансферин) осуществляют перенос железа, γ-глобулины - это антитела, защитные белки организма.
Гистоны - ядерные белки клеток растений и животных, растворимы в воде с сильно щелочной реакций, осаждаются аммиаком или растворами солей.
299

Проламины - растительные белки (клейковина зерен злаковых), не растворимы в воде, кислотах, щелочах, солевых растворах, растворимы в 70% спирте.
Глутелины - растительные белки (семена злаков), растворимы в слабых щелочах.
Коллаген - основа соединительной ткани.
Эластин - белок соединительной ткани, встречается вместе с коллагеном. Фиброин - основа его полипептидной цепи: глицин, аланин, серин и
тирозин.
Кератины - не растворимы в воде, в растворах щелочей, солей, кислот, органических растворителях, не гидролизуются ферментами.
Сложные белки:
Нуклеопротеины - комплекс белка с нуклеиновыми кислотами (ДН- и РНпротеины)
Фосфопротеины - включают остатки фосфорной кислоты (казеин молока, вителлин яичного желтка, ихтулин икры рыб и некоторые ферменты)
Гликопротеины - содержат фрагменты D-глюкозы, D-галактозы, D- маннозы, L-фруктозы, N-ацетиглюкозамина, N-ацетилгалактозы, сиаловую кислоту и отвечают за иммунологические реакции, выполняют роль смазки в суставах, содержатся в опорных тканях, на поверхности эритроцитов, определяя группы крови.
В составе гликопротеина муцина содержится до 40% углеводов. Лектины - гликопротеины растений - компоненты систем обуславлива-
ющих процессы узнавания и адгезии клеток. Липопротеины - комплексы белков и липидов.
Хромопротеины - окрашенные белки с определенным спектром поглощения (гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза, флавиновые ферменты).
Для обнаружения пептидов, белков и аминокислот используют информативные цветные реакции, которые не являются строго специфичными:
Добавляют 1-2 мл раствора натрия нитрита в кислоте соляной или уксусной, появляется различное окрашивание или окрашивание с выделением паров азота (аминокислоты с первичной и вторичной аминогруппой, алкалоиды, амины):
Добавляют 1-2 мг резорцина и 5 капель кислоты серной концентрированной, нагревают до появления зелено-коричневого окрашивания. Затем добавляют 5 мл воды и 5 мл раствора аммиака, появляется красно-фиолетовое окрашивание, иногда с зеленой флюоресценцией (аминокислоты, амины,
алкалоиды, аминосахара).
Добавляют 1-3 мл 10% раствора кислоты хлороводородной, 1-3 капли 0.1М раствора натрия нитрита, перемешивают, затем добавляют 1-3 мл щелочного раствора β-нафтола, появляется вишнево-красное окрашивание или
300
