
Uchebnik
.pdf
Высшие карбоновые кислоты
К высшим карбоновым кислотам относят кислоты состава CH3-(CH2)n- COOH, например:
n=4 – капроновая, n=6 – каприловая, n=8 – каприновая, n=10 - лауриновая, n=12 - миристиновая, n=14 - пальмитиновая СН3-(СН2)4-СН=СН-СН2-СН=СН-(СН2)7-СООН - линолевая кислота СН3-(СН2)7-СН=СН-(СН2)7-СООН - олеиновая кислота и.т.д.
Природные жировые кислоты характеризуются следующими структурными закономерностями:
1Насыщенные и ненасыщенные жировые кислоты, как правило, имеют четное число атомов углерода и неразветвленную цепь (С16, 18, 20, 22).
2Ненасыщенные жировые кислоты чаще имеют цис-конфигурацию одной или нескольких С=С; транс-олефиновые фрагменты отмечены только в редких жировых кислотах.
3Полиненасыщенные жировые кислоты имеют С=С разделенные метиленовым звеном, сопряженные встречаются очень редко.
Ниже приведены насыщенные и ненасыщенные высшие карбоновые кислоты, которые описаны в составе различных липидов, а часть из них - в свободном виде.
Цифрами по порядку обозначают: количество углеродных атомов в основной цепи, после двоеточия - количество кратных связей (двойных и тройных), затем в скобках указывают положение и характер кратных связей (А- ацетиленовая, Z-цис-конфигурация, Е-транс-конфигурация), например:
СН3-(СН2)12-СООН - миристиновая кислота (14:0) СН3-(СН2)14-СООН - пальмитиновая кислота (16:0) СН3-(СН2)16-СООН - стеариновая кислота (18:0)
В овощах и рыбьем жире найдена арахиновая кислота (20:0) - СН3-(СН2)18- СООН, в масле земляного ореха, семенах репы и горчицы содержится
бегеновая кислота (22:0) - СН3-(СН2)20-СООН; в растениях и жирах морских животных описана лигноцериновая кислота (24:0) - СН3-(СН2)22-СООН; в
морских губках Psendaxinyssa и Desmapsama anchorata содержатся:
В жирах лососевых (Sebastes ap) найдены:
261
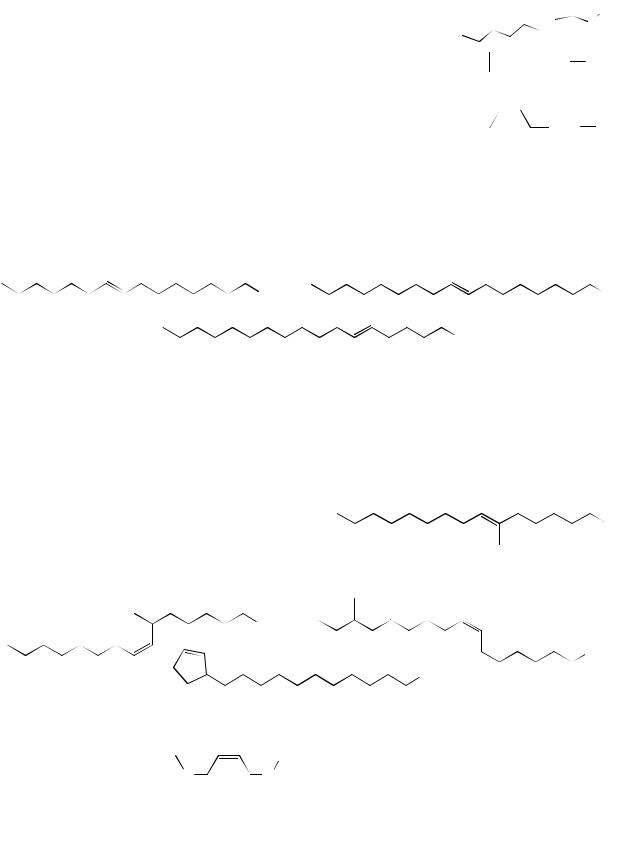
Циклопропановые жирные кислоты, входят в состав липидов растений.
Циклопентановые жирные кислоты, например  дигидрохальмугровая (n=12) содержатся в липидах
дигидрохальмугровая (n=12) содержатся в липидах 
красных водорослей семейства Solieriaceae. |
|
Циклогексановые жирные кислоты |
(n=10, 12) |
найдены в сливочном масле и липидах некоторых 
 микроорганизмов.
микроорганизмов.
Моноеновые кислоты, такие как пальмитоолеиновая кислота 16:1 (9Z) входит в состав жиров морских животных (до 27%), рыбных жиров (до 16%); олеиновая кислота 18:1 (9Z) и петрозелиновая 18:1 (6Z) содержатся в маслах растений семейства зонтичных и аралиевых (кориандр - до 53%, петрушка - до
76%):
Вакценовая кислота 18:1 (11Z и 11Е) Н3С-(СН2)5-СН=СН-(СН2)9-СООН транс-изомер присутствует в сливочном масле, цис-изомер входит в состав липидов многих бактерий.
Элаидиновая кислота 18:1 (9Е) Н3С-(СН2)7-СН=СН-(СН2)7-СООН в небольших количествах содержится в сале жвачных животных, эруковая
кислота 22:1 (13Z) Н3С-(СН2)7-СН=СН-(СН2)11-СООН описана в маслах семян растений семейства крестоцветных, в горчичном - до 53%, в рапсовом до 56%.
7-метил 16:1 (7Е) найдена в составе жира кашалота.
7-метил 16: 1 (8Z) и 14-метил 16: 1 (8Z) выделены из морских губок; хальмугровая кислота - из масла семян Hydnocarpus Wigtinia:
Моноеновая кислота
как продуцент некоторых бактерий, обнаружена в лишайниках Anaptichia ciliaris, Peltigera sp., Umbilicaria deusta и др.
Среди триеновых кислот в свободном виде присутствуют изомерные α- и-линолевые кислоты от 3% и выше.
Полиеновые кислоты лишайников, красных и бурых водорослей представлены значительными количествами кислот, содержащих 4 и 6 С=С сопряженных связей состава от С17 и выше.
262

Фурановые жирные кислоты найдены в липидах рыб, в грибах Agarieus bispous, в водорослях Isochrisis sp. , в плазме крови человека, в некоторых растениях.
R=H, CH3 m=2, 4 n=6, 8, 10.
Мальваловая и стеркуловая кислоты содержатся в масле семян растений семейства Malvaceae,Bombaceae,Tiliaceae:
COOH
|
COOH |
мальваловая кислота |
стеркуловая кислота |
Метиленразделенные полиеновые кислоты. Линолевая кислота 18:2 (9Z, 12Z) и линоленовая кислота 18:3 (9Z, 12Z, 15Z) широко распространены во



 COOH всех маслах, арахидоновая кислота 20:4 (5Z, 8Z, 11Z, 14Z) описана только в животных жирах, в организме образуется из линолевой и линоленовой кислот (витамин F).
COOH всех маслах, арахидоновая кислота 20:4 (5Z, 8Z, 11Z, 14Z) описана только в животных жирах, в организме образуется из линолевой и линоленовой кислот (витамин F).
Кислота 28:8 (4Z, 7Z, 10Z, 13Z, 16Z, 19Z, 22Z, 25Z) Н3С-(СН2-СН=СН)9-
СН2-СООН найдена в нескольких видах морских организмов (Dinoflagellates),
флеиновая кислота 36:5 (4Z, 8Z, 12Z, 16Z, 20Z) Н3С-(СН2)14-(СН=СН-СН2-
СН2)5-СООН найдена в микобактериях.
Сопряженные |
и |
аллен- |
ацетиленовые |
|
Элеостеариновая кислота 18: 3 (9Z, |
11E, |
|||
13E) |
основной компонент тунгового |
|||
масла; punicie acid главная компонента |
||||
масла |
Trichosanthes |
bracteata |
и Т. |
|
nervifolia. |
|
|
|
|
жирные кислоты.
COOH
Оксигенированные жирные кислоты.
12-оксирицинолевая кислота
18:1 (9Z) - основная кислотная ком- 



 понента (до 90%) касторового масла.
понента (до 90%) касторового масла.
8,16-диокси-16:0 - главная липидная компонента огурца
(Cucumis sativus).
10-окси-10:1 (8Е) выделена из съедобных грибов Cantharellus tubaeformis, 13-окси-14:3 (2Е, 4Е, 8Е) выделена из фильтрата культуры Valsa ambiens; (12S)-окси-20:5 (5Z, 8Z, 10E, 14Z, 17Z) - из красных морских водорослей, ингибирует агрегацию бляшек, медиатор возбуждения; 8,13-диокси-18:2 (9Z, 11E) из грибов Filoboletus, обладает противовирусной активностью:
263

7-оксо-18:1 (11Z) выделена из масла зерен Gardenia lucida, 9-оксо-18:1 (11Z) - из масла зерен Lagerstroеmia speciosa, верноловая кислота - из масла зерен Vernolia anthelminitien, 18-окси-цис-9,10-эпокси-18:0 кислота - из листьев Quercus petraeva:
Тетрагидрофурановые |
жирные |
кислоты |
n=5, |
обнаружены в плазме крови человека. |
|
7-14 |
|
Перечень описанных кислот достаточно большой, здесь приведены только примеры их структурного многообразия.
«Необычными» называют кислоты с разветвленной углеродной цепью, с иным, чем в основных кислотах положением и геометрией олефиновых связей, с системой олефиновых и ацетиленовых связей, кислоты, содержащие эпокси-, оксилибо кетогруппы. Жирные кислоты, имеющие в цепи первую двойную связь в положении ∆5, составляют характерную группу необычных неконъюгированных олефиновых кислот, выделенных за последние 50 лет из семян высших растений. Из липидов семян рода Thalictrum выделены моно-, ди- и триеновые кислоты с транс-конфигурацией ∆5 связи и 18 атомами углерода.
Несмотря на определенный прогресс, достигнутый за последние годы, химическая и биологическая роль жирных кислот и построенных на их основе липидов окончательно еще не выяснена. Обращает на себя внимание то обстоятельство, что из огромного разнообразия существующих в природе жирных кислот, а их обнаружено более 600, в том числе и высоконепредельных, отдельные органы и ткани биосинтезируют или кумулируют в липидной фракции клеточных мембран своего растения строго специфические полиеновые кислоты. Полиненасыщенные высшие жирные кислоты служат материалом образования простогландинов и простогландиноподобных веществ, являющихся самыми физиологически активными соединениями природного генеза. Простогландины - это, по существу, ненасыщенные высшие гидроксилированные жирные кислоты, с числом углеродных атомов в цепи 20, характеризующиеся наличием пентацикла в положениях С8-11.
264
Более ценные в биологическом отношении полиеновые высшие жирные кислоты с четырьмя, пятью и шестью изолированными двойными связями в растениях встречаются в крайне низких, а иногда в следовых количествах.
Для получения суммы свободных жировых кислот спиртовый экстракт растений подвергают омылению при нагревании с избытком водного раствора щелочи. После омыления, образец нейтрализуют раствором соляной или серной кислот, дополнительно добавляют (3-5% v/v) водный раствор кислоты фосфорновольфрамовой. Сумму кислот отделяют центрифугированием и/или фильтрованием.
Выделение суммы свободных органических кислот возможно методом анионообменной хроматографии на ионите АВ-17 или подобном. Для этого, при полностью открытом кране колонны вливают 5М кислоту уксусную до положения чуть выше поверхности ионита и промывают 0.1М раствором кислоты уксусной. Выделение свободных органических кислот из спиртового экстракта проводят следующим образом: образец вносят на подготовленный к работе анионит и пропускают со скоростью 1 кап/сек. Затем промывают колонку с такой же скоростью 0.1М раствором кислоты уксусной, а затем водой очищенной. Связанные с анионитом кислоты элюируют со скоростью 1кап/сек 1М раствором натрия сульфата.
Огромное многообразие, входящих в состав растений кислот, затрудняет их хроматографический анализ. В литературе описано множество приборных методик, газовой, газожидкостной и высокоэффективной жидкостной хроматографии природных карбоновых кислот, однако все они значительно отличаются, как по типу применяемого сорбента, так и по составу подвижной фазы, используемой для разделения и анализа веществ.
Общими для всех типов карбоновых кислот растительного происхождения являются ТСХ хроматографические системы:
1бензол-диоксан-уксусная кислота (90:25:4);
2бензол-метанол-уксусная кислота (90:16:8);
3бензол-пропионовая кислота-вода (2:2:1, верхний слой);
42-пропанол-аммиак-вода (8:1:1);
5бензол-уксусная кислота-вода (6:7:3);
6гексан-этилацетат (9:1);
7этилацетат-уксусная кислота-вода (2:1:1).
Для получения наиболее достоверной информации о содержании свободных органических кислот в природных объектах оптимальным является газохроматографический метод. Свободные органические кислоты определяются, в этом случае, в виде этиловых эфиров. С этой целью к спиртовому экстракту растения добавляют раствор внутреннего стандарта например, (глутаровой кислоты в ацетоне). Пробу упаривают до 1 мл в фарфоровой чашке. Остаток смывают в пробирку смесью спирта этилового 96% и кислоты серной концентрированной (6:1), доводят объем раствора до 25 мл водой очищенной, дают отстояться 10-12 часов. Раствор насыщают натрия хлоридом, добавляют этилацетат, перемешивают. Отстоявшийся экстракт отделяют и высушивают небольшим количеством безводного натрия сульфата.
265

Подготовленный таким образом этилацетатный экстракт вводят в испаритель хроматографа. Условия хроматографирования:
колонка HP INNOWAX (30 м х 0.32 м х 0.25 мкм)
температура от 35 до 2300С со скоростью 100С/мин
газ-носитель – гелий
пламенно-ионизационный детектор.
Анализ может быть осуществлен также на капиллярных колонках Stabilwax-DA или Carbowax при температуре 100-1450С с использованием гелия или водорода в качестве газа-носителя или с использованием насадочной колонки, заполненной хроматоном N-AW-DS с нанесенной жидкой фазой – диэтиленгликольсукцинатом (DEgS) 20%.
Способ исследования кислот заключается в предварительной обработке экстракта 0.3 М раствором дибромацетофенона
и дальнейшем анализе производных на колонке Phenomenex Prodigy C8, с использованием подвижной фазы: ацетонитрил-вода 87:13 или 1:1 и УФ детектора (242 нм) либо флуориметра.
Разделяют жирные кислоты после их превращения в метиловые или этиловые эфиры. Однако для идентификации неизвестных жирных кислот удобнее первоначально разделить их на группы, одинаковые по степени ненасыщенности и геометрической конфигурации. Это осуществляется, в основном, ТСХ на носителях, содержащих ионы серебра. Этот метод основан на том, что между ионами серебра и двойными связями в углеводородной цепи образуется комплекс с обратимым переносом заряда, в результате чего происходит фракционирование смесей эфиров жирных кислот, в соответствии с числом двойных связей в молекуле.
Разделение эфиров жирных кислот осуществляется на колонках с силикагелем, пропитанным сульфатом серебра. Элюирование, в этом случае, проводится смесью н-гексан-петролейный эфир-диэтиловый эфир-уксусная кислота (35:12:2:1) при температуре 12-150С. Сульфаминовая кислота не влияет на разделение липидов. Для разделения насыщенных и ненасыщенных жирных кислот используют хроматографию на колонках с кремниевой кислотой, пропитанной нитратом серебра.
ГЖХ – наиболее эффективный метод разделения сложных смесей природных жирных кислот; при этом существуют корреляции между временем удерживания и структурой жирной кислоты. Однако, присутствие в смесях природных жирных кислот большого числа изомеров не позволяет провести полную идентификацию разделенных соединений, поэтому предварительно смеси таких кислот хроматографируют на носителях, содержащих ионы серебра, а затем подвергают ГЖХ-анализу. Для более полной идентификации
266
жирных кислот в настоящее время используют ГЖХ в сочетании с массспектрометрией.
Моно-, ди-, полиеновые жирные кислоты, как правило, разделяют на обычных колонках для ГЖХ, содержащих полярные жидкие фазы (10% EGSS- X, 10% DEGS, 10% TGS) или некоторые неполярные жидкие фазы (10% апиезона L) при постоянной температуре около 2000С.
Для разделения жирных кислот широко используется метод ВЭЖХ. Поскольку обнаружение по поглощению в УФ-области спектра не позволяет уловить малые количества жирных кислот, то вначале используют метод получения производных с сильным поглощением в УФ-области. Среди таких производных наиболее часто используют фенациловые, нитробензоиловые, 2- нафтациловые эфиры и их разделение проводят на колонках с обращенной фазой. В качестве сорбентов используют Лихросорб 10 RP-18 при элюировании ацетонитрилом, μ-Бондапак С18 порасил при элюировании смесью метанолвода, ацетонитрилом, а на сорбенте Лихросорб хибар-II RP-8 в сочетании с элюирующей смесью тетрагидрофуран-ацетонитрил - вода (3:67:30).
Высшие полиненасыщенные жирные кислоты положительно влияют на функцию печени, миокарда, фибринолитическую активность крови, проявляют определенное цитостатическое и, особенно, гипохолестеринемическое действие, причем установлено, что физиологическая активность возрастает с увеличением их ненасыщенности. Например, гипохолестеринемическое действие арахидоновой кислоты, имеющей четыре двойных связи в изолированном положении, в среднем в 3,5 раза превосходит действие линолевой кислоты, имеющей только две двойные связи, а аналогичная активность докозагексановой кислоты, с шестью изолированными двойными связями, почти в пять раз выше. Особенно благоприятный эффект проявляется при совместном воздействии арахидоновой и гексаеновой кислот на функцию сосудов и печени, а также на уровень холестерина в крови. Именно это обусловило внедрение в медицинскую практику препаратов высших жирных кислот, обычным источником которых являются животные и растительные жиры.
Химические свойства природных жирных кислот
Реакции карбоновых кислот с большим числом углеродных атомов мало отличаются от свойств низших карбоновых кислот, если они не содержат дополнительных функций в углеводородной цепи. Их отличает необходимость подбора условий проведения реакций, поскольку отношение жирных кислот к различным растворителям, а особенно к смесям растворителей, весьма специфично по причине их бифильности. Карбоксильная функция (а в случае оксикислот и спиртовая группа) придает молекуле гидрофильный характер, тогда как углеводородная цепочка этих соединений обладает гидрофобными (липофильными) свойствами. Поэтому молекулы жирных кислот имеют тенденцию к локализации на границе раздела фаз, что обеспечивает образование эмульсий, пены и адсорбцию.
267

Наличие карбоксильной группы, как главной функции в молекулах этого класса, обеспечивает соответствующие ей реакции жирных кислот: реакции этерификации, имеющие важное значение в жизнедеятельности практически всех организмов, образование солей, амидов, ангидридов и т.д.
Реакции с бромной водой и с раствором перманганата позволяют отличить насыщенные и ненасыщенные жировые кислоты (обесцвечивание).
В процессах окисления непредельных жирных кислот in vivo (особенно тех, которые содержат несколько олефиновых фрагментов) обращают на себя внимание три основные метаболические реакции: первое - это образование лактонов за счет внутримолекулярного взаимодействия спиртовой и карбоксильной групп; второе – при наличии в молекуле жирной кислоты нескольких спиртовых групп (или спиртовой группы в комбинации с олефиновой) часто реализуются процессы внутримолекулярного образования циклических простых эфиров (как правило, пяти- и шестичленных) и, наконец, реакции окисления жирных полиеновых кислот могут сопровождаться внутримолекулярной карбоциклизацией с образованием циклопропановых, циклопентановых и циклогексановых фрагментов, перемещение олефиновой связи; реакции эпоксидирования; процессы восстановления различных фрагментов; а также декарбоксилирование.
Для жиров (как жидких, так и твердых) характерна высокая степень гидрофобности (липофильности), т.е. они нерастворимы в воде, но хорошо растворимы в углеводородах, галогеналканах, спиртах, эфирах.
Жидкие жиры, т.е. глицериды ненасыщенных кислот (масла), могут быть гидрогенизированы в присутствии катализаторов (Pt, Pd, Ni) до твердых жиров,
врезультате чего происходит превращение остатков ненасыщенных кислот в насыщенные.
Технические жиры используются для получения мыла и глицерина реакцией щелочного гидролиза.
268

Реакция гидрогенизации:
На основе подсолнечного масла и рыбьего жира синтезированы сахароглицериды по реакции переэтерификации триглицеридов сахарозой:
Полученные эфиры обладают противоопухолевой активностью.
Липиды
К производным высших карбоновых кислот относятся не только жиры и масла, но и липиды, простые и сложные эфиры на основе глицерина и других полиолов, стерины и их эфиры, воска, простые и сложные эфиры терпеновых спиртов с высшими жирными кислотами и т.д.
Структурное многообразие липидов обусловлено, в основном, наличием в их составе различных типов высших кислот, отличающихся друг от друга по степени и характеру разветвления углеродной цепи, числу и положению С=С и С≡С связей, количеству и расположению других функциональных групп. Незаменимыми являются линолевая, линоленовая и арахидоновая кислоты, структуры которых приведены выше.
Жиры и масла (глицериды) относят к классу, нейтральных липидов, поскольку они не содержат свободных функциональных групп, обеспечивающих кислотные, либо основные свойства. Другие виды нейтральных липидов, распространенных в природе – это соединения, в которых глицерин образует две сложноэфирные связи и одну связь простого эфира. Функция простого эфира может быть насыщенной (алкилдиацил-глицериды) и ненасыщенной (плазмогены). Такие липиды найдены в различных органах животных (костный и головной мозг, сердце, плазма крови), в яичном желтке и молочном жире, в растениях и микроорганизмах; но более всего их - в морских организмах (звезды, иглокожие, моллюски, некоторые виды рыб).
R1,R2 = фрагменты обычных жирных кислот
R = H-C16H33 – химиловый спирт
H-C18H35 – батиловый спирт
9,10C18H33 – селахиловый спирт
плазмогены : R = -CH=CH-R’ (алкил-виниловые эфиры)
269

Необходимо заметить, что спирты, участвующие в образовании этого вида глицеридов, имеют такой же состав, что и обычные жирные кислоты – факт, указывающий на общность их биосинтеза.
Фосфоглицериды образуются при совместной этерификации глицерина как карбоновыми (жирными), так и минеральными (фосфорной) кислотами. Образующиеся в этом случае фосфатидовые кислоты имеют кислый характер и сохраняют возможность последующих этерификаций.
Y= -H (фосфатидовые кислоты)
-CH2-CH2-NH2 (кефалины) -CH2-CH2-N+(CH3)3 (лецитины)
-CH2-CH(NH2)-COOH (фосфатидил-серины)
-CH2-CH(OH)-CH2OH (фосфатидил-глицерины)
(фосфатидил-инозиты)
Фосфатидилхолин (лецитин) часто составляет до 50% от суммы всех фосфоглицеридов и содержится в клетках растений и высших животных.
Фосфатидилэтаноламин (кефелин) составляет 15-30% от суммы фосфолипидов также содержится в клетках различных растений, в головном и спинном мозге, в мышцах.
Фосфатидилсерин служит регулятором активности многих ферментов, локализованных в мембранах клеток.
Фосфатидилинозитол присутствует во многих растительных клетках, в животных тканях и в мозге млекопитающих.
Кардиолипин – компонент сердечной мышцы и многих растительных клеток.
Гидролиз фосфолипидов в клетках проходит с участием различных фосфолипаз до глицерина, жирных кислот, спиртов или аминоспиртов и фосфорной кислоты.
Вне организма фосфолипиды расщепляются, как и другие сложные эфиры, при нагревании в кислой или щелочной среде.
Разнообразную группу липидов под общим названием сфинголипиды, образуют длинноцепочечные аминоспирты – сфингонин, сфингозин и фитосфингозин. Указанные аминоспирты содержат алкильную цепочку от 12 до 22 атомов углерода. Сфингозины животных имеют олефиновую связь в
270
