
Uchebnik
.pdf
Присоединение бисульфита:
Реакция с реактивом Гриньяра (наращивание углеродной цепи):
Расщепление углеродной цепи сахаров под влиянием щелочей при нагревании, называют ретроальдольный распад, как реакция, обратная альдольной конденсации:
Для изучения строения и конформаций моносахаров используют и физические методы:
поляриметрический метод позволяет определить угол и знак вращения плоскости поляризованного света [α]D= +(-)(+-)(растворитель);
для сравнения оптической активности различных веществ используют
молекулярное вращение [М]D=М[α]D/100, где М - молекулярная масса вещества;
401
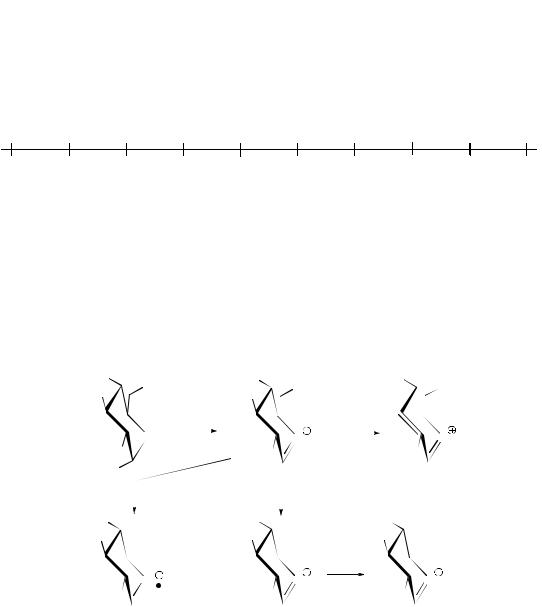
озотриазольное правило позволяет определить конфигурацию С3. Если озотриазол, полученный окислением фенилозазона правовращающий, то С3 имеет D-конфигурацию и наоборот;
лактонное правило Хадсона позволяет установить конфигурацию С4 и
С5-атомов;
дисперсия оптического вращения и круговой дихроизм;
ИК-спектроскопия позволяет установить размер цикла (пиранозные кольца поглощают в области770±14 и 914±13 см-1; фуранозные -799±17 и 924±13см-1); α- и β-фуранозиды имеют мало отличающиеся ИК-спектры,
экваториальное положение связи С1-H характеризуется поглощением в области
844±8 см-1(β), аксиальное – 891±7см-1 (α);
ЯМР-спектроскопия позволяет определить многие структурные особенности сахаров:
J=7-10 Гц наблюдается при транс-диаксиальных протонах; J=7-8 Гц – позволяет отличить аксиальный аномерный протон (дублет 4.74 м.д.) в пиранозах от экваториального протона (дублет 5.32 м.д.), (J=3-4 Гц), т.е. α- и β- формы;
13С-ЯМР позволяет определить число С-атомов в молекуле и идентифицировать аномерный атом углерода (88-102 м.д.), другие – 116-133 м.д.;
15N – используют для идентификации аминосахаров;
масс-спектрометрия дает меньше информации, однако расщепление
циклических форм имеет некоторые особенности:
H3CO |
OCH3 |
H CO |
OCH |
H CO |
OCH |
H3CO |
3 |
3 |
|||
|
H CO |
3 |
|
3 |
|
|
|
3 |
|
|
|
|
O - |
|
|
|
O |
|
|
|
|
|
|
|
|
O |
||||||
OCH |
|
|
|
- |
|
|
|
|||||||||||||
3 |
|
CH OH |
|
|||||||||||||||||
H3CO |
H CO |
3 |
|
|
H CO |
|||||||||||||||
H3CO |
3 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|||||||
m/z 219 |
|
|
|
|
|
|
m/z 187 |
|||||||||||||
|
- CH2OCH3 |
|
|
|
|
|
|
|||||||||||||
|
|
- CH2O |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
H3CO |
H3CO |
|
|
|
|
H3CO |
||||||||||||||
H3CO |
H3CO CH |
|
|
|
H3CO |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
- CH3 |
|
|
|
|
|
||||
H3CO |
H3CO |
|
|
|
|
|
H3CO |
|||||||||||||
m/z 174 |
m/z 189 |
|
|
|
|
|
|
m/z 175 |
||||||||||||
рентгеноструктурный анализ позволяет наиболее точно определить геометрию молекул, конформационные особенности сахаров.
402

СЛОЖНЫЕ САХАРА (n=2 ÷10) – олигосахара
Наиболее распространены дисахара (биозы): восстанавливающие и не восстанавливающие, например:
тип трегалозы (грибной сахар): α-D-глюкопиранозил-(1 1’)-α-D-глюко- пиранозид (не восстанавливающий сахар):
тип мальтозы (солодовый сахар): β-D-глюкопиранозил-(1 4’)-D- глюкоза (восстанавливающий сахар):
тип гентиобиозы: β-D-глюкопиранозил-(1 6’)-D-глюкоза (восстанавливающий сахар):
HO |
OH |
O |
|
|
|
||
HO |
O |
|
|
|
O |
|
|
|
HO |
|
|
HO |
|
OH |
|
HO |
OH |
||
|
|
|
тип сахарозы: α-D-глюкопиранозил-(1 2’)-β-D-фруктофуранозид (не восстанавливающий сахар):
трисахариды:
ПОЛИСАХАРИДЫ:
крахмал (1 4’-α-глюкозы - амилоза + 1 6’-α-глюкозы - амилопектин);
инулин (1 2’-β-D-фруктозы);
пектин (D-галактуроновые кислоты);
целлюлоза (1 4’-β-D-глюкозы).
403
т.е. все сложные сахара (ди-, три-,….олиго-, поли-) образуются из моносахаров: одинаковых (гомо-) или разных (гетеро-) с отщеплением молекул воды из пары -ОН групп.
-если это 1 1’ тип связи альдоз, или 1 2’ тип связи кетоз – это группа не восстанавливающих сахаров;
-другие типы связей образуют восстанавливающие сахара:
Восстанавливающие |
Не восстанавливающие |
Один свободный гликозидный |
Не может перейти в открытую |
гидроксил СОН (>С=О) |
карбонильную форму |
Идет реакция с Ag2O Ag↓ и с |
Не дает реакций с Ag2O и Cu(OH)2 |
Cu(OH)2 Cu2O↓ |
|
Идут все реакции моносахаров по |
Не дает реакций по С=О группе |
С=О группе |
|
Мутаротируют |
Не мутаротируют |
В настоящее время описано более 300 олигосахаров природного происхождения (животные, растительные) с точно установленной структурой, которые образуются из моносахаров или являются продуктами расщепления полисахаридов.
Описаны также олигосахара, состоящие из остатков моносахаров, аминосахаров и уроновых кислот, а также из метоксипроизводных.
Из индивидуальных моно- и олигосахаридов используются глюкоза, фруктоза, лактоза и сахароза. Будучи энергетическими веществами, моно- и олигосахариды, как правило, применяются в качестве наполнителей при изготовлении различных лекарственных форм. Источниками их получения являются сахарный тростник, свекла, виноград, гидролизованная древесина ряда хвойных и древесных покрытосеменных.
Для разделения и качественного анализа моно-, олиго- и полимерных сахаров используют различные хроматографические методы. Если для идентификации мономерных сахаров часто достаточным является проведение лишь сравнительного качественного хроматографического анализа на бумаге или в тонком слое с аутентичными образцами, то для непосредственного анализа смеси высокомолекулярных веществ (олиго- и полисахаридов), в виду ограниченной растворимости этих веществ в органических растворителях, эти методы не применимы.
Выбор хроматографической системы для анализа мономерных сахаров на бумаге определяется природой этих компонентов, чаще всего применяют следующие системы: н-бутанол-уксусная кислота-вода (5:2:1), н-бутанол- этанол-вода (4:1:5) или н-пропанол-этилацетат-вода в соотношении 7:1:2. Для сахарных кислот наиболее пригодны системы: н-бутанол-уксусная кислотавода в соотношении 4:1:5, н-пропанол-метилбензоат-муравьиная кислота-вода в соотношении 7:3:2:5, а для лактонов - н-бутанол-этанол-вода (4:1,1:1,9). Дезоксисахара чаще всего разделяют в системе: н-бутанол-этанол-вода (4:1:5),
404
ангидриды сахаров в системах: н-бутанол-пиридин-вода в соотношении 3:2:1 или этилацетат-пиридин-вода (25:8:7). Для разделения аминосахаров, чаще всего, применяют щелочные системы, в которых аминосахара продвигаются медленнее, чем соответствующие им незамещенные сахара. Наиболее применимой системой является коллидин, насыщенный водой; эта система пригодна для отделения глюкозамина от галактозамина. Приемлемой может оказаться также система: пиридин-этилацетат-уксусная кислота-вода (5:5:1:3). Для разделения альдоз, кетоз и их метильных производных применяют систему н-бутанол-этанол-аммиак-вода в соотношении 4:10:1:49 или н-бутанол-этанол- вода в соотношении 5:1:4.
При ВЭЖХ анализе олиго- и полисахаридов используют силикагели со средним диаметром частиц (5-10 мкм), с которыми химически связана неполярная фаза, например, октадецилсилильная (Сферисорб ODS-2, Нуклеосил 100-C18, Vydac C18, Bondapak C18 и др.), полярные фазы, амино-
пропилсилильные (Lichrosorb NH2, μ-Bondapak NH2 и др.).
В полисахаридах возможна примесь белков, которые удаляют обработкой 5-10% трихлоруксусной кислотой. Образующийся белковый коагулят отделяют центрифугированием, а затем из раствора полисахариды осаждают спиртом.
Более мягким является метод Севага: при обработке полисахарида хлороформом с амиловым спиртом, белок собирается на поверхности раздела хлороформ – водный раствор.
ДЭАЭ-целлюлоза и целлюлоза Эктеола позволяют отделить нейтральные и кислые полисахариды. Эта же задача может быть решена методом электрофореза, кроме того, кислые полисахара можно поделить по степени их кислотности.
УСТАНОВЛЕНИЕ СТРОЕНИЯ СЛОЖНЫХ САХАРОВ проводят комплексом перечисленных ниже реакций:
1 Кислотный гидролиз осуществляют 1-7% водными или водноспиртовыми растворами хлороводородной или серной кислот при температуре 90-1000С. Скорость гидролиза О-гликозидной связи фуранозных форм во много раз выше пиранозных форм. Продукты гидролиза идентифицируют методами БХ или ГЖХ в сравнении со стандартными образцами.
Размер окисного цикла определяют по реакции гидролиза 0.1% НСl на кипящей водяной бане, при этом О-гликозидная связь фуранозидов гидролизуется через 2-10 минут.
Щелочной гидролиз используется для установления порядка связи и
дает возможность отличить 1 2 от 1 3, 1 6; 1 3 связь расщепляется быстро, 1 4, 1 6 – значительно труднее.
Ферментативный гидролиз применяется для определения конфигура-
ции гликозидной связи:
-для α-гликозидных связей специфична мальтаза дрожжей;
-для β-эмульсин сладкого миндаля, фермент улитки.
β-гликозидаза миндаля специфична к β-связи, но малоспецифична, относительно порядка связи.
405

Глюкоамилаза специфична к α-D- 1 4, 1 3 и 1 6 гликозидным связям. Рамнодиастаза специфична при расщеплении 1 6 порядка связи и т.д.
2Метод метилирования дает возможность определить:
размер окисного цикла;
порядок связи между сахарами;
степень ветвления в олиго- и полисахаридах;
степень полимеризации.
При этом все свободные ОН-группы переводятся в ОСН3 под действием диметилсульфата в присутствии поташа или йодистого метила в присутствии оксида серебра.
Для полисахаридов предпочтительнее реакция с диметилсуфоксидом, с гидридом натрия (метод Хакомори), и метод Бовина, Несмеянова, Хорлина, в котором взрывоопасный гидрид заменен третичным бутилатом калия:
Метод Пудри – взаимодействие сахаров с CH3I / Ag2O при нагревании, в настоящее время используется для дометилирования или получения перметилатов.
Метод Хеуэрзса – алкилирование диметилсульфатом в 30% водном растворе NaOH при комнатной температуре или при охлаждении, может сопровождаться гидролизом сложноэфирных связей, поэтому вместо NaOH целесообразнее использовать поташ.
Метод Куна – объединяет указанные выше методы, но вместо водной среды используется диметилформамид или диметилсульфоксид для обеспечения гомогенной среды:
406

После гидролиза гликозидных связей образуются метоксисахара и свободные ОН-группы, которые были задействованы в гликозидных связях. Исходные метилированные сахара и продукты их гидролиза анализируют методами БХ, ТСХ, ГЖХ, ВЭЖХ, спектральными методами, реакцией периодатного расщепления.
Периодатное окисление олигосахаров, как и окисление моносахаридов в определенных условиях проходит строго количественно, при этом разрываются С-С связи, несущие α-диольные группы диальдегид; 1 моль HIO4: при наличии вицинальной три ОН-группировки, средний С НСООН и образуется диальдегид: 2 моля HIO4: СН2ОН НСОН, 1 моль HIO4.
Поляриметрия используется для определения конфигурации аномерного центра и размера окисного цикла:
(+)-вращение (-)-вращение = инверсия (изменение не только величины угла [α], но и направления вращения).
Определение конфигурации гликозидных связей проводят также расчетом удельного вращения и ферментативным гидролизом.
МD = [α]D • М /100, но этот метод непригоден для много компонентных олигосахаров с различными конфигурациями связей.
Ферментативный гидролиз проводят при взаимодействии с α- и β- гликозидазами.
Конформации олигосахаров устанавливают рентгеноструктурным анализом.
Полисахариды в различных количествах присутствуют во всех растениях и, как указано выше, извлекаются водой (кроме клетчатки), водными спиртами, другими водно-органическими растворителями при нагревании.
Для кислых полисахаридов (сульфатированных) используют разбавленные минеральные кислоты, которые вытесняют их из соответствующих солей.
Концентрированные горячие растворы щелочей, наряду с извлечением полисахаридов, высаживают белки (альбуминаты) и продукты щелочного расщепления других групп соединений, не осаждающихся спиртом. Недостатком метода является частичная деполимеризация полисахаридов.
Нейтральные полисахара осаждают растворами солей, например
(NH4)2SO4.
Альгиновую и пектовую кислоты осаждают растворами гидроксидов бария или кальция. Этот метод позволяет разделять кислые и нейтральные полисахара.
Они могут быть в свободном состоянии или в составе гликозидов. Полисахариды гомо-, гетеро-, зоо-, фито- и полисахариды микробов –
высокомолекулярные соединения углеводов, поэтому некоторые из них
407

набухают в теплой воде (крахмал), образуют полуистинные и коллоидные растворы (слизи, пектины, камеди):
Инулин – растворимый в воде высокомолекулярный фруктозан ((С6Н10О5)n
имономер - β-D-фруктофураноза), накапливающийся, главным образом, в подземных органах (одуванчик, цикорий, девясил, топинамбур и др.).
Слизи по химической природе близки к камедям, но отличаются значительным преобладанием в них пентозанов и хорошей растворимостью в воде (солома, оболочки семян, лишайники, меньше – в древесине).
Полисахариды обладают высокой противовоспалительной и иммуномодулирующей, противоопухолевой и антиметастатической активностью, играют существенную роль в обмене веществ. Характер биоактивности и ее величина зависят от их природы (гомо- и/или гетерополисахариды).
Раствор крахмала при нагревании с кислотами гидролизуется до мальтозы
иглюкозы, инулина – до β-D-фруктофуранозы, слизи – до пентозанов. Животные организмы запасают глюкозу в виде животного крахмала -
гликогена, откладывающегося в печени и мышцах.
Гликоген в горячей воде образует коллоидный раствор, не восстанавливает фелингову жидкость, при добавлении йода приобретает окраску от фиолетовокоричневой до фиолетово-красной, вращает плоскость поляризации вправо, гидролизуется в кислой среде до глюкозы.
Во время работы мышц, содержание в них гликогена уменьшается, а углевод в его составе разрушается до молочной кислоты (усталость мышц).
Инулин получают из клубней георгин, топинамбура (земляная груша), артишоков, подземных органов др. растений, особенно семейства сложноцветных.
Инулин растворим в воде с образованием коллоидных растворов, не восстанавливает фелингову жидкость, [α]D -400, при кислотном и ферментативном (индулаза) гидролизе образует D-фруктозу:
Целлюлоза растворима только в концентрированных HCl, H3PO4 и 72% H2SO4, в реактиве Швейцера (раствор соли двухвалентной меди в аммиаке). При обработке целлюлозы «нитрующей» смесью получают азотнокислые эфиры:
408

Смесь продуктов нитрования целлюлозы с содержанием азота более 13% называется пироксилином (взрывчатка), используемым также в производстве бездымного пороха. Нитрат целлюлозы с 11% содержанием азота называют коллоксилином, а его раствор в смеси эфир : спирт – коллодий используется в
медицине. |
|
|
|
|
|
|
|
|
|
|
Пектиновые |
вещества – |
полисахара |
плодовых |
соков |
|
OH |
|
|
|
|
(фруктовое желе) |
и овощей |
– полимеры |
галактуроновой |
|
|
|
O |
|||
|
|
|
|
|||||||
|
|
COOCH3 |
||||||||
кислоты и ее метилового эфира используют при авитаминозе, |
|
|
||||||||
|
|
|
|
|
||||||
отравлениях, для |
получения |
плазмы |
крови. Они |
также |
HO |
|
O |
|||
обладают противоопухолевой активностью: |
|
|
|
|||||||
|
|
|
|
|
|
|
||||
Пектины, имея близкие по строению молекулы, |
|
O |
|
|
|
|||||
отличаются большим разнообразием структур, блочным HO |
|
COOH |
||||||||
построением макромолекул, нерегулярностью и сложностью. |
|
|
O |
|||||||
Считается, что пектины принадлежат |
к |
числу наиболее |
|
|
||||||
HO |
|
|
|
|||||||
сложных биогликанов. В их структуре различают две области: |
|
|
|
|||||||
|
|
|
|
|
||||||
линейную и разветвленную. |
|
|
|
|
|
|
|
|
|
|
Линейная область у большинства пектинов представлена галактуронаном, |
||||||||||
участки различной длины которого связываются между собой через один или два остатка -1,2-L-рамнопиранозы. Остатки галактуроновой кислоты могут быть частично или полностью метоксилированы по СООН-группам. Степень метоксилирования оказывает существенное влияние на гелеобразующую способность и физиологическую активность пектинов.
Разветвленная область пектинов чаще всего представлена одним или несколькими блоками рамногалактуронана-I (RG-I), реже присутствуют блоки рамногалактуронана-II (RG-II), апиогалактуронана и ксилогалактуронана.
Разработан общий метод выделения пектинов и проведено изучение строения и свойств следующих пектиновых полисахаридов: силенана из смолевки обыкновенной Silene vulgaris, танацетана из соцветий пижмы обыкновенной Tanacetum vulgare (оба полисахарида в качестве разветвленной области содержат RG-I); зостерана из морских трав сем. Zosteraceae и лемнана из ряски малой Lemna minor (оба пектина содержат блоки RG-I, апиогалактуронана и ксилогалактуронана).
Уникальный блок апиогалактуронана обнаружен только в этих двух пектинах, он характеризуется устойчивостью к действию пектинолитических ферментов, что обусловливает резистентность морских трав к процессам гниения и разложения. Не исключено, что блок апиогалактуронана играет существенную роль в поддержании водно-солевого режима морских трав и ряски, а также способствует их устойчивости к водным условиям обитания благодаря формированию дополнительной сетчатой структуры, что сопровождается образованием высокомолекулярных гидрофильных молекул, способных удерживать большие количества внутримолекулярной воды.
409
Взостеране фрагмент апиогалактуронана имеет разветвленную структуру,
вкоторой одиночные остатки D-апиозы присоединены во 2-, 3- и 2,3- положения остатков D-галактуроновой кислоты. Апиогалактуроновый блок лемнана отличается наличием не только одиночных остатков D-апиозы, но и
более длинных боковых цепей из двух или трех остатков -1,5-связанной D- апиофуранозы, которые присоединены 1,3-связями. Фрагмент апиогалактуронана составляет в обоих случаях около 25% макромолекулы пектина.
Зостеран нашел применение в качестве лечебной пищевой добавки, исследовано противоязвенное действие зостерана, обеспечивающего защиту эпителия желудка от протеолитического действия желудочного сока и ускоряющего заживление язвенных эрозий. Интересна также способность зостерана ликвидировать диспепсию и нормализовать деятельность желудочнокишечного тракта.
Зостеран обладает радиозащитным действием, повышая на 25% выживаемость животных (мыши), подвергнутых смертельному -облучению. При сочетанном действии зостерана с кверцетином выживаемость мышей превышает 50%. Благодаря мощным сорбционным свойствам зостеран способствует удалению радионуклидов из организма человека и животных (ускоряет их выведение и снижает содержание радиоактивных цезия и стронция на 20-30% и на 30-40% соответственно). Кроме того, он является антидотом при интоксикации ионами тяжелых металлов: препятствует накоплению в организме ионов свинца, ртути, олова, цинка и т.д. и способствует их выведению из самых различных тканей организма, снижая общие симптомы интоксикации, улучшает картину крови, прекращает выпадение волос, нормализует работу желудочно-кишечного тракта.
Экспериментально показана способность зостерана увеличивать продолжительность жизни экспериментальных животных на 30-40%, что сопровождается нормализацией липидного обмена у старых животных.
Найдено, что зостеран и лемнан проявляют гиполипидемическое действие, снижая в крови уровень холестерина и липопротеинов низкой плотности, обусловливающих развитие атеросклероза.
Лемнан оказывает выраженное гастропротективное действие при нейрогенном и химическом поражении слизистой оболочки желудка, которое проявляется в заметном уменьшении числа и размеров образующихся язвенных участков. При этом он нормализует энергетический баланс, снижая дефицит АТФ и гликогена и ликвидируя избыток лактата.
Пектины обладают иммуномодулирующим действием, в частности стимулируют фагоцитоз. Кроме того, зостеран и лемнан усиливают интенсивность реакции гиперчувствительности замедленного типа. Показано также, что зостеран стимулирует гуморальный иммунитет, увеличивая число антителообразующих клеток и обусловливая снижение роста неоплазм.
Хитин – сложный полисахарид грибов, лишайников, моллюсков, червей, бактерий и т.д. Относительно чистый хитин выделен из оболочки омаров и крыльев майского жука.
410
